Students get through AP Inter 2nd Year Chemistry Important Questions 7th Lesson d, f – బ్లాక్ మూలకాలు & సమన్వయ సమ్మేళనాలు which are most likely to be asked in the exam.
AP Inter 2nd Year Chemistry Important Questions 7th Lesson d, f – బ్లాక్ మూలకాలు & సమన్వయ సమ్మేళనాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
పరివర్తన మూలకాలు అంటే ఏమిటి? ఉదాహరణలు ఇవ్వండి.
జవాబు:
పరమాణు స్థితిలో గాని లేదా సాధారణ ఆక్సీకరణ స్థితిలో ఉన్న అయాన్లలో గాని అసంపూర్తిగా నిండిన ఆర్బిటాల్లు ఉన్న మూలకాలను పరివర్తన మూలకాలు అని అంటారు.
ఉదా: క్రోమియం (Cr) (Z = 24) : [Ar] 4s¹3d5
కాపర్ (Cu) (Z = 29) : [Ar]4s¹3d10
ప్రశ్న 2.
3d, 4d మరియు 5d శ్రేణులలో ఏయే మూలకాలను పరివర్తన మూలకాలుగా పరిగణించరు?. ఎందువల్ల?
జవాబు:
3d శ్రేణిలోని Zn, 4d శ్రేణిలోని Cd మరియు 5d శ్రేణిలోని Hg మూలకాలు వాటి పరమాణు స్థితిలోను వాటి సాధారణ ఆక్సీకరణ స్థితిలోను పూర్తిగా నిండిన d- ఆర్బిటాల్లు ఉంటాయి. కాబట్టి వాటిని పరివర్తన మూలకాలుగా పరిగణించరు.
ప్రశ్న 3.
d-బ్లాక్ మూలకాలను పరివర్తన మూలకాలు ఎందుకు పిలుస్తారు?
జవాబు:
d – బ్లాక్ మూలకాల ధర్మాలు s మరియు p బ్లాకు మూలకాల ధర్మాల మధ్యస్తంగా ఉంటాయి. కాబట్టి d – బ్లాక్ మూలకాలను పరివర్తన మూలకాలు అని పిలుస్తారు.
ప్రశ్న 4.
పరివర్తన మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసాన్ని రాయండి.
జవాబు:
(n-1)d1-9 ns1 or 2
ప్రశ్న 5.
పరివర్తన మూలకాల ఎలక్ట్రాన్ విన్యాసానికి, పరివర్తన మూలకాలు కాని వాటి విన్యాసంతో ఏ విధమైన భేదం ఉంటుంది.
జవాబు:
పరివర్తన మూలకాలు అసంపూర్తిగా నిండిన d- ఉపకక్ష్యలను కలిగియుండును. వాటి ఎలక్ట్రాన్ విన్యాసము (n-1)d1-9 ns1-2.
పరివర్తన మూలకాలు కాని వాటిలో d- ఉపకక్ష్యలు ఉండవు లేదా పూర్తిగా నిండినd- ఉపకక్ష్యలు ఉంటాయి. మరియు బాహ్య స్థాయి ఎలక్ట్రాన్ విన్యాసం. ns1-2 లేదా ns² np1-6 గా కలిగి ఉంటాయి.
![]()
ప్రశ్న 6.
క్రోమియం(Cr) మరియు కాపర్ (Cu) ల ఎలక్ట్రాన్ విన్యాసాలను రాయండి.
జవాబు:
క్రోమియం (Cr) (Z = 24) : [Ar] 4s¹3d5
కాపర్ (Cu) (Z = 29): [Ar]4s¹3d10
ప్రశ్న 7.
పరివర్తన మూలకాలు విలక్షణ ధర్మాలను ప్రదర్శించడానికి కారణం ఏమిటి?
జవాబు:
ఒంటిరి (జతకూడని) డి-ఎలక్ట్రాన్లు ఉండటం వల్ల పరివర్తన మూలకాలు విలక్షణ ధర్మాలను ప్రదర్శిస్తాయి.
ప్రశ్న 8.
స్కాండియం పరివర్తన మూలకం. కానీ జింక్ కాదు. ఎందువల్ల? [IPE ’14][AP 19]
జవాబు:
Sc[Ar]3d¹4s² లో బాహ్య కక్ష్యకు ముందు కక్ష్య (n−1)d లో జత కూడని ఎలక్ట్రాన్లు ఉండుట వల్ల స్కాండియం పరివర్తన మూలకము.
కాని Zn[Ar]3d104s² లో బాహ్యకక్ష్యకు ముందు కక్ష్య (n−1)dలో లేక పోవుట వలన ఇది పరివర్తన మూలకము కాదు.
ప్రశ్న 9.
సిల్వర్ 3d10 విన్యాసం ఉన్నప్పటికీ, దానిని పరివర్తన మూలకంగా పరిగణిస్తారు. ఎందువల్ల?
జవాబు:
సిల్వర్ (Z = 47) సాధారణంగా + 2 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది. ఈ స్థితిలో ఇది అసంపూర్తిగా నిండిన d-ఆర్బిటాల్ను (4d) ను కలిగి ఉంటుంది. అందువలన సిల్వర్ పరివర్తన మూలకం.
ప్రశ్న 10.
Co2+ మరియు Mn2+ల ఎలక్ట్రాన్ విన్యాసాన్ని రాయండి.
జవాబు:
ఎలక్ట్రాన్ విన్యాసం:
Co+2 → [Ar] 3d7; Mn+2 [Ar] 3d5
ప్రశ్న 11.
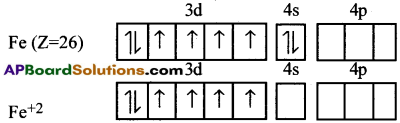
+3 స్థితికి ఆక్సీకరణం చెందడానికి Mn2+ సమ్మేళనాలకు, Fe2+ సమ్మేళనాల కంటే ఎక్కువ స్థిరత్వం ఉంటుంది.
జవాబు:
Mn2+ యొక్క ఎలక్ట్రాన్ విన్యాసము [Ar] 3d5, ఖచ్చితంగా సగం నిండిన ఆర్బిటాల్లు ఉండుట వలన ఇది స్థిరమైనది. మూడవ అయనీకరణ ఎంథాల్పీ విలువ అత్యధికం కాబట్టి ఇది మూడవ ఎలక్ట్రాన్ను కోల్పోదు. Fe2+ విషయంలో ఎలక్ట్రాన్ విన్యాసము [Ar] 3d6. కావున ఇది ఎలక్ట్రాన్ సులువుగా కోల్పోయి స్థిరమైన సగం నిండిన [Ar] 3d5 విన్యాసంను ఇచ్చును.
![]()
ప్రశ్న 12.
మొదటి పరివర్తన శ్రేణిలో ఏ లోహం తరచుగా +1 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది.
జవాబు:
కాపర్ ఎలక్ట్రాన్ విన్యాసం [Ar] 3d104s¹. ఇది సులువుగా 4s ఎలక్ట్రాన్ను కోల్పోయి స్థిరమైన [Ar] 3d10 విన్యాసాన్ని ఇస్తుంది. కావున ఇది తరచుగా +1 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది.
ప్రశ్న 13.
పరివర్తన మూలకాలు ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులు (బహుళ ఆక్సీకరణ స్థితలు) ప్రదర్శిస్తాయి ఎందుకు?
జవాబు:
పరివర్తన మూలకాలలో (n-1)d ఉపస్థాయికి మరియు ఉపస్థాయికి మధ్య శక్తి బేధం చాలా తక్కువ. కావున ఈ రెండు ఉపకక్ష్యలు ఎలక్ట్రాన్లను కోల్పోతాయి. దీని ఫలితంగా ఈ మూలకాలు ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితిని ప్రదర్శిస్తాయి.
ప్రశ్న 14.
స్కాండియం పరివర్తన మూలకం అయినప్పటికీ, అది బహుళ ఆక్సీకరణ స్థితులు ప్రదర్శించదు. ఎందువల్ల?
జవాబు:
Sc ఎలక్ట్రాన్ విన్యాసం [Ar]4s²3d¹. ఇది ఒక ఒంటరి – ఎలక్ట్రాను మాత్రమే కలిగియుండును. కావున ఇది బహుళ ఆక్సీకరణ స్థితిని ప్రదర్శించదు. ఇది +3 ఆక్సీకరణ స్థితిని మాత్రమే ప్రదర్శిస్తుంది.
ప్రశ్న 15.
Ni,Cu మరియు Zn లలో M3+ ఆక్సీకరణ స్థితిని పొందడం కష్టం?0
జవాబు:
Ni, Cu మరియు Znలు +2 ఆక్సీకరణ స్థితిలో స్థిరమైనవి. కావున +3 ఆక్సీకరణ స్థితిని పొందడం కష్టం.
+2 ఆక్సీకరణ స్థితి స్థిరంనకు కారణం :
రుణహైడ్రేషన్ ఎంథాల్పీ కారణం Ni మరియు Cuలు +2 ఆక్సీకరణ స్థితిలో స్థిరమైనవి. Zn యొక్క +2 ఆక్సీకరణ స్థితి పూర్తిగా నిండిన d-ఉపస్థాయిల కారణం Zn +2 ఆక్సీకరణ స్థితిలో స్థిరమైనది.
ప్రశ్న 16.
రెండింటిలో ఒకే విధమైన ఎలక్ట్రాన్ విన్యాసము d4 ఉన్నప్పటికీ, Cr2+ మరియు Mn3+ ఆక్సీకరణి. ఎందువల్ల?
జవాబు:
Cr+2 ఎలక్ట్రాన్ విన్యాసం [Ar] 4s°3d4.
Mn+3 ఎలక్ట్రాన్ విన్యాసం [Ar] 4s°3d4.
Cr+2 మరియు Mn+3 లు ఒకే విధమైన ఎలక్ట్రాన్ విన్యాసంను కలిగి ఉంటాయి. Cr2+ క్షయకరణ కారకంగా పని చేస్తుంది. కాని Mn+3 ఆక్సీకరణ కారకంగా పని చేస్తుంది.
కారణం:
Cr+3/Cr+2 కు E° విలువ ఋణాత్మక (-0.41V) ఉండుట. Mn+3/Mn+2 కు E° విలువ (+1.57V) ధనాత్మకంగా ఉండును.
కావున Cr+2 అయాన్లు సులువుగా ఆక్సీకరణం చెంది Cr+3 అయాన్లను ఇస్తుంది. కావున Cr+2 క్షయికరణ కారకంగా పనిచేస్తుంది.
Mn+3 అయాన్లు సులువుగా క్షయకరణం చెంది Mn+2 అయాన్లను ఇస్తుంది. కావున Mn+3 ఆక్సీకరణ కారకంగా పనిచేస్తుంది.
![]()
ప్రశ్న 17.
Cr, Mo మరియు W లు ఒకే గ్రూపుకు (గ్రూపు 6) చెందిన మూలకాలైనప్పటికీ Cr(VI) బలమైన ఆక్సీకరణ అయితే Mo (VI) మరియు W (VI)లు కావు ఎందువల్ల?
జవాబు:
d-బ్లాక్ మూలకాలలో ఒకే గ్రూపు నందు, భార మూలకాలు అధిక ఆక్సీకరణ స్థితిలో స్థిరంగా ఉంటాయి.
ఉదా : గ్రూపు 6 నందు Mo(VI) మరియు W(VI)లు Cr(VI) కంటే స్థిరమైనదిగా కనుగొనబడినది. ఈ కారణం చేత డైక్రోమేట్ రూపంలో Cr(VI) ఆమ్ల యానకంలో బలమైన ఆక్సీకరణీ కారకం కాని MoO3 మరియు WO3 లు ఆక్సీకరణీలు కావు.
ప్రశ్న 18.
M3+/M2+ ప్రమాణ ఎలక్ట్రోడ్ పొటెన్షియల్ Mn కు సాపేక్షకంగా ఎక్కువగా Feకు సాపేక్షకంగా తక్కువ ఉంటుంది అనే వాస్తవిక విషయం నుంచి మీరు ఏమి గ్రహిస్తారు?
జవాబు:
సాపేక్షకంగా E°(Mn+3/Mn+2) కు అధిక విలువ ఉండుటకు కారణం Mn+2 కు అధిక స్థిరత్వంను ds5 విన్యాసంతోపొందుటయే. సాపేక్షకంగా E (Fe+3/Fe+2) విలువ స్వల్పంగా ఉండుటకు కారణం Fe+3అయాన్ df విన్యాసంతో అధిక స్థిరత్వంను కలిగియుండుటయే.
E°(Mn+3/Mn+2) = +1.57V
Eo(Fe+3/Fe+2) = +0.77V
ప్రశ్న 19.
పరివర్తన మూలకాలకు అధిక ద్రవీభవన స్థానాలు ఉంటాయి. ఎందువల్ల?
జవాబు:
పరివర్తన మూలక పరమాణువుల మధ్య ఉన్న బలమైన లోహా బంధాలు వాటి అధిక ద్రవీభవన స్థానాలకు కారణం.
ప్రశ్న 20.
మొదటి పరివర్తన శ్రేణి (3d శ్రేణి) లో క్రోమియంకు అత్యధిక ద్రవీభవన స్థానం ఉంటుంది. ఎందువల్ల?
జవాబు:
మొదటి పరివర్తన శ్రేణి మూలకాలలో లోహ బంధ బలం మొదటి నుండి మధ్య వరకు జత కూడని ఎలక్ట్రాన్ల సంఖ్యతో పాటు పెరుగుతుంది. Sc లో 1, Ti లో 2, V లో 3 మరియు క్రోమియంలో 5 జతకూడని ఎలక్ట్రాన్లు ఉంటాయి.
క్రోమియం(Cr) తరువాత జతకూడని ఎలక్ట్రాన్ల సంఖ్య తగ్గుతుంది. Fe లో 4, Coలో 3 జత కూడని ఎలక్ట్రాన్లు ఉంటాయి. క్రోమియంలో అధికంగా జతకూడని ఎలక్ట్రాన్లు ఉండుట వల్ల అత్యధిక ద్రవీభవన స్థానం ఉంటుంది.
ప్రశ్న 21.
s-బ్లాక్ మూలకాలతో పోలిస్తే, పరివర్తన మూలకాలు అధిక పరమాణీకరణ ఎంథాల్పీలను ప్రదర్శిస్తాయి. ఎందువల్ల?
జవాబు:
సాధారణంగా వేలన్సీ స్థాయిలో ఒంటరి ఎలక్ట్రాన్ల సంఖ్య ఎంత ఎక్కువ ఉంటే లోహ బంధం అంత బలంగా ఉంటుంది. లోహాబంధం బలంగా ఉంటే, పరమాణీకరణ ఎంథాల్పీ కూడా అధికంగా ఉండను. S బ్లాక్ మూలకాలతో పోల్చితే, పరివర్తన మూలకాలకు అధిక సంఖ్యలో ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి. అందువల్ల వీటికి అధిక పరమాణీకరణ ఎంథాల్పీలను ప్రదర్శిస్తాయి.
ప్రశ్న 22.
మొదటి పరివర్తన శ్రేణి (3d శ్రేణి) లో జింకు అత్యల్ప పరమాణీకరణ ఎంథాల్పీ ఉంటుంది. ఎందువల్ల?
జవాబు:
జింక్లో ఒంటరి ఎలక్ట్రాన్లు ఉండవు. అందువల్ల జింక్ మూలకములో పరమాణువులు బలహీనంగా బంధించబడి ఉంటాయి. దీని ఫలితంగా జింకు అత్యల్ప పరమాణీకరణ ఎంథాల్పీ ఉంటుంది.
![]()
ప్రశ్న 23.
ఒక శ్రేణిలో పరివర్తనమూలకాల సాంద్రతలు ఏ విధంగామారుతాయని మీరు ఊహీస్తారు? ఎందుకు?
జవాబు:
పరివర్తన శ్రేణిలో ఎడమ నుండి కుడికి పోయే కొలది, పరమాణు వ్యాసార్థాలు తగ్గుతాయి. దీనికి కారణం కేంద్రక ఆకర్షణ పెరుగటయే.
కావున పరమాణు ఘనపరిమాణం తగ్గుతుంది. అదే సమయంలో పరమాణు ద్రవ్యరాశి పెరుగుతుంది. అందువల్ల సాంద్రత పెరుగుతుంది.
ప్రశ్న 24.
ఒక శ్రేణిలో పరివర్తన లోహాల పరమాణు మరియు అయానిక పరిమాణం ఎలా మారుతాయి?
జవాబు:
సాధారణంగా ఒక శ్రేణిలో పరివర్తన లోహాల పరమాణు మరియు అయానిక వ్యాసార్థాలు పరమాణు సంఖ్య పెరుగుదలతో పాటు తగ్గుతాయి. కాని మధ్య మూలకాల తరువాత తగ్గుదల తక్కువగా ఉంటుంది. బాహ్యా కర్పరానికి ముందు కర్పరంలో d-ఎలక్ట్రాన్లు పెరుగుట వలన పరిరక్షణ ప్రభావం కూడా పెరుగుతుంది. దీని ఫలితంగా పరమాణు మరియు అయానిక వ్యాసార్థాలు మధ్య మూలకాల తరువాత దాదాపుగా సమానంగా ఉంటుంది.
ఉదా: 3d శ్రేణి మూలకాల పరమాణు వ్యాసార్థాలు క్రోమియంనుండి కాపర్ వరకు ఒకే విధంగా ఉంటాయి.
ప్రశ్న 25.
Mn, Ni మరియు Zn లు ఉండవలసిన దాని కంటే ఎక్కువ ఋణ E° విలువ ఉంటుంది. ఎందుకు?
జవాబు:
సాధారణ ప్రవృతి కంటే Mn, Ni మరియు Znలకు ఉండవలసిన దాని కంటే ఎక్కువ ఋణ E° విలువలు ఉంటాయి.దీని కారణంగా Mn+2తో స్థిరమైనd5 తో అనగా సగం నిండిన ఉపకక్ష్యలు ఉంటాయి మరియు Zn+2 లో 3d10 అనగా పూర్తిగా నిండిన ఉపకక్ష్యలు ఉంటాయి.
Ni కు అధిక ఋణహైడ్రేషన్ ఎంథాల్పీ ఉండుట కారణంగా Ni కు ఉండవలసిన దాని కంటే ఎక్కువ ఋణ E° విలువ కలదు.
ప్రశ్న 26.
మొదటి పరివర్తన శ్రేణిలో (3d శ్రేణి) కాపర్కి మాత్రమే ధన E[M2+/M] విలువ ఉంటుంది. ఎందుకు?
జవాబు:
కాపర్ యొక్క ఉత్పతన మరియు అయనీకరణ ఎంథాల్పీల మొత్తందాని యొక్క హైడ్రేషన్ ఎంథాల్పీతో తుల్యం కాదు కనుకనే Cuకి ధనాత్మకE° విలువ కలదు.
ప్రశ్న 27.
CuII CuF2. CuCl2 మరియు CuBr2 లాంటి హాలైడ్లను ఏర్పరుస్తుంది. కాని Cul ను ఏర్పరచలేదు. ఎందుకు?
జవాబు:
Cu+2 అయోడైడ్ను అయోడిన్గా ఆక్సీకరిస్తుంది. అందువల్ల Cu+2 CuF2, CuCl2 మరియు CuBr2 లను ఏర్పరుస్తుంది. Cul2 ను ఏర్పర్చలేదు.
2Cu+2 + 4I– → Cu2I2 + I2
ప్రశ్న 28.
Mn అధిక స్థాయి ఫ్లోరైడ్ MnF4 అయితే, అధికస్థాయి ఆక్సైడ్ Mn2O7 ఎందుకు?
జవాబు:
ఆక్సిజన్ అధిక ఆక్సీకరణ స్థితిలో ఫ్లోరిన్ కన్నా స్థిరీకరిస్తుంది. కనుక Mn యొక్క అత్యధిక ఫ్లోరైడ్ MnF4 కాగ, అధికస్థాయి ఆక్సైడ్ Mn2O7 దీనికి కారణం ఆక్సిజన్ లోహా పరమాణువులతో బహు బంధాలను ఏర్పర్చే సామర్థ్యంను కలిగి ఉండుట. ఫ్లోరిన్ కన్నా అధిక ఆక్సీకరణ స్థితిలో ఆక్సిజన్ స్థిరీకరిస్తుంది.
ప్రశ్న 29.
ఒక పరివర్తన మూలకం, దాని ఫ్లోరైడ్ లేదా ఆక్సైడ్లలో అధిక ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది. ఎందుకు?
జవాబు:
అల్ప పరిమాణం మరియు అధిక ఋణవిద్యుదాత్మకత కారణంగా ఆక్సిజన్ మరియు ఫ్లోరిన్లు లోహాలను అత్యధిక ఆక్సీకరణ స్థితికి ఆక్సీకరణం చెందిస్తాయి.
![]()
ప్రశ్న 30.
Zn2+ డయా అయస్కాంత పదార్థం అయితే Mn2+ పరా అయస్కాంత పదార్థం. ఎందుకు? [TS 15] [AP17,18,20]
జవాబు:
Zn+2 ఎలక్ట్రాన్ విన్యాసం [Ar]4s°3d10. దీనిలో ఒంటరి ఎలక్ట్రాన్లు ఉండవు కావున ఇది డయా అయస్కాంత పదార్థం.
Mn+2 ఎలక్ట్రాన్ విన్యాసం [Ar]4s°3d5 దీనిలో 5 ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి. కావున ఇది పరా అయస్కాంత పదార్థం.
ప్రశ్న 31.
పరివర్తన లోహ అయాన్ల అయస్కాంత భ్రామకాలు లెక్కగట్టే భ్రమణ-ఆధారిత భ్రామకం రాయండి.
జవాబు:
భ్రమణ అయస్కాంత భ్రామకం µ = \(\sqrt{n(n+2)}\) BM
BM = బోర్ మాగ్నటాన్
n = ఒంటరి ఎలక్ట్రాన్ల సంఖ్య
ప్రశ్న 32.
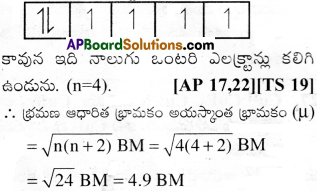
Fe2+(జల) అయాన్ భ్రమణ-ఆధారిత భ్రామకం
జవాబు:
Fe+2 అయాన్ ఎలక్ట్రాన్ విన్యాసం= [Ar] 3d64s°
ప్రశ్న 33.
“అననుపాతం” అంటే అర్థం ఏమిటి? ఉదాహరణలు ఇవ్వండి.
జవాబు:
ఒక ఆక్సీకరణ స్థితి అస్థిరమైనచో, ఆ మూలకం ఇతర స్థిరమైన ఆక్సీకరణ స్థితులుగా (ఒకటి తక్కువ మరియు ఒకటి ఎక్కువ) మార్పు చెందుటను అననుపాతం అంటారు.
ఉదా: మాంగనీస్ (+6) అస్థిరమైనది కనుక ఆమ్ల యానకంలో మాంగనీస్ + 7 మరియు +4 గా మార్పు చెందును.
![]()
ప్రశ్న 34.
జల Cu2+ అయాన్ల లు నీలి రంగులో ఉంటాయి. కానీ జల Zn2+ అయాన్లు రంగులేనివి. ఎందుకు?
జవాబు:
Cu+2 అయాన్ ఎలక్ట్రాన్ విన్యాసం [Ar] 46°3d9.ఇది ఒక ఒంటరి ఎలక్ట్రానన్ను కలిగియుండును, కావున ఇది జలద్రావణంలో నీలి రంగు ప్రదర్శించును. Zn+2 ఎలక్ట్రాన్ విన్యాసం [Ar]4s°3d10.దీనిలో ఒంటరి ఎలక్ట్రాన్లు లేవు. కావున జల ద్రావణంలో ఇది రంగును ప్రదర్శించదు. [AP,TS-16]
ప్రశ్న 35.
సంక్లిష్ట సమ్మేళనాలు అంటే ఏమిటి? ఉదాహరణలు ఇవ్వండి.
జవాబు:
పరివర్తన లోహ పరమాణువులు లేదా అయాన్లు అనయాన్లతో గాని లేదా తటస్థ సముహాలతో గాని బంధాలను లేదా సమన్వయ సమయోజనీయ బంధాలను ఏర్పర్చుకొని అధిక సంఖ్యలో సమ్మేళనాలను ఏర్పరుస్తాయి. ఈ సమ్మేళనాలను సంక్లిష్ట సమ్మేళనాలు లేదా సమన్వయ సమ్మేళనాలు అని అంటారు.
ఉదా: [Fe(CN)6]-4, [Co(NH3)6]+3
![]()
ప్రశ్న 36.
పరివర్తన లోహాలు అధిక సంఖ్యలో సంక్లిష్ట సమ్మేళనాలను ఏర్పరుస్తాయి. ఎందువల్ల?
జవాబు:
పరివర్తన మూలకాలు తక్కువ పరిమాణం, అధిక కేంద్రక ప్రభావికావేశం మరియు అసంపూర్తిగా నిండిన d ఆర్బిటాల్లను కలిగియుండుట కారణంగా పరివర్తన మూలకాలు (లోహాలు) అధిక సంఖ్యలో సంక్లిష్ట సమ్మేళనాలను ఏర్పరుస్తాయి.
ప్రశ్న 37.
పరివర్తన లోహాలు ఉత్ప్రేరక ధర్మాలను ఎలా ప్రదర్శిస్తాయి?
జవాబు:
పరివర్తన మూలకాలు, వాటి సమ్మేళనాలు ఉత్ప్రేరక ధర్మాలను ప్రదర్శిస్తాయి. ఈ ఉత్ప్రేరక ధర్మాలకు కారణం, పరివర్తన మూలకాలకు, ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులు ఉండటం, సంక్లిష్టాలు ఏర్పరచడం.
ఉదా:వెనేడియం(V) ఆక్సైడ్ (కాంటాక్ట్ పద్ధతి)లో, సూక్ష విభజిత ఐరన్(హేబర్ పద్ధతి), నికెల్ (ఉత్ప్రేరక హైడ్రోజనీకరణం). పరివర్తన మూలక అయాన్లు వాటి ఆక్సీకరణ స్థితులను మార్చుకొనగలుగటచే ఇవి సమర్థవంతమైన ఉత్ప్రేరకాలుగా పనిచేయును. ఉదాహరణకు ఐరన్ (III) అయోడైడ్ మరియు పర్సల్ఫేట్ అయాన్లకు ఉత్ప్రేరకంగా పని చేస్తుంది.
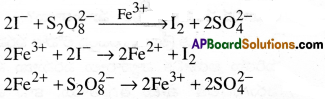
ప్రశ్న 38.
పరివర్తన లోహాలు లేదా వాటి సమ్మేళనాలు ఉత్ప్రేరకాలుగా పనిచేసే రెండు చర్యలను ఇవ్వండి.
జవాబు:
1) SO2 నుండి SO3ని తయారు చేయుటలో V2O5ను ఉత్ప్రేరకంగా వాడుతారు. [TS 17]

ప్రశ్న 39.
మిశ్రలోహం అనగానేమి? ఉదాహరణ ఇవ్వండి. [AP 18]
జవాబు:
ఒక లోహం ఒకే విధమైన భౌతిక ధర్మాలను కలిగిన మరొక లోహంతో లేదా అలోహంలో లేదా అర్ధలోహంలో ఏర్పర్చే సజాతీయ మిశ్రమంను మిశ్రలోహం అంటారు.
ఉదా: ఇన్వర్ 64% Fe, 35% Ni, Mn, C లు లేశ మాత్రంలో ఉంటాయి.
నిక్రోమ్: 60% Ni, 25% Fe, 15% Cr
ప్రశ్న 40.
పరివర్తన లోహాలు సులభంగా మిశ్రమలోహాలను ఏర్పరుస్తాయి. ఎందుకు?
జవాబు:
పరివర్తన మూలకాలకు ఒకే విధమైన పరమాణు లేదా అయానిక వ్యాసార్థాలు మరియు ఒకే విధమైన అభిలక్షణ ధర్మాలు ఉంటాయి. అందువల్ల ఈ మూలకాలు సులభంగా మిశ్ర లోహాలను ఏర్పరుస్తాయి.
ప్రశ్న 41.
మొదటి పరివర్తన శ్రేణి ఆక్సైడ్లలో అయానిక లక్షణం, ఆమ్ల స్వభావం ఎలా మారుతాయి?
జవాబు:
లోహం యొక్క ఆక్సీకరణ సంఖ్య పెరిగితే అయానిక లక్షణం తగ్గుతుంది.
ఉదా: Mn2O7 సమయోజనీయ ఆకుపచ్చ నూనె. సాధారణంగా తక్కువ ఆక్సీకరణ స్థితి ఉన్న ఆక్సైడ్లు క్షార స్వభావాన్ని, మధ్యస్థ ఆక్సీకరణ స్థితి ఉన్న ఆక్సైడ్లు ద్వంద్వ స్వభావాన్ని మరియు అధిక ఆక్సీకరణ స్థితి ఉన్న ఆక్సైడ్లు ఆమ్ల స్వభావాన్ని కలిగి ఉంటాయి.
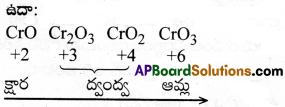
ఆక్సీకరణ సంఖ్య పెరుగుదలతో పాటు ఆమ్ల లక్షణం పెరుగుతుంది.
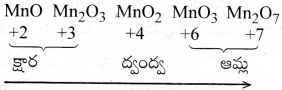
ఆక్సీకరణ సంఖ్య పెరుగుదలతో పాటు ఆమ్ల లక్షణం పెరుగుతుంది.
ప్రశ్న 42.
పొటాషియం డైక్రోమేట్ ద్రావణం పై PH పెరుగుదల ప్రభావం ఏమిటి?
జవాబు:
జలద్రావణంలో క్రిందివి కలిగి ఉంటాయి.
![]()
ఆమ్లయానకంలో pH < 4 ఇది Cr2O-27 గా ఉంటుంది. మరియు నారింజ రంగులో ఉంటుంది. క్షార యానకంలో pH>7 ఇది Cr2O-24 గా ఉంటుంది. మరియు పసుపు రంగులో ఉంటుంది.
![]()
ప్రశ్న 43.
మొదటి శ్రేణి పరివర్తన లోహాలలో, లోహం ప్రదర్శించే ఆక్సీకరణ స్థితి దాని గ్రూపు సంఖ్యకు సమానమయ్యే ఆక్సోలోహ అనయాన్ల పేర్లను తెల్పండి.
జవాబు:
VO-34 లో V +5 ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది. ఇది గ్రూపు సంఖ్య V కు సమానం.
ప్రశ్న 44.
పర్మాంగనేట్ అంశమాపనాలను సాధారణంగా సల్ఫూరిక్ ఆమ్లం సమక్షంలో జరుపుతారు. కానీ హైడ్రోక్లోరిన్ ఆమ్లం సమక్షంలో జరపరు. ఎందువల్ల?
జవాబు:
పర్మాంగనేట్ అంశమాపనాలు, హైడ్రోక్లోరిక్ ఆమ్లం సమక్షంలో సంతృప్తిగా జరగవు. దీనికి కారణం హైడ్రోక్లోరిక్ ఆమ్లం, క్లోరిన్గా ఆక్సీకరణం చెందడమే.
ప్రశ్న 45.
‘లాంథనైడ్ సంకోచం’ అంటే ఏమిటి? [TS 16,19,20]
జవాబు:
లాంథనైడ్ శ్రేణీలో లాంథనం నుండి లూటిషియంకు పోయే కొలది పరమాణు సంఖ్య పెరుగుదలతో పాటు పరమాణు మరియు అయానిక వ్యాసార్థాలు క్రమంగా తగ్గుతాయి. దీనినే ‘లాంథనైడ్ సంకోచం’ అని అంటారు.
ప్రశ్న 46.
లాంథనైడ్లు ప్రదర్శించే వివిధ ఆక్సీకరణ స్థితులు ఏవి?
జవాబు:
లాంథనైడ్లు ప్రముఖంగా +2,+3 ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి. అయితే అప్పుడప్పుడు ద్రావణాలలో లేదా ఘనపదార్థాలలో +2 మరియు +4 స్థితులలో కూడా అయాన్లు లభిస్తాయి.
ప్రశ్న 47.
‘మిష్ లోహం’ (Mischmetall) అంటే ఏమిటి? దాని సంఘటనాన్ని మరియు ఉపయోగాలు ఇవ్వండి. [AP 16,19]
జవాబు:
లాంథనైడ్ లోహం యొక్క ప్రముఖ మిశ్ర లోహంను ‘మిష్ లోహం’ అని అంటారు.
దీనిలో లాంథనైడ్ లోహం 95%, ఇనుము 5% తో పాటు లేశమాత్రలో S, C, Ca మరియు Alలు ఉంటాయి. మిష్ లోహాన్ని అధికంగా బుల్లెట్లు, తొడుగులు (Shells) తేలిక చకుముఖిల తయారీకి ఉపయోగించే Mg ఆధారిత మిశ్ర లోహ ఉత్పత్తికి వాడతారు.
ప్రశ్న 48.
ఆక్టినైడ్ సంకోచం అంటే ఏమిటి?
జవాబు:
ఆక్టినైడ్లలో పరమాణువుల పరిమాణం లేదా M+3 అయాన్ల పరిమాణం అడ్డంగా క్రమంగా తగ్గుతాయి. దీనినే ఆక్టినైడ్ సంకోచం అంటారు.
ప్రశ్న 49.
సమన్వయ సమ్మేళనాలు అంటే ఏమిటి? రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
పరివర్తన లోహ పరమాణువులు లేదా అయాన్లు అనయాన్లతో గాని లేదా తటస్థ సమూహాలతో గాని బంధాలను లేదా సమన్వయ సమయోజనీయ బంధాలను ఏర్పర్చుకొని అధిక సంఖ్యలో సమ్మేళనాలు ఏర్పరుస్తాయి. ఈ సమ్మేళనాలను సంక్లిష్ట సమ్మేళనాలు లేదా సమన్వయం సమ్మేళనాలు అని అంటారు.
ఉదా: [Co(NH3)6]Cl3, K4[Fe(CN)6]
![]()
ప్రశ్న 50.
‘కో ఆర్డినేషన్ పాలిహెడ్రన్’ అంటే ఏమిటి?
జవాబు:
కేంద్రలోహ పరమాణువు లేక అయాన్కు త్రిమితీయంగా అమర్చబడిన లైగాండ్ల యొక్క అమరికను కేంద్ర పరమాణువు యొక్క సమన్వయ పాలిహెడ్రన్ అంటారు. (కో ఆర్డినేషన్) సమన్వయ పాలిహెడ్రన్ యొక్క సాధారణ ఆకృతి చతుర్ముఖీయ సమతల చతురస్రం, అష్టముఖీయం, చతురస్త్ర పిరమిడల్ మరియు ట్రైగోనల్ బై పిరమిడల్.
ప్రశ్న 51.
ద్వంద్వ లవణం అంటే ఏమిటి?
జవాబు:
ద్వంద్వ లవణాలు సంకలన సమ్మేళనాలు. ఇవి ఘన స్థితిలో స్థిరమైనవి కాని వీటిని నీటిలో లేదా వేరే ద్రావణిలో కరిగించినపుడు వాటి అనుఘటక అయాన్లుగా విడిపోతాయి. ఈ సమ్మేళనాలలో అనుఘటక అయాన్లు వ్యక్తిగత ధర్మాలను కోల్పోవు.
మోర్ లవణం – FeSO4, (NH4)2SO4.6H2O
పొటాష్ ఆలమ్ – K2SO4.Al2(SO4)3.24H2O
కార్నలైట్- KCl.MgCl2.6H2O
ప్రశ్న 52.
సంక్లిష్ట సమ్మేళనానికి, ద్వంద్వ లవణానికి మధ్య భేదం ఏమిటి?
జవాబు:
సంక్లిష్ట సమ్మేళనం అయానీకరణంలో ద్వంద్వ లవణం నుండి విభేదించును.
సంక్లిష్ట సమ్మేళనం ఒక సంక్లిష్ట అయాన్గాను, మరియు సాధారణ అయాన్లుగా వియోజనం చెందును. అదే ద్వంద్వ లవణం దాని యందలి అనుమటక అయాన్లుగా పూర్తిగా వియోజనం చెందును.
ద్వంద్వ లవణం:
ఉదా : కార్నలైట్ KCl.MgCl2.6H2O → K+ + Mg+2 + 2Cl–
సంక్లిష్ట లవణం:
ఉదా: పొటాషీయం ఫెర్రో సయనైడ్
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
ప్రశ్న 53.
లైగాండ్ అంటే ఏమిటి? [TS-18]
జవాబు:
సంక్లిష్టంలోని కేంద్ర లోహ పరమాణువుకు లేదా అయాన్కు ఎలక్ట్రాన్ జంటలను దానం చేసి సమన్వయం బంధాలను ఏర్పరచే అయాన్ల `లేదా పరమాణువు లేదా అణువును లైగాండ్ అంటారు.
ఉదా: Cl–, NH3, CN– etc.
ప్రశ్న 54.
అయానిక, తటస్థ లైగాండ్లకు ఒక్కొక్కదానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
అయానిక లైగాండ్ : CN–, Cl–
కాటయానిక లైగాండ్ : NO+, NO2+
తటస్థ లైగాండ్ : NH3, H2O
ప్రశ్న 55.
ఒక మోల్ CoCl3 ని AgNO3 ద్రావణంతో చర్య జరిపించినపుడు ఎన్ని మోల్ల AgCl అవక్షేపం
జవాబు:
మూడు మోల్ల AgCI అవక్షేపం ఏర్పడును.
3AgNO3 + COCl3 → Co(NO3)3 +3AgCl↓
ప్రశ్న 56.
“కీలేట్ లైగాండ్” అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి.
జవాబు:
‘ఉభయదంత’ లేక బహుదంత లైగాండ్ రెండు లేదా అంతకన్నాఎక్కువ దాత పరమాణువులను ఉపయోగించి లోహ అయాన్తో బంధించబడియుండుట వలన వలయం వంటి నిర్మాణం లభించును దీనిని కీలేట్ అని ఆ లైగాండ్ను కీలేట్ లైగాండ్ అని అంటారు.
ఉదా: C2O-24 (ఆకాలేట్)
NH2 – NH2 (హైడ్రాజిన్)
![]()
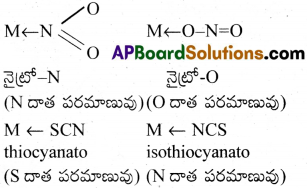
ప్రశ్న 57.
‘ఉభయదంత’ లైగాండ్ (ambidentate ligand) అంటే ఏమిటి? [AP 16]
జవాబు:
రెండుదాత పరమాణువులను కలిగిన లైగాండ్ రెండు పరమాణువులలో ఏదైనా ఒక పరమాణువు కేంద్ర పరమాణువు లేక అయాన్తో సమన్వయ బంధాన్ని ఏర్పరుస్తుంది. ఆ లైగాండ్ను ఉభయదంత లైగాండ్ అంటారు.
కొన్ని సాధారణ ఉదాహరణలు క్రింద ఇవ్వబడినవి:
ప్రశ్న 58.
CuSO4.5H2O నీలి రంగులో ఉంటుంది. కానీ ఆనార్థ CuSO4 రంగు లేనిది. ఎందుకు? [TS 22]
జవాబు:
CuSO4.5H2O,లో నీరు లైగాండ్గా పని చేస్తుంది. ఇది స్ఫటిక క్షేత్ర విభజనకు కారణం అగును. కావున CuSO4.5H2O లోd-dపరివర్తనం సాధ్యం కావచ్చును. అనార్ద్ర CuSO4లో నీటి అణువులు లేకపోవుట వలన స్ఫటిక క్షేత్ర విభజన సాధ్యం కాదు. కావున దీనికి రంగులేదు.
ప్రశ్న 59.
1 : 1 మోలార్ నిష్పత్తిలో FeSO4 ద్రావణాన్ని (NH4)2SO4 ద్రావణంలో కలిపితే ఆ ద్రావణం Fe2+ అయానన్ను పరీక్షనిస్తుంది. కాని 1 : 4 మోలార్ నిష్పత్తిలో CuSO4 ద్రావణాన్ని అమ్మోనియా జలద్రావణంతో కలిపితే, ఆ ద్రావణం Cu2+ అయాన్కు పరీక్షను ఇవ్వదు. ఎందువల్ల?
జవాబు:
1 : 1 నిష్పత్తిలో FeSO4 ను (NH4)2SO4 లో మిశ్రమం చేసిన ద్వంద్వ లవణం ఏర్పడును. FeSO4(NH4)2 SO4.6H2O ఇది ద్రావణంలో అయానీకరణం చెంది Fe+2 అయాన్లను ఇస్తుంది. కావున ఇది Fe+2 పరీక్షనిస్తుంది.
1 : 4 నిష్పత్తిలో CuSO4 ద్రావణంలను అమ్మోనియా జలద్రావణంతో మిశ్రమంగావించిన సంక్లిష్ట లవణం ఏర్పడును. దాని ఫార్ములా [Cu(NH3)4]SO4.,
[Cu(NH3)4]+2 సంక్లిష్ట అయాన్ అయానీకరణం చెంది Cu+2 అయాన్లను ఇవ్వదు. కావున ఇది Cu+2 అయాన్ పరీక్షనివ్వదు.
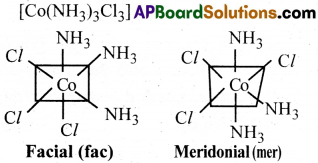
ప్రశ్న 60.
క్రింది సమన్వయ జాతులలో ఎన్ని జ్యామితీయ ఐసోమర్లు సాధ్యమవుతాయి?
(i) [Cr(C2O4)3]3- (ii) [Co(NH3)3Cl3]
జవాబు:
i) జ్యామితీయ ఐసోమర్లు సాధ్యం కావు.
[Cr(C2O4)3]-3.
ii) రెండు జ్యామితీయ ఐసోమర్లు సాధ్యమగును.
ప్రశ్న 61.
కాపర్ సల్ఫేట్ జలద్రావణానికి అధికంగా KCN జల ద్రావణం కలిపినప్పుడు ఏర్పడే సమన్వయజాతి ఏమిటి?
జవాబు:
కాపర్ సల్ఫేట్ జలద్రావణానికి అధిక KCN జలద్రావణంను కలిపినప్పుడు K2[Cu(CN)4] అనే సమన్వయ జాతి ఏర్పడుతుంది.

CN– అయాన్ బలమైన లైగాండ్ కావటంచే సంక్లిష్టం అత్యంత స్థిరమైనది. ఇది H2S వాయువు చేత స్పష్టం అవ్వదు. ఈ ద్రావణం గుండా H2S వాయువును పంపగా CuS అవక్షేపం ఏర్పడదు.
ప్రశ్న 62.
[Cr(NH3)6]3+ పరాయస్కాంత పదార్థం కాగా [Ni(CN)4]2- డయా అయస్కాంత పదార్థం ఎందువల్ల?
జవాబు:
మూడు ఒంటరి ఎలక్ట్రాన్లు ఉండుట వలన [Cr(NH3)6]3+పరాయస్కాంత పదార్థం.
ఒంటరి ఎలక్ట్రాన్లు లేకపోవుట వలన [Ni(CN)4]2- డయా అయస్కాంత పదార్థం.
![]()
ప్రశ్న 63.
[Ni(H2O)6]2+ ద్రావణం ఆకుపచ్చని రంగులో ఉంటుంది. కానీ[Ni(CN)4]2- ద్రావణంనకు రంగు లేదు. ఎందువల్ల?
జవాబు:
(Ni(H2O)6]2+, లో Ni +2 స్థితిలో 3d8 ఎలక్ట్రాన్ విన్యాసములో ఉండును. దీనిలో రెండు ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి. ఇది బలహీన లైగాండ్ సమక్షంలో జంటలను ఏర్పర్చవు. కావున దీనికి రంగు కలదు. ఇది d-d పరివర్తనంలో ఎరుపు కాంతిని శోషించుకొని ఆకుపచ్చని (complementary) సంపూరకంను ఉద్గారిస్తుంది. [Ni(CN)4]2- లోNi +2 స్థితిలో 3d8 ఎలక్ట్రాన్ విన్యాసమను కలిగియుండును. దీనికి రెండు ఒంటరి ఎలక్ట్రాన్లు ఉంటాయి. ఇది బలమైన లైగాండ్ CN– సమక్షంలో రెండు ఒంటరి 3d ఎలక్ట్రాన్లు జంటలుగా ఏర్పడుతాయి. ఒంటరి d ఎలక్ట్రాన్లు లేకపోవుట వలన దీనికి రంగు లేదు.
ప్రశ్న 64.
[Fe(CN)4]2-, [Fe(H2O)6]²లకు జలద్రావణాలలో వేరు వేరు రంగులు ఉంటాయి. ఎందువల్ల?
జవాబు:
పై రెండు సంక్లిష్టాలో Fe 3d6 విన్యాసంతో +2 ఆక్సీకరణ స్థితిలో ఉంటుంది. ఇది నాలుగు ఒంటరి ఎలక్ట్రాన్లను కలిగియుండును.
బలహీన లైగాండ్ H2O సమక్షంలో అవి జతకూడవు. బలమైన లైగాండ్ CN– సమక్షంలో ఇవి జతకూడటం వలన ఒంటరి ఎలక్ట్రాన్లు ఉండవు.
ఈ ఒంటరి ఎలక్ట్రాన్ల సంఖ్య తేడా కారణంగా ఇవి వేరు వేరు రంగులను కలిగి ఉంటాయి.
ప్రశ్న 65.
క్రింది వాటిలో కోబాల్ట్ ఆక్సీకరణ స్థితి ఎంత?
(i) K[Co(CO)4] and (ii) [Co(NH3)6]3+
జవాబు:
i) K[Co(CO)4] లో కోబాల్ట్ ఆక్సీకరణ స్థితి -1
ii) [Co(NH3)6]3+ లో కోబాల్ట్ ఆక్సీకరణ స్థితి +3
ప్రశ్న 65.
జలద్రావణములో ద్విసంయోజక అయాన్ అయస్కాంత భ్రామకాన్ని లెక్కగట్టండి. దాని పరమాణు సంఖ్య 25. [TS 16]
జవాబు:
జలద్రావణములో పరమాణు సంఖ్య 25 గా కలిగిన ద్విసంయోజక అయాన్ d5 సంకరీకరణం (5 ఒంటరి ఎలక్ట్రాన్లు) కలిగి ఉండును.
అయస్కాంత భ్రామకం
μ = \(\sqrt{n(n+2)}=\sqrt{5(5+2)}\) = 5.92BM
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
3d శ్రేణితో పోలిస్తే 4d మరియు 5d శ్రేణులలో అనూరూప పరివర్తన లోహాలు అధిక పరమాణీకరణ ఎంథాల్పీ చూపిస్తాయి. వివరించండి.
జవాబు:
3d శ్రేణితో పోలిస్తే 44 మరియు 5d శ్రేణులలోని అనూరూప పరివర్తన లోహాలు అధిక పరమాణీకరణ ఎంథాల్పీని చూపిస్తాయి.
ప్రశ్న 2.
3d మరియు 4d శ్రేణులలోని మూలకాల పరమాణు మరియు అయానిక సైజులతో పోలిస్తే, 4d మరియు 5d శ్రేణులలోని మూలకాల వ్యాసార్థాలు మారకుండా దాదాపు ఒకే విధంగా ఉంటాయి. వ్యాఖ్యానించండి.
జవాబు:
3d మరియు 4d శ్రేణులలోని మూలకాల పరమాణు మరియు అయానిక సైజులతో పోలిస్తే, 4d మరియు 5d శ్రేణులలోని మూలకాల వ్యాసార్థాలు మారకుండా దాదాపు ఒకే విధంగా ఉంటాయి.
5d శ్రేణి మూలకాల కంటే ఎలక్ట్రాన్లు ముందుగా 4f ఆర్బిటాల్లో నిండి ఉంటాయి. ఈ విధంగా 5d ఆర్బిటాల్ కన్నా ముందుగా 4f ఆర్బిటాల్లు నిండుటచే పరమాణు వ్యాసార్థాలు క్రమంగా తగ్గును. దీనిని లాంథనైడ్ సంకోచం అంటారు. లాంథనైడ్ సంకోచం వలన 4d మరియు 5d శ్రేణి మూలకాలు ఒకే పరమాణు పరిమాణాన్ని ప్రదర్శించును.
ప్రశ్న 3.
[Ni(CO)4]మరియు[Fe(CO)5] లలో వరుసగా Ni మరియు Fe లు సున్నా ఆక్సీకరణ స్థితి గురించి విశదీకరించండి.
జవాబు:
[Ni(CO)4] మరియు [Fe(CO)5]లలో Ni మరియు Fe ల ఆక్సీకరణ స్థితి సున్నా. ఈ అల్ప ఆక్సీకరణ స్థితులను కనుగొనుటకు కారణం సంక్లిష్ట సమ్మేళనం నందు లైగాండ్లు సిగ్మా బంధంతో పాటు π గ్రహీత స్వభావ సామర్థ్యంను కలిగి ఉండుట.
ప్రశ్న 4.
జలద్రావణాలలో పరివర్తన లోహ అయాన్లు అభిలాక్షణిక రంగు ఎందువల్ల ప్రదర్శిస్తాయి? ఉదాహరణలతో వివరించండి.
జవాబు:
ఒంటరి d-ఎలక్ట్రాన్లు కారణంగా జలద్రావణంలో పరివర్తనలోహ అయాన్లు రంగును కలిగియుండే ధర్మాన్ని కలిగి ఉంటాయి.
ఒక సంక్లిష్టలో లోహ అయాన్లోని ఒకే ‘n’ విలువ గల తక్కువ శక్తి d- ఆర్బిటాల్ నుండి ఒక ఎలక్ట్రాన్ జ: ఎక్కువశక్తిగల d-ఆర్బిటాల్లోకి ఉత్తేజితం చెందినప్పుడు, ఉత్తేజితశక్తి, శోషితకాంతిపౌనఃపున్యానికి సంబంధించినదై ఉంటుంది. ఈ పౌనఃపున్యం సాధారణంగా దృగ్గోచర ప్రాంతంలో ఉంటుంది.లోహ అయాన్ ప్రదర్శించే రంగు శోషిత కాంతి రంగుకు సంపూర్ణ రంగుగా ఉంటుంది. శోషిత కాంతి పౌనఃపున్యం లైగాండ్ స్వభావం పై ఆధారపడి ఉంటుందని నిర్ణయిస్తారు. జలద్రావణంలో నీటి అణువులు లైగాండ్ల వివిధ లోహ అయాన్లు ప్రదర్శించే రంగులు క్రింది పట్టికలో ఇవ్వడమైంది.
| విన్యాసం | ఉదాహరణ | రంగు |
| 3d0 | Sc3+ | రంగులేదు |
| 3d0 | Ti4+ | రంగులేదు |
| 3d1 | Ti3+ | ఉదా |
| 3d1 | V4+ | నీలి |
| 3d2 | V3+ | ఆకుపచ్చ |
| 3d3 | V2+ | ఉదా |
| 3d3 | Cr3+ | ఉదా |
| 3d4 | Mn3+ | ఉదా |
| 3d4 | Cr2+ | నీలి |
| 3d5 | Mn2+ | పింక్ |
| 3d5 | Fe3+ | పసుపు |
| 3d6 | Fe2+ | ఆకుపచ్చ |
| 3d6 3d7 | Co3+ Co2+ | నీలి, పింక్ |
| 3d8 | Ni2+ | ఆకుపచ్చ |
| 3d9 | Cu2+ | నీలి |
| 3d10 | Zn2+ | రంగులేదు. |
![]()
ప్రశ్న 5.
I– మరియు S2O82- ల మధ్య జరిగే చర్యలో ఐరన్(III) ఉత్ప్రేరకం క్రియాశీలతను వివరించండి.
జవాబు:
పరివర్తన మూలక అయాన్లు వాటి ఆక్సీకరణ స్థితులను మార్చుకొనగలుగుటచే అవి సమర్థవంతమైన ఉత్ప్రేరకాలుగా పని చేయును. ఐరన్ (III) అయొడైడ్ మరియు పర్సల్ఫేట్ అయాన్ల మధ్య చర్యలో ఉత్ప్రేరకంగా పనిచేయును.

ప్రశ్న 6.
అల్పాంతరాళ సమ్మేళనాలు అనగానేమి? అవి ఏలా ఏర్పడతాయి? రెండు ఉదాహరణలు ఇవ్వండి. [AP 15]
జవాబు:
చిన్న పరమాణువులు లోహల స్ఫటిక జాలకంలోని అల్పాంతరాళాలలో చిక్కుకుపోయినప్పుడు ఏర్పడే సమ్మేళనాలను అల్పాంతరాళ సమ్మేళనాలు అంటారు. పరివర్తన లోహాలు అల్పాంతరాళ సమ్మేళనాలను ఎక్కువగా ఏర్పర్చుటకు కారణం చిన్న పరమాణువులైన H,B,C మరియు N మొదలైనవి చాలా సులువుగా పరివర్తన లోహాల స్ఫటిక జాలకం యొక్క ఖాళీలను సులువుగా ఆక్రమించగలవు.
ఉదా: VH0.56, TiH1.7, Fe3H
ప్రశ్న 7.
అల్పాంతరాళ సమ్మేళనాల లక్షణాలను వ్రాయండి.
జవాబు:
- ఈ సమ్మేళనాలకు అధిక ద్రవీభవన స్థానాలు ఉంటాయి.
- ఈ సమ్మేళనాలు బాగా కఠినమైనవి కొన్ని బోరైడ్లకు డైమండ్ అంత కఠినత్వం ఉంటుంది.
- ఈ సమ్మేళనాలు లోహ వాహకత్వాన్ని పదిల పరచుకోంటాయి.
- ఈ సమ్మేళనాలకు రసాయనికంగా జడత్వం ఉంటుంది.
ప్రశ్న 8.
పరివర్తన మూలకాల విలక్షణ ధర్మాలను రాయండి. [AP 15] [TS 22]
జవాబు:
పరివర్తన మూలకాల విలక్షణ ధర్మాలు:
- పరివర్తన మూలకాలు బహుళ ఆక్సీకరణస్థితులను ప్రదర్శిస్తాయి.
- ఇవి పరాఅయస్కాంత ధర్మాన్ని కలిగి ఉంటాయి.
- ఇవి సంక్లిష్ట సమ్మేళనాలను ఏర్పరుస్తాయి.
- ఇవి రంగు గల అయాన్లను మరియు లవణాలను ఏర్పరచును.
- ఇవి ఉత్ప్రేరక ధర్మాలను ప్రదర్శిస్తాయి.
- ఇవి మిశ్రమ లోహాలను ఏర్పరుస్తాయి.
ప్రశ్న 9.
క్రింది వాటి ఎలక్ట్రాన్ విన్యాసాలను వ్రాయండి.
(i) Cr3+ (ii) Cu+ (iii) Co2+ (iv) Mn2+
జవాబు:
i) Cr3+ ఎలక్ట్రాన్ విన్యాసం [Ar]3d³
ii) Cu+ ఎలక్ట్రాన్ విన్యాసం [Ar]3d10
iii) Co2+ ఎలక్ట్రాన్ విన్యాసం [Ar]3d7
iv) Mn2+ ఎలక్ట్రాన్ విన్యాసం [Ar]3d5
ప్రశ్న 10.
పరివర్తన మూలక పరమాణువులలో భూస్థితిలో d ఎలక్ట్రాన్ విన్యాసాలు క్రింది విధంగా ఉన్నాయి. 3d³ 3d5, 3d8 మరియు 3d4 వీటిలో ఏ విన్యాసం స్థిర ఆక్సీకరణ స్థితిని తెలుపుతుంది.?
జవాబు:
| విన్యాసం | స్థిర ఆక్సీకరణ స్థితులు |
| 3d³(V) | +2, +3, +4 మరియు +5 |
| 3d5(Cr) | +3, +4 మరియు +6 |
| 3d5(Mn) | +2, +4, +6 మరియు +7 |
| 3d8(Ni) | +2, +3 మరియు +4 |
| 3d4 | ఇది ఉండదు. |
![]()
ప్రశ్న 11.
లాంథనైడ్ సంకోచం అంటే ఏమిటి? లాంథనైడ్ సంకోచం ఫలితాలు ఏమిటి?
జవాబు:
లాంథనైడ్ శ్రేణిలో లాంథనం నుండి లూటిషియంకు పోయే కొలది పరమాణు సంఖ్య పెరుగుదలతో పాటు పరమాణు మరియు అయానిక వ్యాసార్థాలు క్రమంగా తగ్గుతాయి. దీనిని లాంథనైడ్ సంకోచం అంటారు.
లాంథనైడ్ సంకోచం యొక్క ఫలితాలు :
i) ఆక్సైడ్లు మరియు హైడ్రాక్సైడ్ యొక్క క్షార లక్షణం:
లాంథనైడ్ సంకోచం వలన La-OH బంధనంనకు సమయోజనీయ స్వభావం పెరుగును. కనుక వాటి ఆక్సైడ్లు మరియు హైడ్రాక్సైడ్ యొక్క క్షార ధర్మం La(OH)3 నుండి Lu(OH)3కు తగ్గును.
ii) ఇదే విధంగా 2వ మరియు 3వ పరివర్తన శ్రేణి మూలకాల పరమాణు పరిమాణం లాంథనైడ్ సంకోచం వల్ల ఒకే విధంగా ఉండును. 3వ శ్రేణిలో లాంథనైడ్ను అనుసరించి మూలక పరమాణువులు ఊహించినదాని కన్నా చిన్నగా ఉండును. సాధారణ పెరుగదల Sc→Y→Laగా ఉండును. లాంథనైడ్ల తరువాత ఇది అదృశ్యమగును కనుక మూలకాల జతలు అయిన Zr/Hf, Nb/Ta మరియు Mo/W లు దాదాపు ఒకే ధర్మంను కలిగి ఉండుటచే వీటిని వేరు చేయుట కష్టం.
iii) లాంథనైడ్లను వేరు పర్చుట :
లాంథనైడ్ సంకోచం వలన లాంథనైడ్ మూలకాల యొక్క కొన్ని ధర్మాలు అనగా ద్రావణీయత, హైడ్రేషన్ అవధి మరియు సంక్లిష్టం ఏర్పడుట వంటి ధర్మాలు స్వల్పంగా విభేదించును. ఈ భేదంతో అయాన్ వినిమయ విధానం లాంథనైడ్లను వేరు చేయుట సాధ్యంకాదు.
ప్రశ్న 12.
పరివర్తన లోహాల ఆక్సీకరణ స్థితులలో మార్పు, పరివర్తన మూలకాలు కాని వాటిలో ఈ మార్పుకు గల భేదం ఏమిటి? ఉదాహరణలతో విశదీకరించండి.
జవాబు:
పరివర్తన మూలకాల ఆక్సీకరణ స్థితిలో భేదం ఏకాంకంగా వేరు చేయబడును (d-ఆర్బిటాల్లు అసంపూర్తిగా నిండి ఉండుట వలన) పరివర్తన మూలకాలు కాని వాటిలో ఆక్సీకరణస్థితి 2 యూనిట్ల తేడా ఉండును.
ఉదా: సల్ఫర్ +2, +4 మరియు +6 ఆక్సీకరణ స్థితిని చూపును.
ప్రశ్న 13.
ఐరన్ క్రోమైట్ ధాతువు నుండి పొటాషియం డైక్రోమేట్ తయారీని వివరించండి.
జవాబు:
ఐరన్ క్రోమైట్ నుండిK2 Cr2O7 తయారీ :
a) పొటాషియం డైక్రోమెట్ను క్రోమైట్ ధాతువు (FeCr2O4)ను సోడియం లేదా పొటాషియం కార్బోనేట్తో గలనం చేసి పొందుతారు.
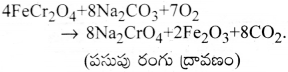
b) పసుపు రంగు సోడియం క్రోమేట్ ద్రావణాన్ని వడపోసి, సల్ఫూరిక్ ఆమ్లంలో ఆమ్లీకృతం గావిస్తే ఆరెంజంగు గల సోడియం డైక్రోమేట్ Na2Cr2O7.2H2O స్ఫటికాలు ఏర్పడతాయి.
2Na2CrO4 + 2H+ → Na2Cr2O7 + 2Na+ + H2O
c) సోడియం డైక్రోమేట్, పొటాషియం డైక్రోమేట్ కంటే నీటిలో అధికంగా కరుగుతుంది. కాబట్టి సోడియం డై క్రోమేట్ను పొటాషియం క్లోరైడ్తో చర్య జరిపించి, పొటాషియం డై క్రోమేట్ను తయారు చేస్తారు.
Na2Cr2O7 + 2KCl → K2Cr2O7 + 2NaCl
ఆరంజ్ రంగు గల పొటాషియం డైక్రోమేట్ . స్ఫటికాలు ఏర్పడుతాయి.
ప్రశ్న 14.
పొటాషియం డైక్రోమేట్ ఆక్సీకరణ చర్యా విధానాన్ని వివరించండి. క్రింది వాటితో దాని చర్యలకు అయానిక -సమీకరణాలు రాయండి.
(i) అయోడైడ్ (ii) ఐరన్ (II)ద్రావణం (iii) H2S (iv) Sn (II)
జవాబు:
పొటాషియం డైక్రోమేట్ బలమైన ఆక్సీకరణ కారకం, ఆమ్ల ద్రావణంలో పొటాషియం డైక్రోమేట్ ఆక్సీకరణ చర్యను క్రింది విధంగా సూచిస్తారు.

ప్రశ్న 15.
పొటాషియం పర్మాంగనేట్ తయారీని వర్ణించండి.
జవాబు:
MnO2 ను క్షారలోహ హైడ్రాక్సైడ్, KNO3 లాంటి ఆక్సీకరణితో గలనం చెందించగా పొటాషియం పర్మాంగనేట్ను తయారు చేస్తారు. ఈ చర్యలో ముదురు ఆకుపచ్చ KMnO4 ఏర్పడుతుంది. ఇది తటస్థ లేదా ఆమ్లలేదా ఆమ్ల ద్రావణంలో అననుపాతం చెంది, పొటాషియం పర్మాంగనేట్ను ఇస్తుంది.
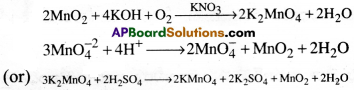
ప్రశ్న 16.
ఆమ్లీకృత పొటాషియం పర్మాంగనేట్ ద్రావణం క్రింది వాటితో ఏలా చర్య జరుపుతుంది?
(i) ఐరన్(II) అయాన్లు (ii) SO2 (iii) ఆక్జాలిక్ ఆమ్లం
జవాబు:
ఆమ్ల యానకంలో KMnO4 చర్య
MnO–4 + 8H+ + 5e– → Mn+2 + 4H2O …… (1)
i) ఐరన్(II)అయాన్లు :
ఫెర్రస్ అయాన్లు ఫెర్రిక్ అయాన్గా ఆక్సీకరణం చెందుతాయి.
[Fe+2 → Fe+3 + e–] × 5 …..(2)
సమీకరణం (1) మరియు (2) ల నుండి
5Fe+2 + MnO–4 + 8H+ → Mn+2 + 4H2O + 5Fe+3
ii) SO2 :
ఆమ్లీకృత KMnO4 SO2 నుSO4-2 గా ఆక్సీకరిస్తుంది.
SO2 + 2H2O → SO4-2 + 4H+ + 2e– …. (3)
సమీకరణం (1) మరియు (3) ల నుండి
5SO2 + 2MnO4 + 2H2O → 2Mn+2 + 4H+ + 5SO4-2
iii) ఆక్జాలిక్ ఆమ్లం:
C2O4-2 → 2CO2 + 2e– ……. (4)
సమీకరణం (1) మరియు (4) ల నుండి
5C2O4-2 + 2MnO–4 + 16H+ → 2Mn+2 + 8H2O + 10CO2
![]()
ప్రశ్న 17.
జలద్రావణంలో Cu+, Sc3+, Mn2+ మరియు Fe2+ లలో ఏ అయాన్కు రంగు ఉంటుందనిభావిస్తున్నారు? కారణాలను తెల్పండి.
జవాబు:
ఏ అయాన్లు అసంపూర్తిగా నిండి d-ఆర్బిటాల్న కలిగి ఉంటాయో అయాన్లు మాత్రమే రంగును కలిగి ఉంటాయి. ఏ అయాన్లు అయితే పూర్తిగా నిండిన d-ఆర్బిటాల్ను కలిగి ఉంటాయి. ఆ అయాన్లకు రంగు ఉండదు.
Cu+ = [Ar] 3d10 రంగు లేదు
Sc+3 = [Ar] 3d0 రంగు లేదు
Mn+2 = [Ar] 3d5 పింక్ రంగు
Fe+2 = [Ar] 3d5 లేత ఆకుపచ్చ
ప్రశ్న 18.
మొదటి పరివర్తనశ్రేణి మూలకాల +2 ఆక్సీకరణ స్థితుల స్థిరత్వాలను పోల్చండి.
జవాబు:
మొదటి పరివర్తన శ్రేణి మూలకాల I.E1 + I.E2 ల మొత్తం కేంద్రక ఆవేశం పెరుగుదలతో పాటు పెరుగుతుంది. కావున ప్రమాణ పొటెన్షియల్ లు తక్కువగా ఉండును మరియు తక్కువ ఋణావేశం. కావున M+2 అయాన్ ఏర్పడే ప్రవృత్తి తగ్గుతుంది. సగం నిండిన d-ఉపకక్ష్య (3d5) కారణంగా Mn యొక్క + 2 ఆక్సీకరణ స్థితి అత్యంత స్థిరమైనది.
జింక్ పూర్తిగా నిండిన d-ఉపకక్ష్య (3d10) కారణంగా Zn+2 అత్యంత స్థిరమైనది. అత్యధిక ఋణహైడ్రేషన్ ఎంథాల్పీ కారణంగా Ni +2 ఆక్సీకరణ స్థితిలో స్థిరమైనది.
ప్రశ్న 19.
హుండ్ నియమాన్ని ఉపయోగించి Ce3+ అయాన్ ఎలక్ట్రాన్ విన్యాసాన్ని ఉత్పాదించి, భ్రమణ -ఆధారిత భ్రామకం(‘spin-only’) ఆధారంగా దాని అయస్కాంత భ్రామకాన్ని లెక్కించండి.
జవాబు:
Ce (Z = 58) = [Xe] 4f¹5d¹6s².
Ce+3 = [Xe] 4f¹. ఇచ్చట ఒక ఒంటరి ఎలక్ట్రాన్ మాత్రమే కలదు. n = 1
కావున, µ = \(\sqrt{n(n+2)}=\sqrt{1(1+2)}\) = √3 = 1.73 BM
ప్రశ్న 20.
Ti2+, V2+, Cr3+ మరియు Mn2+ అయాన్లు ప్రతి దానిలోను ఎన్ని 3d ఎలక్ట్రాన్లు ఉంటాయో రాయండి. ఈ హైడ్రేషన్ అయాన్లలో (ఆక్టాహెడ్రల్) 5 3d ఆర్బిటాల్లు ఏ విధంగా నిండి ఉంటాయని ఉహిస్తున్నారో సూచించండి.
జవాబు:

ప్రశ్న 21.
వెర్నర్ సమన్వయం సమ్మేళనాల సిద్ధాంతాన్ని తగిన ఉదాహరణలతో వివరించండి. [AP 16,17,18,20,22] [TS – 15,18 19,22]
జవాబు:
వెర్నర్ సమన్వయ సమ్మేళనాలు సిద్ధాంతం:
1) ప్రతి సంక్లిష్ట సమ్మేళనం కేంద్ర లోహ పరమాణువు లేదా అయానన్ను కలిగి ఉండును.
2) లోహ పరమాణువు లేదా అయాన్ రెండు రకాల సంయోజకతలను ప్రదర్శించును. అనగా ప్రాథమిక వేలన్సీ మరియు ద్వితీయ వేలన్సీ.
a) ప్రాథమిక సంయోజకత :
ఇది కేంద్ర లోహ పరమాణువు యొక్క ఆక్సీకరణస్థితికి సమానం. సాధారణంగా అయాన్లు, లోహ పరమాణువు యొక్క ప్రాథమిక వేలన్ని సంతృప్త పరుస్తాయి. ఈ అయాన్లు చుక్కల గీతలతో(- – – – -) కేంద్ర లోహ పరమాణువునకు సంధానం చేయబడును. దీనిని అయానీకరణం చెందే సంయోజకత అంటారు.
b) ద్వితీయ సంయోజకత :
కేంద్ర లోహ పరమాణువు లేదా అయాన్ తో సమయోజనీయ బంధాలతో బంధితమై పరమాణువులు లేదా అయాన్లను ‘లైగాండ్’ లు అంటారు.
“కేంద్ర లోహపరమాణువు లేదా అయాన్ ఏర్పర్చే సమన్వయ సమయోజనీయ బంధాల సంఖ్యను “ద్వితీయ సంయోజకత లేదా సమన్వయ సంఖ్య అంటారు.
ప్రతిలోహ పరమాణువు నిర్ధిష్టమైన సమన్వయ సంఖ్యను కలిగి ఉండును.
ద్వితీయ సంయోజకతను సంతృప్త పర్చే సమ్మేళనాలు అయానీకరణం చెందవు. సంక్లిష్టం నిర్మాణంలో వీటిని గీతలతో కేంద్ర పరమాణువుకు కలుపబడును.
3) కొన్ని లైగాండ్లు ప్రథమ, ద్వితీయ సంయోజకతలను సంతృప్త పర్చును. ఇవి అయానీకరణం చెందవు.
4) కేంద్రలోహ, పరమాణువు లేదా అయాన్లను లైగాండ్లతో కలిపి చతురస్ర బ్రాకెట్ల లోపల వ్రాస్తారు. దీనిని సమన్వయ గోళం అంటారు.
5) అయానీకం చెంది ప్రథమ సంయోజకతను సంతృప్త పర్చే అయాన్లను చతురస్త్ర బ్రాకెట్ల వెలుపల వ్రాస్తారు.
క్రింది ఉదాహరణలు వెర్నర్ సిద్ధాంతమును వివరింపుము
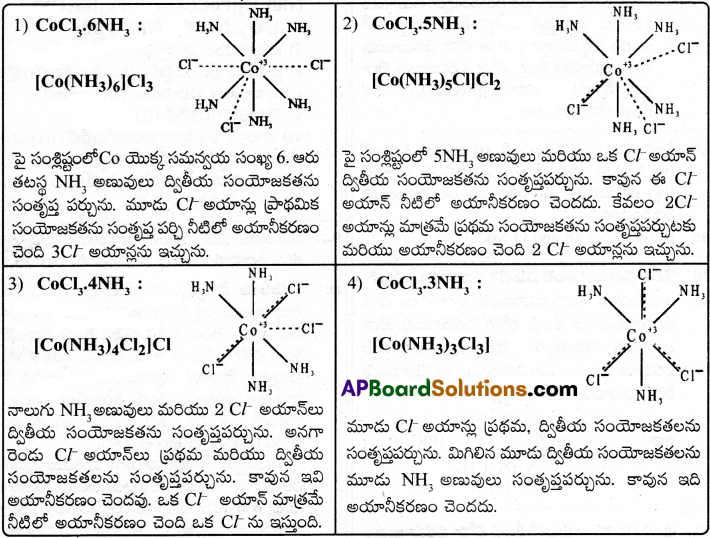
ప్రశ్న 22.
క్రింది సంక్లిష్టజాతుల జ్యామితీయ ఆకృతులను ఇవ్వండి.
(i) [Co(NH3)6]3+
(ii) [Ni(CO)4]
(iii) [PtCl4)]2-
(iv) [Fe(CN)6]4-
జవాబు:
i) [Co(NH3)6]3+ → ఆక్టా హెడ్రల్( అష్టముఖీ)
ii) [Ni(CO)4] → టెట్రా హెడ్రల్
iii) [PtCl4)]2- → సమతల చతురస్త్రం
iv) [Fe(CN)6]4- → ఆక్టా హెడ్రల్
ప్రశ్న 23.
క్రింది పదాలను వివరించండి.
(i) లైగాండ్
(ii) సమన్వయ సంఖ్య
(iii) సమన్వయసమూహం
(iv) కేంద్ర లోహ పరమాణువు లేదా అయాన్
జవాబు:
i) లైగాండ్ :
సమన్వయ సమూహంలోని కేంద్ర లోహ పరమాణువు లేదా అయాన్తో సమన్వయ సమయోజనీయ బంధంతో బంధించబడిన అయాన్లు లేదా అణువులను లైగాండ్ అని అంటారు.
a) Cl– వంటి సాధారణ అయాన్లు
b) H2O వంటి చిన్న అణువులు.
c) పెద్ద అణువులు అయిన
H2N-CH2-CH2-NH2
d) ప్రోటిన్ వంటి పెద్ద అణువులు సమన్వయానికి అందుబాటులో ఉన్నదాతపరమాణువుల సంఖ్యను ఆధారంగా లైగాండ్లను ఈ విధంగా వర్గీకరిస్తారు.
A) ఏకదంత లైగాండ్ : ఒక దాత పరమాణువు.
ఉదా: NH3
B) ద్విదంత లైగాండ్: రెండు దాత పరమాణువులు.
![]()
C) బహుదంత లైగాండ్రెండు కంటే ఎక్కువ దాత పరమాణువులు.
ఉదా : EDTA
ii) సమన్వయసంఖ్య :
సమన్వయ సమ్మేళనంలో కేంద్ర లోహ పరమాణువు లేదా అయాన్తో లైగాండ్ లేదా పరమాణువులు నేరుగా ఏర్పర్చే సమన్వయ బంధాల మన సంఖ్య అంటారు.
Ex: [Pt Cl6]-2, Pt సమన్వయ సంఖ్య = 6
[Ni(NH3)4]+2, Ni సమన్వయ సంఖ్య = 4
ii) సమన్వయసమూహం :
స్థిరసంఖ్యలో అణువులు లేదా అయాన్తో బంధించబడి ఉన్న కేంద్ర లోహ పరమాణువు లేదా అయానన్ను సమన్వయ సమూహం అంటారు.
Ex: [CoCl3(NH3)3], [Ni(CO)4]
iv) కేంద్రలోహ పరమాణువు లేదా అయాన్ :
సమన్వయ సమూహంలో దేనితోనైతే స్థిర సంఖ్యలో అయాన్లు గ్రూపులు నిర్దిష్టమైన త్రిజ్యామితీయ విన్యాసంలో బంధం ఏర్పరుస్తూన్నాయో ఆ లోహ పరమాణువు లేదా అయాన్ను కేంద్ర లోహ పరమాణువు లేదా అయాన్ అంటారు.
ఉదా: K4[Fe(CN)6] లో ‘Fe’ కేంద్ర లోహ పరమాణువు.
![]()
ప్రశ్న 24.
కింది పదాలను వివరించండి. (i) ఏకదంత లైగాండ్ (ii) ద్విదంత లైగాండ్ (iii) బహుదంత లైగాండ్ (iv) ఉభయదంత లైగాండ్ లను ఉదాహరణలతో వివరించండి.
జవాబు:
i) లైగాండ్ :
సమన్వయ సమూహంలోని కేంద్ర లోహ పరమాణువు లేదా అయాన్తో సమన్వయ సమయోజనీయ బంధంతో బంధించబడిన అయాన్లు లేదా అణువులను లైగాండ్ అని అంటారు.
a) Cl– వంటి సాధారణ అయాన్లు
b) H2O వంటి చిన్న అణువులు.
c) పెద్ద అణువులు అయిన
H2N-CH2-CH2-NH2
d) ప్రోటిన్ వంటి పెద్ద అణువులు సమన్వయానికి అందుబాటులో ఉన్నదాతపరమాణువుల సంఖ్యను ఆధారంగా లైగాండ్లను ఈ విధంగా వర్గీకరిస్తారు.
A) ఏకదంత లైగాండ్ : ఒక దాత పరమాణువు.
ఉదా: NH3
B) ద్విదంత లైగాండ్: రెండు దాత పరమాణువులు.
![]()
C) బహుదంత లైగాండ్రెండు కంటే ఎక్కువ దాత పరమాణువులు.
ఉదా : EDTA
ii) సమన్వయసంఖ్య :
సమన్వయ సమ్మేళనంలో కేంద్ర లోహ పరమాణువు లేదా అయాన్తో లైగాండ్ లేదా పరమాణువులు నేరుగా ఏర్పర్చే సమన్వయ బంధాల మన సంఖ్య అంటారు.
Ex: [Pt Cl6]-2, Pt సమన్వయ సంఖ్య = 6
[Ni(NH3)4]+2, Ni సమన్వయ సంఖ్య = 4
ii) సమన్వయసమూహం :
స్థిరసంఖ్యలో అణువులు లేదా అయాన్తో బంధించబడి ఉన్న కేంద్ర లోహ పరమాణువు లేదా అయానన్ను సమన్వయ సమూహం అంటారు.
Ex: [CoCl3(NH3)3], [Ni(CO)4]
iv) కేంద్రలోహ పరమాణువు లేదా అయాన్ :
సమన్వయ సమూహంలో దేనితోనైతే స్థిర సంఖ్యలో అయాన్లు గ్రూపులు నిర్దిష్టమైన త్రిజ్యామితీయ విన్యాసంలో బంధం ఏర్పరుస్తూన్నాయో ఆ లోహ పరమాణువు లేదా అయాన్ను కేంద్ర లోహ పరమాణువు లేదా అయాన్ అంటారు.
ఉదా: K4[Fe(CN)6] లో ‘Fe’ కేంద్ర లోహ పరమాణువు.
రెండుదాత పరమాణువులను కలిగిన లైగాండ్ రెండు పరమాణువులలో ఏదైనా ఒక పరమాణువు కేంద్ర పరమాణువు లేక అయాన్తో సమన్వయ బంధాన్ని ఏర్పరుస్తుంది. ఆ లైగాండ్ను ఉభయదంత లైగాండ్ అంటారు.
కొన్ని సాధారణ ఉదాహరణలు క్రింద ఇవ్వబడినవి:

ప్రశ్న 25.
‘కీలేట్ ప్రభావం’ అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి.
జవాబు:
ఉభయదంత లేదా బహుదంత లైగాండ్లు దాత పరమాణువులను కేంద్ర లోహ పరమాణువు లేదా అయాన్తో సమన్వయం చెంది ఐదు లేక ఆరు పరమాణువుల వలయం ఏర్పర్చును. ఈ ప్రభావంను కీలేట్ ప్రభావం అంటారు.
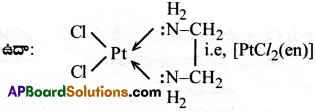
ప్రశ్న 26.
క్రింది సంక్లిష్ట జాతులలో కేంద్ర లోహ పరమాణువుల ఆక్సీకరణ సంఖ్యలను ఇవ్వండి.
(i) [Ni(CO)4]
(ii) [Co(NH3)6]3+
(iii) [Fe(CN)6]4-
(iv) [Fe(C2O4)3]3-
జవాబు:
i) [Ni(CO)4]
x + 4(0) = 0 x = 0
ii) [Co(NH3)6]+3
x + 6(0) = +3
x = +3
iii) [Fe(CN)6]4-
x + 6(-1) = -4
x = 6 – 4 = +2
iv) [Fe(C2O4)3]3-
x + 3(-2) =-3
x = +3
ప్రశ్న 27.
IUPAC నియమాలు ఉపయోగించి క్రింది వాటి సాంకేతికాలు రాయండి. :
(i) టెట్రాహైడ్రాక్సోజింకేట్ (II) [TS 22]
(ii) హెక్సమీన్ కోబాల్ట్ (III) సల్ఫేట్
(iii) పొటాషియం టెట్రాక్లోరో పల్లాడేట్(II)
(iv) పొటాషియం ట్రై (ఆక్జాలెటో) క్రోమేట్ (III)
జవాబు:
i) [Zn(OH)4]-2
ii) [Co(NH3)6]2(SO4)3
iii) K2[PdCl4]
iv) K3[Cr(C2O4)3]
ప్రశ్న 28.
IUPAC నియమాలు ఉపయోగించి క్రింది వాటి సాంకేతికాలు రాయండి.: [AP15,19] [IPE’14]
(i)[Co(NH3)6]Cl3
(ii) K3[Fe(CN)6]
(iii) [Pt(NH3)2Cl(NH2 CH3)]Cl
(iv) [Ti(H2O)6]3+.
(v) [NiCl4]2-
(vi) K4[Fe(CN)6]
(vii) [Cu(NH3)4]SO4
(viii) K2[PdCl4]
(xi) Fe4[Fe(CN)6]3
జవాబు:
i) హెక్సాఎమీన్ కోబాల్ట్ (III) క్లోరైడ్
ii) పొటాషియం హెక్సా సైనో ఫెర్రేట్ (III)
iii) డై ఏమీన్ క్లోరో మిథైల్ ఎమీన్ ప్లాటినమ్ (II) క్లోరైడ్
iv) హెక్సాఆక్వా టెటానియం (III) అయాన్
v) టెట్రాక్లోరో నికెలేట్ (II) అయాన్
vi) పొటాషియం హెక్సాసయనో ఫెర్రేట్ (II) అయాన్
vii) టెట్రాఏమైన్ కాపర్ (II) సల్ఫేట్
viii)పొటాషియం టెట్రాక్లోరో పల్లాడేట్ (II)
ix) హెక్సా సైనెడోఫెర్రేట్ (II)
ప్రశ్న 29.
సమన్వయ సమ్మేళనాలలో జామితీయ సాదృశ్యాన్ని తగిన ఉదాహరణలు ఇచ్చి వివరించండి. [AP 15,19]
జవాబు:
జామితీయ సాదృశ్యం :
ఈ సాదృశ్యం రెండు రకాల సాదృశ్యాలను ఏర్పర్చును. అవి సిస్ మరియు ట్రాన్స్ సాదృశ్యాలు. రెండు ఒకే విధమైన రెండు లైగాండ్లు కేంద్ర లోహ పరమాణువు యొక్క సమన్వయ గోళానికి ప్రక్కప్రక్క స్థానాన్ని ఆక్రమించి ఉంటే దానిని సిస్ సాదృశ్యం అంటారు. రెండు లైగాండ్లు సమన్వయ గోళంలో ఒకదానికి ఒకటి వ్యతిరేక స్థానంలో ఉంటే దానిని ట్రాన్స్ సాదృశ్యం అంటారు.
సమన్వయ సంఖ్య నాలుగు మరియు సమతల చతురస్త్ర నిర్మాణం కల సంక్లిష్టాలు మరియు సమన్వయ సంఖ్య 6 మరియు అష్టముఖీ నిర్మాణం కల సంక్లిష్టాలు సాధారణంగా జామితీయ సాదృశ్యాలను ప్రదర్శిస్తాయి.
ఉదా: [Pt(NH3)2Cl2]
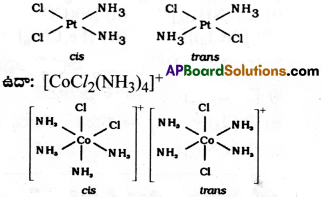
![]()
ప్రశ్న 30.
హోమెలెప్టిక్, హెటిరోలెప్టిక్ సంక్లిష్టాలు అంటే ఏమిటి? ఒక్కొక్కదానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
హోమోలెప్టిక్ సంక్లిష్టము :
ఒక సంక్లిష్టంలోని లోహంతో బంధితమైన లైగాండ్లు అన్నీ ఒకే రకం అయితే ఆ సంక్లిష్టాన్ని హోమోలెప్టిక్ సంక్లిష్టం అంటారు.
ఉదా: [Co(NH3)6]+3
హెటిరోలెప్టిక్ సంక్లిష్టము :
సంక్లిష్టంలోని లోహంతో బంధితమైన లైగాండ్లు ఒకటి కంటే ఎక్కువ రకాలు (భిన్న) అయితే ఆ సంక్లిష్టాన్ని హెటిరోలెప్టిక్ సంక్లిష్టం అంటారు.
ఉదా: [Co(NH3)4Cl2]+
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
క్రింది వాటిని తగిన కారణాలతో వివరించండి.
i) పరివర్తన లోహాలు మరియు వాటి అనేక సమ్మేళనాలు పరాఅయస్కాంత స్వభావాన్ని చూపిస్తాయి.
ii) పరివర్తన లోహాల పరమాణీకరణ ఎంథాల్పీలు అధికంగా ఉంటాయి.
iii) పరివర్తన లోహాలు, సాధారణంగా రంగు గల సమ్మేళనాలను ఏర్పరుస్తాయి.
iv) పరివర్తన లోహాలు, మరియు వాటి అనేక సమ్మేళనాలు మంచి ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
జవాబు:
i) పరివర్తన మూలకాలు ఒంటరి d-ఎలక్ట్రాన్లను కలిగి ఉంటాయి. ప్రతి ఒంటరి ఎలక్ట్రాను అయస్కాంత భ్రామకం ఉంటుంది. ఈ అయస్కాంత భ్రామకం. ఒంటరి ఎలక్ట్రాన్ భ్రమణ కోణీయ భ్రామకం మరియు ఆర్బిటాల్ కోణీయ భ్రామకాలతో కూడి ఉంటుంది. ఈ కారణం చేత పరివర్తన లోహాలు పరాఅయస్కాంత స్వభావాన్ని కలిగి ఉంటాయి.
ii) అత్యధిక పరమాణీకరణ ఎంథాల్పీ కలిగి ఉండుటకు కారణం ఈ పరమాణువులు అధిక సంఖ్యలో ఒంటరి ఎలక్ట్రాన్లను కలిగియుండుట. ఈ పరమాణువులు బలమైన అంతర పరమాణుక అన్యోన్య చర్యలకు అనుకూలం కావున వీటి మధ్య బలమైన బంధాలు ఉంటాయి.
iii) పరివర్తన లోహాలు దృగ్గోచర కాంతిని పాక్షికంగా శోషించుకోవడం వలన రంగు గల సమ్మేళనాలను ఏర్పర్చును. ఎలక్ట్రాన్ నిర్ధిష్ట పౌనఃపున్యం గల (దృగ్గోచర ప్రాంతం) గల వికిరణాన్ని శోషించుకొని తరువాత ఆర్బిటాల్ లోనికి దూకుతుంది.
iv) ఘనపదార్థం ఉపరితలం వద్ద, క్రియాజనకాల అణువులు, ఉత్ప్రేరకం యొక్క ఉపరితల పరమాణువులతో బంధాలను ఏర్పరుస్తాయి. దీని ఫలితంగా ఉత్ప్రేరక ఉపరితలంపై క్రియాజనకాల గాఢత పెరుగును మరియు ఉత్తేజిత శక్తి తగ్గుతుంది. అంతే కాకుండా పరివర్తన లోహ అయాన్లు, బహు ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి. కాబట్టి ఇవి ఎక్కువ ప్రభావాత్మక ఉత్ప్రేరకాలుగా ఉంటాయి.

ప్రశ్న 2.
పొటాషియం పర్మాంగనేట్ తయారీని వర్ణించండి. ఆమ్లీకృత పొటాషియం పర్మాంగనేట్ ద్రావణం క్రింది వాటితో ఎలా చర్య జరుపుతుంది?
(i) ఐరన్(II) అయాన్లు (ii) SO2 (iii) ఆక్జాలిక్ ఆమ్లం లకు అయానీక సమీకరణాలు వ్రాయండి.
జవాబు:
MnO2 ను క్షారలోహ హైడ్రాక్సైడ్, KNO3 లాంటి ఆక్సీకరణితో గలనం చెందించగా పొటాషియం పర్మాంగనేట్ను తయారు చేస్తారు. ఈ చర్యలో ముదురు ఆకుపచ్చ KMnO4 ఏర్పడుతుంది. ఇది తటస్థ లేదా ఆమ్లలేదా ఆమ్ల ద్రావణంలో అననుపాతం చెంది, పొటాషియం పర్మాంగనేట్ను ఇస్తుంది.

ఆమ్ల యానకంలో KMnO4 చర్య
MnO–4 + 8H+ + 5e– → Mn+2 + 4H2O …… (1)
i) ఐరన్(II)అయాన్లు :
ఫెర్రస్ అయాన్లు ఫెర్రిక్ అయాన్గా ఆక్సీకరణం చెందుతాయి.
[Fe+2 → Fe+3 + e–] × 5 …..(2)
సమీకరణం (1) మరియు (2) ల నుండి
5Fe+2 + MnO–4 + 8H+ → Mn+2 + 4H2O + 5Fe+3
ii) SO2 :
ఆమ్లీకృత KMnO4 SO2 నుSO4-2 గా ఆక్సీకరిస్తుంది.
SO2 + 2H2O → SO4-2 + 4H+ + 2e– …. (3)
సమీకరణం (1) మరియు (3) ల నుండి
5SO2 + 2MnO4 + 2H2O → 2Mn+2 + 4H+ + 5SO4-2
iii) ఆక్జాలిక్ ఆమ్లం:
C2O4-2 → 2CO2 + 2e– ……. (4)
సమీకరణం (1) మరియు (4) ల నుండి
5C2O4-2 + 2MnO–4 + 16H+ → 2Mn+2 + 8H2O + 10CO2
ప్రశ్న 3.
క్రింది ధర్మాలకు సంబంధించి, ఆక్టినైడ్ల రసాయన శాస్త్రాన్ని లాంథనైడ్లతో పోల్చండి.
i) ఎలక్ట్రాన్ విన్యాసం
ii) ఆక్సీకరణ స్థితి
iii)పరమాణు మరియు అయానిక పరిమాణాలు
iv)రసాయన చర్యాశీలత
జవాబు:
i) ఎలక్ట్రాన్ విన్యాసం :
లాంథనైడ్ల సాధారణ ఎలక్ట్రాన్ విన్యాసం [Xe]4f1-145d0-16s².
ఆక్టినైడ్ ఎలక్ట్రాన్ విన్యాసము
[Rn] 5f1-146d0-17s².
లాంథనైడ్లు 4f శ్రేణికి చెందినవి. ఆక్టినైడ్లు 5f శ్రేణికి చెందినాయి.
ii) ఆక్సీకరణ స్థితి :
అతి సాధారణ ఆక్సీకరణ స్థితి +3 కాకుండా లాంథనైడ్లు పరిమిత ఆక్సీకరణ స్థితులు (+2,+3,+4) లను ప్రదర్శిస్తాయి. దీనికి కారణం 4f మరియు 5d ఉపకక్ష్యల మధ్య శక్తి అంతరం. మరోవైపు ఆక్టినైడ్లు ఎక్కువ సంఖ్యలో ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి. దీనికి కారణం 5f, 6d మరియు 7S ల మధ్య శక్తి అంతరం తక్కువ.
iii) రెండింటిలోను పరమాణువుల లేదా +3 ఆక్సీకరణ స్థితిలో అయాన్ల పరిమాణం తగ్గును. లాంథనైడ్లలో ఈ తగ్గుదలను లాంథనైడ్ సంకోచం అని అంటారు. అదే విధంగా ఆక్టీనైడ్లలో ఆక్టినైడ్ సంకోచం అంటారు. అయితే ఈ సంకోచం మూలకంనుండి మూలకంకు ఆక్టినైడ్లలో అధికంగా ఉండును. దీనికి కారణం 4f ఎలక్ట్రాన్ల కన్నా 5f ఎలక్ట్రాన్లకు అతిస్వల్ప పరిరక్షక ప్రభావం ఉండుట.
iv) ఆక్టినైడ్ల కంటే లాంథనైడ్లకు సంక్లిష్టాన్ని ఏర్పర్చే ప్రవృత్తి తక్కువగా ఉండును.
లాంథనైడ్లలో ప్రోమితియమ్ మాత్రమే రేడియో ధార్మిక మూలకం మిగిలినవి కావు. అన్ని ఆక్టినైడ్లు రేడియోధార్మిక మూలకాలు.
లాంథనైడ్లు ఆక్సోకాటయాన్లను ఏర్పర్చలేవు.
ఆక్టినైడ్లు ఆక్సో LiO2+2 లాంటి లాంథనైడ్లలో PuO2+2, VO+ మొదలైన ఆక్సైడ్లు మరియు హైడ్రాక్సైడ్లు తక్కువ క్షార స్వభావంను కలిగి ఉంటాయి. కాని ఆక్టినైడ్లు అధిక క్షార స్వభావంను కలిగి ఉంటాయి.
![]()
ప్రశ్న 4.
క్రింది వాటిని ఎలా వివరిస్తారు?
జవాబు:
(i) d4 జాతులలో, Cr2+ బలమైన క్షయకరణి అయితే, మాంగనీస్ (III) బలమైన ఆక్సీకరణి.
(ii) జలద్రావణంలో కోబాల్ట్ (II) కు స్థిరత్వంఉంటుంది. కానీ సంక్లిష్టాలను ఏర్పర్చే కారకాల సమక్షంలో సులభంగా ఆక్సీకరణం చెందుతుంది.
(iii) అయాన్లలో d¹ విన్యాసం చాలా అస్థిరమైనది.
జవాబు:
i) Cr+2 ఎలక్ట్రాన్ విన్యాసము [Ar] 4s°3d4
Mn+3 ఎలక్ట్రాన్ విన్యాసము [Ar] 4s°3d4
Cr+2 మరియు Mn+3 లు ఒకే ఎలక్ట్రాన్ విన్యాసము కలిగి ఉన్నప్పటికి Cr+2 బలమైన క్షయకరణ కారకంగా పని చేస్తుంది. కాని Mn+3 బలమైన ఆక్సీకరణ కారకంగా పనిచేస్తుంది.
కారణం :
Cr+3/Cr+2కు E° విలువ ఋణాత్మకం (–0.41V)గా గాను, Mn+3/Mn+2కు, EO విలువ ధనాత్మకం (+1.57V)గా ఉండును.
కావున Cr+2 అయాన్లు సులువుగా ఆక్సీకరణం చెంది Cr+3 అయాన్లను ఇస్తాయి. కావున Cr+2 క్షయికరణ కారకంగా పనిచేస్తుంది.
Mn+3 అయాన్లు సలువుగా క్షయికరణం చెంది Mn+2 అయాన్లను ఇస్తాయి. కావున Mn+3 బలమైన ఆక్సీకరణ కారకంగా పని చేస్తుంది.
ii) Co(II)కంటే Co(III) కు సమన్వయ సంక్లిష్టాలను ఏర్పర్చే ప్రవృత్తి అధికంగా ఉంటుంది. కాని లైగాండ్ల సమక్షంలో Co(II) తేలికగా ఆక్సీకరణం చెంది Co(III) గా మారుతుంది.
iii) d¹ ఎలక్ట్రాన్ విన్యాసంతో ఉన్న అయాన్ d- ఉపకక్ష్యలో ఉన్న ఒకే ఒక్క ఎలక్ట్రాన్ కోల్పోయి స్థిరమైన d° ఎలక్ట్రాన్ విన్యాసం పొందే ప్రవృత్తిని కలిగి ఉంటుంది. కావున ఇవి అస్థిరమైనవి. మరియు ఆక్సీకరణం(లేక) అననుపాతంను పొందుతాయి.
ప్రశ్న 5.
పరివర్తన లోహాల కింది లక్షణాలకు కారణాలను తెలిపి ఉదాహరణలు ఇవ్వండి.
i) పరివర్తన లోహం యొక్క అల్పస్థాయి ఆక్సైడు క్షార స్వభావం ఉంటే అధికస్థాయి ఆక్సైడ్కు ద్విస్వభావం ఆమ్లస్వభావం ఉంటుంది.
ii) పరివర్తన లోహం, దాని ఆక్సైడ్లలోను, ఫ్లోరైడ్లలో అధిక స్థితిని ప్రదర్శిస్తుంది.
iii) లోహం ఆక్సో అనయాన్లలో అధిక ఆక్సీకరణ స్థితిని ప్రదర్శితమవుతుంది.
జవాబు:
i) తక్కువ ఆక్సీకరణ స్థితి కారణంగా పరివర్తన లోహ అల్ప ఆక్సైడ్లు క్షార స్వభావాన్ని కలిగియండును. అధిక ఆక్సీకరణ స్థితి కారణంగా అధిక ఆక్సైడ్లు ఆమ్ల స్వభావాన్ని కలిగి ఉంటాయి. ఉదాహరణలకు MnO క్షారం Mn2O7 ఆమ్లం.
ii) ఆక్సిజన్ మరియు ఫ్లోరిన్లు తక్కువ పరిమాణం మరియు అధిక ఋణవిద్యుదాత్మకత కారణంగా పరివర్తన మూలకాలు వాటి ఆక్సైడ్ లలోను మరియు ఫ్లోరైడ్లలోను అధిక ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి.
ఉదా: OsF6 లో ఆస్మీయమ్ +6 ఆక్సీకరణ స్థితిని మరియు V2O5లో వెనిడియమ్ .+5 ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి.
iii) లోహం ఆక్సో అనయాన్లలో అధిక ఆక్సీకరణ స్థితిని ప్రదర్శిస్తుంది.
ఉదా: Cr2O7-2 లో Cr యొక్క ఆక్సీకరణ స్థితి +6 MnO4– లో Mn యొక్క ఆక్సీకరణ స్థితి + 7 ఆక్సీజన్ అత్యధిక ఋణవిద్యుదాత్మకత మరియు ఆక్సీకరణ కారకం కారణంచే లోహం ఆక్సీజన్తో సంయోగం చెందును.
ప్రశ్న 6.
క్రింది ధర్మాలకు సంబంధించి, ఆక్టినైడ్ల రసాయన శాస్త్రాన్ని లాంథనైడ్లతో పోల్చండి.
(i) ఎలక్ట్రాన్ విన్యాసం
(ii) ఆక్సీకరణ స్థితి
(iii)పరమాణు మరియు అయానిక పరిమాణాలు
(iv) రసాయన చర్యాశీలత
జవాబు:
i) ఎలక్ట్రాన్ విన్యాసం :
లాంథనైడ్ల సాధారణ ఎలక్ట్రాన్ విన్యాసం [Xe]4f1-145d0-16s².
ఆక్టినైడ్ ఎలక్ట్రాన్ విన్యాసము
[Rn] 5f1-146d0-17s².
లాంథనైడ్లు 4f శ్రేణికి చెందినవి. ఆక్టినైడ్లు 5f శ్రేణికి చెందినాయి.
ii) ఆక్సీకరణ స్థితి :
అతి సాధారణ ఆక్సీకరణ స్థితి +3 కాకుండా లాంథనైడ్లు పరిమిత ఆక్సీకరణ స్థితులు (+2,+3,+4) లను ప్రదర్శిస్తాయి. దీనికి కారణం 4f మరియు 5d ఉపకక్ష్యల మధ్య శక్తి అంతరం. మరోవైపు ఆక్టినైడ్లు ఎక్కువ సంఖ్యలో ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి. దీనికి కారణం 5f, 6d మరియు 7S ల మధ్య శక్తి అంతరం తక్కువ.
iii) రెండింటిలోను పరమాణువుల లేదా +3 ఆక్సీకరణ స్థితిలో అయాన్ల పరిమాణం తగ్గును. లాంథనైడ్లలో ఈ తగ్గుదలను లాంథనైడ్ సంకోచం అని అంటారు. అదే విధంగా ఆక్టీనైడ్లలో ఆక్టినైడ్ సంకోచం అంటారు. అయితే ఈ సంకోచం మూలకంనుండి మూలకంకు ఆక్టినైడ్లలో అధికంగా ఉండును. దీనికి కారణం 4f ఎలక్ట్రాన్ల కన్నా 5f ఎలక్ట్రాన్లకు అతిస్వల్ప పరిరక్షక ప్రభావం ఉండుట.
iv) ఆక్టినైడ్ల కంటే లాంథనైడ్లకు సంక్లిష్టాన్ని ఏర్పర్చే ప్రవృత్తి తక్కువగా ఉండును.
లాంథనైడ్లలో ప్రోమితియమ్ మాత్రమే రేడియో ధార్మిక మూలకం మిగిలినవి కావు. అన్ని ఆక్టినైడ్లు రేడియోధార్మిక మూలకాలు.
లాంథనైడ్లు ఆక్సోకాటయాన్లను ఏర్పర్చలేవు.
ఆక్టినైడ్లు ఆక్సో LiO2+2 లాంటి లాంథనైడ్లలో PuO2+2, VO+ మొదలైన ఆక్సైడ్లు మరియు హైడ్రాక్సైడ్లు తక్కువ క్షార స్వభావంను కలిగి ఉంటాయి. కాని ఆక్టినైడ్లు అధిక క్షార స్వభావంను కలిగి ఉంటాయి.
ప్రశ్న 7.
సమన్వయ సమ్మేళనాల IUPAC నామకరణ విధానాన్ని తగిన ఉదాహరణతో వివరింపుము.
జవాబు:
ఒక సంయోగ పదార్థం ఫార్ములాను ఆ పదార్థం సంఘటనను తెలిపే లఘు వర్ణనగా భావిస్తారు. సమన్వయ సమ్మేళనాలకు నామకరణం చేయడానికి క్రింది నియమాలను IUPAC వారు ప్రతిపాదించారు.
i) సంక్లిష్ట ధనావేశ అయాన్ పేరును ముందు రాసి తరువాత ఋణావేశ అయాన్ పేరు రాయాలి.
ఉదా: పొటాషియం హెక్సా సయనోఫెర్రేట్ (II) ఫార్ములా K4[Fe(CN)6]
ii) సంక్లిష్ట గోళంలో లైగాండ్ పేర్లను లోహం/అయాన్ పేరు గల ముందు రాయాలి. అయితే ఫార్ములా రాసేటప్పుడు లోహ పరమాణువు/అయాన్ సంకేతాన్ని ముందుగా రాయాలి.
ఉదా: టెట్రాఎమీన్ కాపర్ (II) సల్ఫేట్ (Cu(NH3)4]SO4.
iii) సమన్వయ సంక్లిష్ట ఫార్ములాలలో సజాతి లైగాండ్లు ఒకటి కంటే ఎక్కువ ఉంటే వాటి సంఖ్యను పూర్వపదం ద్వారా తెలియజేయాలి. సంక్లిష్ట లైగాండ్ను బ్రాకెట్లలో[ ]రాసి దీని ముందు పూర్వపదాలు బిస్,ట్రిస్లను రాయాలి.
ఉదాహరణలు:

ఉదా: [Co(NH2CH2CH2NH2)2Cl2]Cl ను డైక్లోరో బిస్ (ఇథిలీన్ డై ఎమీన్) కోబాల్ట్ (III) క్లోరైడ్గా రాయాలి.
iv) లైగాండ్ల పేర్లను అక్షర క్రమంలో రాయాలి.
ఉదా: [PtCl2(NH3)2] డై ఎమీన్ డై క్లోరో ప్లాటినమ్ (II)
v) ఋణవిద్యుదావేశ లైగాండ్ల పేర్లను, పేర్ల చివర ‘O’ ను కలిపి రాయాలి. తటస్థ లైగాండ్లను వాటి సహజ పేర్లతోనే రాయాలి.
ఉదా: Cl– క్లోరో, CN– సయనో
పై వాటి మినహాయింపులను క్రింద చూపండి :
| లైగాండ్ | తెలిపే పద్ధతి |
| H2O | ఆక్వా |
| NH3 | ఎమీన్ |
| CO | కార్బొనైట్ |
| NO | నైట్రోసైల్ |
vi) లోహ అయాన్ యొక్క ఆక్సీకరణ స్థితిని బ్రాకెట్లో రోమన్ అంకెలతో సూచిస్తారు.
ఉదా: [Ag(NH3)2][Ag(CN)2] డై ఎమీన్ సిల్వర్ (I) డై సయనో అర్జెంటేట్ (I)గా రాయాలి.
vii) సంక్లిష్ట భాగం విద్యుదావేశం ఋణవిద్యుదావేశం అయితే లోహం పేరు చివర ఏట్(ate) గా రాయాలి.
ఉదా: [Co(SCN)4)2- – టెట్రాథయోసయనేట్ కోబాల్టేట్ (II)
కొన్ని లోహాలకు వాటి గ్రీకు, లాటిన్ పేర్లను వాడుతున్నాం కాబట్టి వాటి ఆధారంగా పేర్లను రాయాలి.
ఉదా: Fe-ఫెర్రెట్ Pb-ప్లంబేట్ Sn-స్టానేట్ Ag-అర్జెంటేట్ Au-ఆరేట్
viii) సంక్లిష్టాలలో లైగాండ్లు పక్కపక్క స్థానాలలో ఉన్నాయాలేదా ఒకదానికి మరొకటి వ్యతిరేక దిశలో. ఉన్నాయా అనే దానికి అనుసరించి వాటి పేర్ల ముందు సిస్ లేదా ట్రాన్స్ అనే పూర్వపదం రాయాలి.
ఉదా:
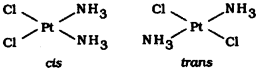
ix) సంక్లిష్టంలో రెండు లోహ అయాన్లను కలుపుతూ బ్రిడ్జ్ లైగాండ్లు ఉంటే ఆ సమన్వయ లైగాండ్ను µ అనే గ్రీకు అక్షర పూర్వ పదం ఉంచి రాయాలి.
ఉదా: [(NH3)4 Co(OH)(NH2) Co(NH3)4]+ యొక్క పేరు µ-ఎమిడో-µ హైడ్రాక్సోబిస్(టెట్రాఎమిన్) కోబాల్ట్ (IV) సమన్వయ సమ్మేళనాలు నామకరణానికి కొన్ని ఉదాహరణలు.
1) [Cr(NH3)3(H2O)3]Cl3 ట్రై ఎమీన్ ట్రై ఆక్వా క్రోమియం (III) క్లోరైడ్
2) [Co(H2NCH2CH2NH2)3]2(SO4)3 ట్రిస్ (ఈథేన్-1,2-డై ఎమీన్) కోబాల్ట్ (III) సల్ఫేట్
3) [Ag(NH3)2][Ag(CN)2] డై ఎమీన్ సిల్వర్(I) డై సయనో అర్జెంటేట్ (I)
ప్రశ్న 8.
సమన్వయ సమ్మేళనాలు ప్రదర్శించే వివిధ రకాల అణుసాదృశ్యాలను తగిన ఉదాహరణలతో వివరించండి.
జవాబు:
ఒకే రసాయన ఫార్ములా కలిగి ఉండి వేరు వేరు పరమాణువుల అమరికలను కలిగియున్న సమ్మేళనాలను ఐసోమర్లు లేదా సాదృశ్యకాలు అంటారు. విభిన్న త్రిమితీయ పరమాణు అమరికలను కలిగి ఉండటం కారణంగా ఈ సాదృశ్యకాలు ఒకటి లేదా అంత కన్నా ఎక్కువ భౌతిక లేదా రసాయన ధర్మాలలో భేదంను ప్రదర్శించును. ఈ సంక్లిష్ట సమ్మేళనాలు ప్రధానంగా రెండు సాదృశ్యాలను ప్రదర్శిస్తాయి. ఇవి ప్రాదేశిక సాదృశ్యం, నిర్మాణాత్మక సాదృశ్యం.
a) ప్రాదేశిక సాదృశ్యం :
ఒకే అణుఫార్ములా, ఒకే అణు నిర్మాణం ఉండి, లైగాండ్ల ప్రాదేశిక అమరికలో భేదం కనపరచే రెండు సమన్వయ సమ్మేళనాలు ప్రదర్శించే సాదృశ్యమే ప్రాదేశిక సాదృశ్యం దీనిని రెండు వర్గాలుగా విభజిస్తారు. (i) క్షేత్ర సాదృశ్యం (ii) దృక్ సాదృశ్యం
b) నిర్మాణాత్మక సాదృశ్యం :
i. బంధ సాదృశ్యం ii. సమన్వయ సాదృశ్యం iii. అయనీకరణ సాదృశ్యంiv. హైడ్రేట్ సాదృశ్యం క్షేత్ర సాదృశ్యం: సమన్వయ సంక్లిష్టాలలో లైగాండ్లకు విభిన్న జ్యామితీయ అమరికలు సాధ్యమవడం వల్ల ఈ సాదృశ్యం సంభవిస్తుంది. సమన్వయ సంఖ్యలు 4 మరియు 6 గల సంక్లిష్టాలు ఈ రకం సాదృశ్యానికి ముఖ్య ఉదాహరణలు.
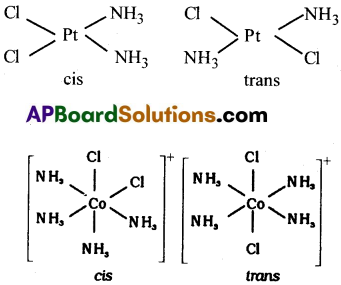
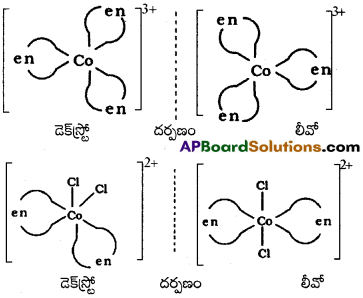
MX2L2 (X మరియు L లు ఏకదంత లైగాండ్లు), ఫార్ములాతో సూచించబడిన సమతల చతురస్త్ర సంక్లిష్టంలో X లైగాండ్లు రెండూ ఒకదానికొకటి పక్క పక్కన లేదా. వ్యతిరేక దిశలోను ఉండే అవకాశం ఉంది. పక్క పక్కన ఉన్నట్లైతే సిస్ సాదృశ్యం అని, వ్యతిరేక దిశలో ఉన్నట్లైతే ట్రాన్స్ సాదృశ్యం అని పటంలో చూపించిన విధంగా పరిగణిస్తాం.
MABXL (ఇచ్చట A, B, X, Lలు4 ఏకదంత లైగాండ్లు) అనే ఇతర సమతల చతురస్ర సంక్లిష్టం, మూడు సదృశ్యాకాలను రెండు సిస్, ఒక ట్రాన్స్ ఏర్పరుస్తుంది. ఈ రకం ప్రవర్తన టెట్రా హెడ్రల్ జ్యామితి గల సంక్లిష్టాలలో తటస్థపడదు. [MX2L4] ఫార్ములా గల ఆక్టాహెడ్రల్ సంక్లిష్టాలలో సాధ్యపడుతుంది. రెండు X లు సిస్ విన్యాసంలో లేదా ట్రాన్స్ విన్యాసంలో ఉంటాయి.
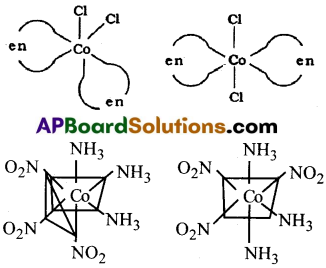
L-L (ఉదా: NH2CH2CH2NH2 (en)] లాంటి ద్విదంత (బైడెంటేట్) లైగాండ్లు గల [MX2(L-L)2]ఫార్ములా ప్రదర్శించే సంక్లిష్టాలలో కూడా ఈ రకం సాదృశ్యం ప్రాప్తిస్తుంది. [Co(NH3)3(NO2)3] వంటి [Ma3b3] రకం ఆక్టాహెడ్రల్ సమన్వయ సమూహాలలో (సంక్లిష్టాలలో) వేరొక రకం క్షేత్ర సాదృశ్యం తటస్థ పడుతుంది. దీనిలో అదే లైగాండ్లకు చెందిన మూడుదాత పరమాణువులు సంక్లిష్టం నిర్మాణంలో ఆక్టాహెడ్రల్ ఫలకం (face) లో పక్క పక్క స్థానాలను ఆక్రమిస్తాయి. వీటిని ఫేషియల్ (fac)సాదృశ్యాకాలు అంటారు. అయితే ఆక్టాహెడ్రల్ సంక్లిష్టంలో దాత పరమాణువులు గల మూడు లైగాండ్లు ఆక్టాహెడ్రన్ మెరిడియన్ చుట్టూ వ్యాప్తి చెంది ఉంటే, ఆ సాదృశ్యకాన్ని మెరిడోనియల్ సాదృశ్యకం అంటారు.
దృక్ సాదృశ్యం :
రెండు సాదృశ్యకాలు ఒకదానికొకటి అధ్యారోపితం కాని బింబ, ప్రతిబింబాలుగా ఉంటే దృక్ సాదృశ్యం ప్రాప్తిస్తుంది. ఈ రకం సాదృశ్యకాలను దృక్ సాదృశ్యకాలు లేదా ఎనాన్షియోమర్లు అంటారు. అధ్యారోపితం కాని అణువులు లేదా అయాన్లను కైరల్ అణువులు లేదా అయాన్లు అంటారు. పొలారిమీటర్ సమతల ధ్రువిత కాంతి సమతలాన్ని భ్రమణం చేసే దిశ ఆధారంగా (కుడివైపుకు అయితే(d) ఎడమ వైపుకు అయితే (1) ఈ రెండు రూపాలను (సాదృశ్యకాలను) డెక్స్ట్రో (d) లీవో (1) అంటారు. ద్విదంత (బై డెంటేట్) లైగాండ్లు గల ఆక్టాహెడ్రల్ సంక్లిష్టాలలో దృక్ సాదృశ్యం సామాన్యంగా ప్రాప్తిస్తుంది.
[PtCl2(en)2]2+ సంక్లిష్టంలో సిస్ సాదృశ్యకం మాత్రమే ధ్రువణ భ్రమణతను ప్రదర్శిస్తుంది.
బంధ (లింకేజి ) సాదృశ్యం :
బంధ సాదృశ్యకం చూపించే సమన్వయ అణువు/అయాన్లో ఒక ఏంబిడేంటేట్ (సమన్వయ బంధాలు ఏర్పరచగల కనీసం రెండు వేరు వేరు పరమాణువులున్న) లైగాండ్ ఉండాలి. NCS , లైగాండ్ గల సంక్లిష్టం ఒక ఉదాహరణ. ఒక బంధ సంక్లిష్టంలో M-NCS బంధం ఏర్పడితే రెండో బంధ సంక్లిష్టంలో M-SCN. ఏర్పడుతుంది.. మొదటిదానిలో లోహ పరమాణువు నైట్రోజన్ సమన్వయ బంధం (M-N). రెండో దానిలో లోహ పరమాణువు -సల్ఫర్ పరమాణువు సమన్వయ బంధం (M-S) ఏర్పడుతుంది. ఇటువంటి సాదృశ్యకాలను మొదటగా జోర్గెన్సన్ గుర్తించాడు. [Co(NH3)5(NO2)]Cl2, ను రెండు రంగుల్లో గుర్తించాడు. అందులో ఎరుపురంగు సాదృశ్యకంలో (CO-O-NO) బంధం అనగా Co పరమాణువు NO2 గ్రూపుల్లోని ఆక్సిజన్ పరమాణువు మధ్య బంధం ఏర్పడుతుంది. పసుపు పచ్చ సాదృశ్యకంలో బంధం అనగా పరమాణువులోని నైట్రోజన్ పరమాణువు మద్య బంధం ఏర్పడుతాయి.
సమన్వయ సాదృశ్యం :
సంక్లిష్టంలో ఉండే విభిన్న లోహాలలోని కాటయానిక్, ఆనయానిక్ సమూహాల మధ్య లైగాండ్లు వినిమయం చెందడంవల్ల ఈ రకమైన సాదృశ్యం ఏర్పడుతుంది. ఉదాహరణకు [Co(NH3)6][Cr(CN)6], ఈ రెండు సంక్లిష్టాలలో మొదటి దానిలో Co3+ తో NH3 లైగాండ్లు ఆరు సమన్వయ బంధాలను ఏర్పరిస్తే, Cr3+ తో CN– లు ఆరు సమన్వయ బంధాలను ఏర్పరుస్తాయి. అదే రెండో సంక్లిష్టంలో Cr3+ తో NH3 అణువులు Co3+తో సయనైడ్ అయాన్ CN–లు ఆరు సమన్వయ బంధాలు ఏర్పరుస్తాయి. ఇటువంటి ఐసోమర్లను సమన్వయ సాదృశ్యకాలు అంటారు.
అయనీకరణ సాదృశ్యం :
సంక్లిష్ట సమ్మేళనంలోని ప్రతి అయాన్ కూడా లైగాండ్గా పనిచేయగలిగితే ఈ రకం సాదృశ్యం ప్రాప్తిస్తుంది. సమన్వయ సంక్లిష్టంలో లోహ పరమాణువు లేక అయాన్తో ఉన్న లైగాండ్ స్థానభ్రంశం గావించబడుతుంది. అది ప్రతి అయాన్గా బయటకు వస్తుంది.
ఉదాహరణ : [Co(NH3)5SO4]Br, [Co(NH3)5Br]SO4.లు అయనీకరణ సాదృశ్యకాలు.
హైడ్రేట్ సాదృశ్యం :
నీరు ద్రావణిగా పని చేయడం కారణంగా ఈ సాదృశ్యకాన్ని హైడ్రేట్ సాదృశ్యం అంటారు. ఇది అయనీకరణ సాదృశ్యం లాంటిదే. హైడ్రేట్ సాదృశ్యకాలలో నీటి అణువులు లోహ అయాన్లతో నేరుగా సమన్వయ బంధం ఏర్పరచగలిగేవి గాను లేదా స్వేచ్ఛా నీటి అణువులుగా స్ఫటిక జాలకంలో ఉండేవి గాను రెండు విధాలుగా ఉండవచ్చు. ఉదాహరణకి [Cr(H2O)6]Cl, జలసంక్లిష్టం ఉదారంగు సంక్లిష్టం అదే దాని హైడ్రేట్ సాదృశ్యకం [Cr(H2O)5Cl]Cl2.H2O (బూడిద – ఆకు పచ్చరంగు సంక్లిష్టం).
![]()
ప్రశ్న 9.
వేలాన్స్ బంధ సిద్ధాంతం ఆధారంగా కింది సమన్వయ సమూహాలలో బంధ స్వభావాన్ని, అయస్కాంత స్వభావాన్ని చర్చించండి.
(i) [Fe(CN)6]4-
(ii) [FeF6]3-
(iii) [Co(C2O4)3]3-
(iv) [CoF6]3-
జవాబు:
(i) [Fe(CN)6]4- :
ఇచ్చట Fe యొక్క ఆక్సీకరణ స్థితి +2 కావున
బలమైన లైగాండ్ CN– సమక్షంలో హుండ్ నియమానికి వ్యతిరేకంగా జంటలు ఏర్పడును మరియు d²sp³ సంకరీకరణం జరుగును.
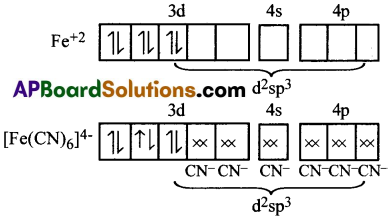
ఇప్పుడు CN– కు ఆరు d²sp³ హైబ్రిడ్ ఆర్బిటాల్లు అందుబాటులో ఉండను.
ఫలితంగా ఏర్పడిన సంక్లిష్ట అయాన్ ఆక్టాహెడ్రల్ మరియు డయా అయస్కాంత పదార్థం. ఇందులో ఒంటరి ఎలక్ట్రాన్లు లేక పోవుటవలన (n-1)d ఆర్బిటాల్లు సంకరీకరణంలో పాల్గొనుట వలన సంక్లిష్ట అయాన్ అంతర్ ఆర్బిటాల్ లేదా తక్కువ భ్రమణ సంక్లిష్ట అయాన్ అని పిలుస్తారు.
(ii) [FeF6]3- :
ఈ సంక్లిష్టంలో Fe యొక్క ఆక్సీకరణ స్థితి+3.
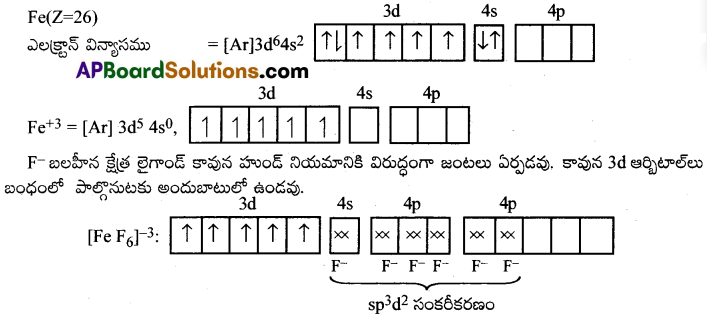
5 ఒంటరి ఎలక్ట్రాన్లు సంక్లిష్టం పరాఅయస్కాంత ధర్మంను ప్రదర్శిస్తుంది. ఐతే కాకుండా బాహ్య d ఆర్బిటాల్లు సంకరీకరణంలో పాల్గొంటాయి. కావున ఇది బాహ్య ఆర్బిటాల్ లేదా అధిక భ్రమణం సంక్లిష్టం అని అంటారు.
(iii) [Co(C2O4)3]3- :
ఈ సంక్లిష్టంలో Co +3. ఆక్సీకరణ స్థితిలో ఉండును. Co+3
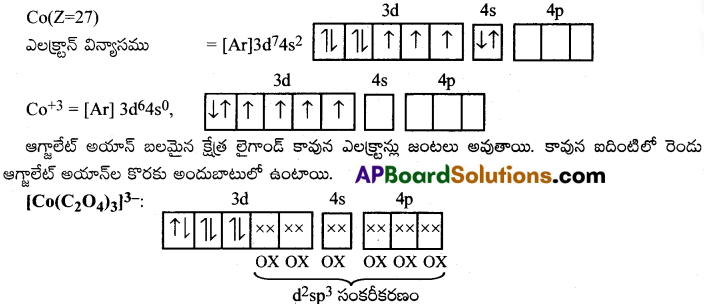
ఇప్పుడు అన్ని ఎలక్ట్రాన్లు జంటగా ఏర్పడతాయి. కావున ఇది డయా అయస్కాంత సంక్లిష్టం . బంధంలో ఆర్బిటాల్లు పాల్గొన్నాయి. కావున దీనిని అంతర్ ఆర్బిటాల్ సంక్లిష్టం అని అంటారు.
(iv) [CoF6]3- :
ఈ సంక్లిష్టంలో Co +3 ఆక్సీకరణ స్థితిలో ఉండును.
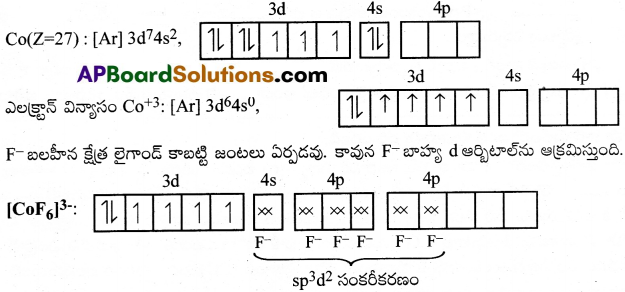
నాలుగు ఒంటరి ఎలక్ట్రాన్లు ఉండుట వలన ఇది పరా అయస్కాంత సంక్లిష్టం.
దీనికి బాహ్య ఆర్బిటాల్ బంధంలో పాల్గొనుట వలన దీనిని బాహ్య ఆర్బిటాల్ సంక్లిష్ట అయాన్ లేదా అధిక భ్రమణ సంక్లిష్ట అయాన్ అని పిలుస్తారు.
ప్రశ్న 10.
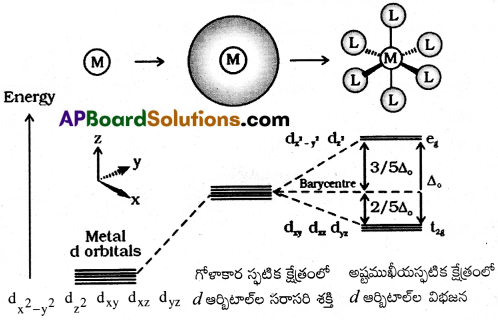
అష్టముఖీయ స్పటిక క్షేత్రంలో ఆర్బిటాల్ల విభజనకు రేఖా పటం గీయండి.
జవాబు:
ప్రశ్న 11.
వర్ణపట రసాయన శ్రేణి అంటే ఏమిటి? దుర్బల క్షేత్ర లైగాండ్కు ప్రబల క్షేత్ర లైగాండ్కు మధ్యగల భేదాన్ని వివరించండి.
జవాబు:
క్షేత్ర బలాలు పెరిగే క్రమంలో లైగాండ్లను అమరుస్తారు. అనగా స్ఫటిక క్షేత్ర విభజన పెరిగే శక్తి విలువలను వర్ణపటరసాయన శ్రేణి అంటారు.
I– < Br– < S2- < SCN– < Cl– < N3- < F– < OH– < C2O4-2 < H2O< NCS– <NH3 < en < CN– < CO
తక్కువ శక్తి కలిగిన లైగాండ్లను బలహీన క్షేత్ర లైగాండ్లు అంటారు. అలాంటి లైగాండ్లకు ∆0 < P ఇక్కడ P అనగా ఎలక్ట్రాన్లు జతకూడటానికి అవసరమయ్యే శక్తి. అయితే ఎక్కువ శక్తి కలిగిన లైగాండ్లను బలమైన క్షేత్ర లైగాండ్లు అంటారు. ఈ విధమైన లైగాండ్ల విషయంలో ∆0 > P.
లైగాండ్లు పరివర్తన లోహ అయాన్కు దగ్గరగా వచ్చినప్పుడు d-ఆర్బిటాల్లు రెండుగా విభజన చెందుతాయి. (t2g మరియు eg),ఒకటి (మూడు) అల్పశక్తి మరియు మరొకటి (రెండు) అధిక శక్తి ఆర్బిటాల్గా విభజన చెందుతాయి. రెండు ∆0 ఆక్టాహెడ్రల్ క్షేత్రం మరియు ∆t చతుర్ముఖీయం క్షేత్రాల మధ్య శక్తి భేదాన్ని స్ఫటిక క్షేత్ర విభజన అని అంటారు.
∆0 < P అయితే నాల్గవ ఎలక్ట్రాన్ eg ఆర్బిటాల్లో ఒకదానిలోకి చేరుతుంది. అప్పుడు t³2geg¹ విన్యాసం ప్రాప్తిస్తుంది. అలాంటి లైగాండ్లకు ∆0 < P గా ఉంటుంది. కావున ఆ లైగాండ్లను బలహీన క్షేత్రలైగాండ్లు అంటారు. ఇవి అధిక స్పిన్ సంక్లిష్టాలను ఏర్పరుస్తాయి.
∆0 > P, అయితే నాల్గవ ఎలక్ట్రాన్ t2g ఆర్బిటాల్లోకి చేరి t42geg0, విన్యాసాన్ని పొందడం సౌలభ్యంగా ఉంటుంది. ∆0 > P గా ఉన్న లైగాండ్లను బలమైన క్షేత్ర లైగాండ్లు అంటారు. ఇవి తక్కువ స్పిన్ సంక్లిష్టాలను ఇస్తాయి.
ప్రశ్న 12.
లోహ కార్బొనైల్లలో బంధ స్వభావాన్ని చర్చించండి.
జవాబు:
లోహ కార్బొనైల్లలోని లోహ కార్బన్ బంధానికి సిగ్మా (σ) బంధ, మరియు పై (π) బంధ లక్షణాలు రెండూ ఉంటాయి. కార్బొనైల్ కార్బన్ మీద ఉన్న ఒంటరి ఎలక్ట్రాన్ జంటను లోహ పరమాణువు యొక్క ఖాళీ ఆర్బిటాల్ లోనికి పంపుతుంది. దీని వలన సిగ్మా బంధం ఏర్పడుతుంది. π బంధం మాత్రం జంట ఎలక్ట్రాన్లతో నిండి ఉన్న లోహ పరమాణువు d-ఆర్బిటాల్ CO అణువులో ఉన్న ఖాళీ (π*) అపబంధక ఆర్బిటాల్లోని ఎలక్ట్రాన్ జంటను పంపడం వల్ల ఏర్పడుతుంది. సినర్జిక్ ప్రభావంతో లోహ-లైగాండ్ (CO) బంధం మరింత బలపడుతుంది.
![]()
ప్రశ్న 13.
వివిధ రంగాలలో సమన్వయ సమ్మేళనాల అనువర్తనాలను వివరించండి.
జవాబు:
1) గుణాత్మక, పరిమాణాత్మక రసాయన విశ్లేషణల్లో సమన్వయ సంక్లిష్టాలు ఉపయోగపడుతాయి. దీనికి ఉపయోగపడే కొన్ని కీలేట్ కారకాలు ఇథిలిన్ డై ఎమీన్ టెట్రాఎసిటిక్ ఆమ్లం EDTA దాని ఉత్పన్నాలు, డైమిథైల్ గ్లైఆక్సైమ్ (DMG), α–నైట్రోసో, -β- నాఫ్తాల్ క్యూప్రాన్ మొదలైనవి.
2) కఠిన జలంలోని Mg+2 మరియు Ca+2లను EDTAవంటి కీలేట్ కారకాలను ఉపయోగించి జల కఠినత్యను పరిమాణాత్మకంగా విశ్లేషణ చేయవచ్చు.
3) దాతువును సంక్లిష్టం ఏర్పర్చుట ద్వారా సిల్వర్ మరియు గోల్డ్ వంటి లోహాలను నిష్కరిస్తారు. ఈ పద్ధతిలో లోహ స్థానభ్రంశం చెందుతుంది.
ఉదా: AgCl + 2NaCN → Na[Ag(CN)2] + NaCl
2Na[Ag(CN)2] + Zn → Na2[Zn(CN)4] + 2Ag↓
4) Ni, Co, Fe వంటి లోహాలను శుద్ధిచేయడానికి వాటితో సమన్వయ సంక్లిష్టాలను ఏర్పర్చి వాటిని వియోగం చెందిస్తే శుద్ధ లోహాలు వస్తాయి.
Δ [Ni(CO)4]- →Ni+4CO
పై పద్ధతిలో మాండే విధానంలో ‘Ni’ ని శుద్ధి చేస్తారు.
5) జీవ వ్యవస్థలో సమన్వయ సమ్మేళనాల పాత్ర ముఖ్యమైనది.
i) మొక్కలలోని క్లోరోఫిల్ Mg+2అయాన్ యొక్క సంక్లిష్టం ఉండును.
ii) విటమిన్ B12 (సయనోకోబాలమైన్) అనునది CO+3 అయాన్ యొక్క సంక్లిష్టం.
iii) హిమోగ్లోబిన్ నందు హీమ్ అనునది Fe+2అయాన్ యొక్క సంక్లిష్టం.
iv) కార్బాక్సీ పెప్టైడెజ్ మరియు కార్బోనిక్ అనైడ్రజ్లు జీవరసాయన చర్యలలో ఉత్ప్రేరకాలు.
6) సంక్లిష్టాలను అనేక పారిశ్రామిక చర్యలో ఉత్ప్రేరకాలుగా ఉపయోగిస్తారు. రోడియం సంక్లిష్టాన్ని [(Ph3P)3RhCl] ఆల్కీన్లను హైడ్రోజనీకరణంలో ఉపయోగిస్తారు.
7) ఫోటోగ్రాఫీ నందు హైపోను క్షయకరణం చెందని AgBr ను నీటిలో కరిగే సంక్లిష్టంను ఏర్పర్చుటకు ఉపయోగిస్తారు. ఈప్రక్రియను డెవలపింగ్ అంటారు.
8) ఈ మధ్యకాలంలో సంక్లిష్టాలను వైద్య శాస్త్రంలో వ్యాధులకు చికిత్స చేయుటకు ఉపయోగిస్తున్నారు.
ఉదా: లెడ్ విషతుల్యంను చికిత్స చేయుటకు EDTA ను ఉపయోగిస్తున్నారు.