Students get through AP Inter 2nd Year Chemistry Important Questions Lesson 6(c) 17వ గ్రూపు మూలకాలు which are most likely to be asked in the exam.
AP Inter 2nd Year Chemistry Important Questions Lesson 6(c) 17వ గ్రూపు మూలకాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
ఏ హాలోజన్ ను నీటి ద్వారా పంపించిన O2 మరియు O3 ల మిశ్రమాన్ని ఏర్పరుస్తుంది.
జవాబు:
ఫ్లోరిన్ ను నీటి ద్వారా పంపించినపుడు O2 మరియు O3 ల మిశ్రమాన్ని ఏర్పరుస్తుంది.
2F2 + 2H2O → 4HF + O2
3F2 + 3H2O → 6HF + O3
ప్రశ్న 2.
అంతర హాలోజన్ సమ్మేళనాలకు, ఫ్లోరిన్ మినహా మిగిలిన అనుఘటక హాలోజన్ల కంటే ఎక్కువ చర్యాశీలత ఉంటుంది. వివరించండి.
జవాబు:
సాధారణంగా అంతర హాలోజన్ సమ్మేళనాలు హాలోజన్లు (ఫ్లోరిన్ మినహా) అధిక చర్యాశీలతను కలిగి ఉంటాయి. దీనికి కారణం అంతర హాలోజన్లో X−X’ బంధము హాలోజన్లలో X-X బంధం కన్నా బలహీనంగా ఉంటుంది. ( F-F బంధం మినహా)
ప్రశ్న 3.
ClF3 యొక్క ఉపయోగం ఏమిటి?
జవాబు:
U235 ను సంపనం చేసే ప్రక్రియలో UF6 ను ఉత్పత్తి చేయుటకు ClF3 ని ఉపయోగిస్తారు.
U(s) + 3ClF3(l) → UF6(g) + 3ClF(g)
ప్రశ్న 4.
ClO2 యొక్క రెండు ఉపయోగాలను వ్రాయండి.
జవాబు:
- కాగితం గుజ్జు, బట్టలను విరంజనం చేయడానికి మరియు నీటిని శుద్ధిచేయుటకు ClO2 ను ఉపయోగిస్తారు.
- దీనిని బలమైన ఆక్సీకరణ మరియు క్లోరినేటింగ్ కారకాలుగా ఉపయోగిస్తారు.
ప్రశ్న 5.
హాలోజన్లకు రంగులు ఎందుకు ఉన్నాయి?
జవాబు:
అన్ని హాలోజన్లకు రంగు కలదు. ఈ రంగుకి కారణం వీటి అణువులు దృగ్గోచర ప్రాంతంలో కాంతిని అభిశోషించుకుంటాయి. దీని ఫలితంగా బాహ్య ఎలక్ట్రాన్లు అధికశక్తి స్థాయిలోని ఉత్తేజితం చెందుతాయి. మిగిలిన కాంతి పరివర్తనం చెందుతుంది.
హాలోజన్ల రంగు:
ఫ్లోరిన్ – పసుపు
సీనియర్ కెమిస్ట్రీ S-మెటీరియల్
క్లోరిన్ లేత ఆకుపచ్చ బ్రోమిన్- ఎరుపు
అయోడిన్ – ఉదారంగు
![]()
ప్రశ్న 6.
నీటితో F2 మరియు Cl2 ల చర్యలను వ్రాయుము. [AP 19][TS 17][IPE ’14]
జవాబు:
F2 బలమైన ఆక్సీకరణ కారకం. ఇది H2O ను O2 మరియు O3 గా ఆక్సీకరిస్తుంది.
2F2(g) + 2H2O(l) → 4HF(aq) + O2(g)
3F2(g) + 3H2O(l) → 6HF(aq) + O3(g)
Cl2 నీటితో చర్యజరిపి హైడ్రోక్లోరిక్ ఆమ్లం మరియు హైపోక్లోరస్ ఆమ్లం ఏర్పరుస్తుంది.
Cl2(g) + H2O(l) → HCl(aq) + HOCl(aq)
ప్రశ్న 7.
ఏ తటస్థ అణువుతో ClO– సమ ఎలక్ట్రాన్గా ఉంటుంది? అది ఒక లూయీ క్షారమా? కాదా?
జవాబు:
ClO–లో 17+ 8 + 1 = 26 ఎలక్ట్రాన్లు
26 ఎలక్ట్రాన్లతో ఉన్న తటస్థ అణువు
ClF (17 + 9 = 26 e–)
ClF లూయిస్ క్షారం. తరువాత ఇది ఎలక్ట్రాన్లను రెండు లేదా అంతకంటే ఎక్కువ ‘F’ పరమాణువులకు ఎలక్ట్రాన్లను దానం చేసి ClF3ను ఏర్పర్చుకొంటుంది.
ప్రశ్న 8.
ఈ క్రింది వాటిని ప్రతిసమితికి సూచించిన ధర్మం క్రమంలో అమర్చండి.
a) F2, Cl2, Br2, I2, – బంధన విఘటన ఎంథాల్పీ పెరిగే క్రమం
b) HF, HCl, HBr, HI – ఆమ్లత్వం పెరిగే క్రమం
c) HF, HCl, HBr, HI – భాష్పీభవన స్థానాలు పెరిగే క్రమం
జవాబు:
a) I2(151.1 kJ mol-1) < F2 (158.8 kJ mol-1) < Br2 (192.8 kJ mol-1) < Cl2 (242.6 kJ mol-1)
b) HF < HCl < HBr < HI
c) HCl < HBr < HI < HF
ప్రశ్న 9.
ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ క్లోరిన్ కంటే ఫ్లోరిన్కు తక్కువ. వివరించండి.
జవాబు:
ఫ్లోరిన్ యొక్క పరమాణు పరిమాణం చాలా తక్కువ. క్లోరిన్ కంటే ఫ్లోరిన్లో అంతర ఎలక్ట్రాన్ల వికర్షణలు అధికంగా ఉంటాయి.
అందువల్ల ఫ్లోరిన్ యొక్క ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ క్లోరిన్ కంటే తక్కువ.
ప్రశ్న 10.
HF ద్రవం కాని HCl వాయువు. వివరింపుము.
జవాబు:
HF లో అణువుల మధ్య అంతర్వణుక హైడ్రోజన్ బంధాలు ఉంటాయి. కాని HCl లో అణువుల మధ్య బలహీనమైన వాండర్వాల్ ఆకర్షణ బలాలు ఉంటాయి. కావున HF ద్రవం HCl వాయువు.
ప్రశ్న 11.
బంధ విఘటన ఎంథాల్పీ Cl2 కంటే F2 కు తక్కువ. వివరింపుము.
జవాబు:
క్లోరిన్ అల్ప పరమాణు పరిమాణం కారణంగా రెండు ఫ్లోరిన్ పరమాణువుల మీద ఉన్న ఒంటరి జంట ఎలక్ట్రాన్ల మధ్య వికర్షణలు బలంగా ఉంటాయి. అందువలన బంధం బలహీనమగును.
ఈ ఫలితంగా బంధ విఘటన ఎంథాల్పీ Cl2 కంటే F2కు తక్కువ.
![]()
ప్రశ్న 12.
ఆక్సిజన్ ధనాత్మక ఆక్సీకరణ స్థితులను ప్రదర్శించే సమ్మేళనాల ఫార్ములాలు వ్రాయుము. మరియు వాటిలో ఆక్సిజన్ ఆక్సీకరణ స్థితులు ఏమిటి?
జవాబు:
O2F2 లో ఆక్సిజన్ యొక్క ఆక్సీకరణ స్థితి +1
OF2 లో ఆక్సిజన్ యొక్క ఆక్సీకరణ స్థితి +2
ప్రశ్న 13.
O2F2 మరియు I2O5 ల యొక్క ఉపయోగాలు ఏమిటి?
జవాబు:
O2F2 బలమైన ఆక్సీకరణ మరియు ఫ్లోరినీకరణ కారకం
H2S + 4O2F2 → SF6 + 2HF + 4O2
వాతావరణంలో మరియు ఇతర వాయు మిశ్రమంలో CO ని గుర్తించుటకు మరియు లెక్కించుటకు I2O5 ఉపయోగపడుతుంది.
![]()
ప్రశ్న 14.
హైడ్రోజన్ క్లోరైడ్ యొక్క రెండు ఉపయోగాలను వ్రాయుము.
జవాబు:
- దీనిని అక్వారీజియా తయారీకి ఉపయోగిస్తారు.
- అద్దకం తయారీ మరియు పంచదార పరిశ్రమలలో HCl ను ఉపయోగిస్తారు.
ప్రశ్న 15.
NaOH తో Cl2 చర్యలను వివరింపుము.
జవాబు:
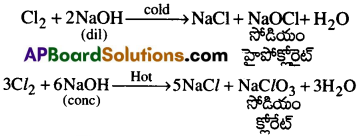
ప్రశ్న 16.
పొడి స్లెక్డ్ లైమ్ తో Cl2 చర్య జరిపితే ఏమౌతుంది? [AP17] [TS-18]
జవాబు:
పొడి స్లెక్డ్ లైమ్ తో క్లోరిన్ చర్య జరిపి బ్లీచింగ్ పౌడర్ (విరంజన చూర్ణం)ను ఏర్పరుస్తుంది.
Ca(OH)2 + Cl2 → CaOCl2.H2O
ప్రశ్న 17.
క్లోరిన్ ఆక్సీకరణిగా పనిచేస్తుంది. దీనిని రెండు ఉదాహరణలతో వివరింపుము.
జవాబు:
క్లోరిన్ నీటిలో కరిగి క్లోరిన్ జలంను ఏర్పరుస్తుంది. కొంత కాలం తర్వాత HCl మరియు HOCl ఏర్పడుట కారణంగా క్లోరిన్ జలం పసుపు రంగును కోల్పోతుంది. HOCl అస్థిరమైనది ఇది విఘటనం చెంది నవజాత ఆక్సిజన్ను ఏర్పరచి క్లోరిన్ యొక్క ఆక్సీకరణ ధర్మాలకు కారణంగా ఉంటుంది.
Cl2 + H2O → [HCl + HOCl] → 2HCl + (O)
ఇది ఆమ్లీకృత ఫెర్రస్ను ఫెర్రిక్గా ఆక్సీకరిస్తుంది.
2FeSO4 + H2SO4 + Cl2 →Fe2(SO4)3 + 2HCl
ఇది సల్ఫైట్ను సల్ఫేట్గా ఆక్సీకరిస్తుంది.
Na2SO3 + Cl2 + H2O → Na2SO4 + 2HCl
![]()
ప్రశ్న 18.
ద్రవరాజం (ఆక్వారీజియా) అనగానేమి? బంగారం మరియు ప్లాటినంతో దాని చర్యలను వ్రాయండి.
జవాబు:
మూడు భాగాల గాఢ HCl మరియు ఒక భాగం గాఢ HNO3 లను కలిపితే ఆక్వారీజియ ఏర్పడుతుంది. దీనిని బంగారం మరియు ప్లాటినమ్ వంటి ఉత్కృష్ట లోహాలను కరిగించడానికి ఉపయోగిస్తారు.
Au + 4H+ + NO–3 + 4Cl– → AuCl–4 + NO + 2H2O
3pt + 16H+ + 4NO–3 + 18Cl– → 3[ptCl6]-2 + 4NO + 8H2O
ప్రశ్న 19.
డీకన్ పద్ధతి ద్వారా క్లోరిన్ ను ఎలా ఉత్పత్తి చేస్తారు? [TS 16][AP 17,19]
జవాబు:
డీకాన్ విధానం :
హైడ్రోజన్ క్లోరైడ్ వాయువును వాతావరణ ఆక్సిజన్తో CuCl2 ఉత్ప్రేరకం సమక్షంలో 723K ఉష్ణోగ్రత వద్ద ఆక్సీకరణం చెందించి క్లోరిన్ ను ఉత్పత్తి చేస్తారు.
![]()
ప్రశ్న 20.
తేమ సమక్షంలో మాత్రమే క్లోరిన్ విరంజనకారిగా పనిచేస్తుంది. వివరింపుము. [TS-16]
జవాబు:
క్లోరిన్ విరంజన చర్యకు కారణం తేమ సమక్షంలో మాత్రమే ఇది ఆక్సిజన్ను విడుదల చేస్తుంది.
Cl2 + H2O → 2HCl + (O)
కావున ఇది తేమ సమక్షంలో మాత్రమే విరంజకారిగా పని చేస్తుంది. తేమ సమక్షంలో ఇది వృక్ష సంబంధ లేక కర్బన పదార్థాలను విరంజనం చేస్తుంది. రంగు పదార్థం +(O) → రంగులేని పదార్థం.
ప్రశ్న 21.
హైపోహాలన్ ఆమ్లాల ఆమ్లత్వం తగ్గే క్రమం HClO > HBrO > HIOగా ఉంటుంది. కారణం తెలపండి.
జవాబు:
హాలోజన్ ఋణవిద్యుదాత్మకత (తగ్గుతుంది) తగ్గే క్రమంలోనే హైపో హాలస్ ఆమ్లాల యొక్క ఆమ్లత్వం తగ్గుతుంది.
ప్రశ్న 22.
క్లోరిన్ ఆక్సోఆమ్లాల ఆమ్ల స్వభావం HOCl < HClO2 < HClO3 < HClO4– వివరింపుము.
జవాబు:
ఒకే హాలోజన్ ఏర్పర్చే ఆక్సో ఆమ్లాలో ఆక్సీకరణ సంఖ్య పెరిగే కొలదీ ఆమ్ల బలం కూడా పెరుగును.

ఆనయాన్ నందు ఆక్సిజన్ పరమాణువుల సంఖ్య ఎంత ఎక్కువగా ఉంటే ఋణావేశ వితరణం pπ-dπ బంధం ద్వారా అంత అధికంగా జరుగుతుంది. కనుక ఆనయాన్ కు అధిక స్థిరత్వం ఉండును.
ఆనయాన్ యొక్క స్థిరత్వం పెరిగే క్రమం
ClO– < ClO–2 < ClO–3 < ClO–4,గా ఉండును కనుక ఆమ్ల స్వభావం కూడా అదే క్రమంలో పెరుగుతుంది.
HClO < HClO2 < HClO3 < HClO4
ప్రశ్న 23.
అంతర హాలోజన్ సమ్మేళనాలు అనగానేమి? రెండు ఉదాహరణలిమ్ము?
జవాబు:
రెండు భిన్న హాలోజన్లు ఒక దానితో ఒకటి కలిసి ఏర్పరచే సమ్మేళనాలు అంతర హాలోజన్ సమ్మేళనాలు అంటారు. ఇవి నాలుగు రకాలు: XX’, XX’3, XX’5 మరియు XX’7. ఇచ్చట X పెద్ద హాలోజన్.
ఉదా: IF7, ClF3.
![]()
ప్రశ్న 24.
ClF3 నిర్మాణాన్ని వివరింపుము.
జవాబు:
భూస్థితిలో క్లోరిన్ ఎలక్ట్రాన్ విన్యాసము
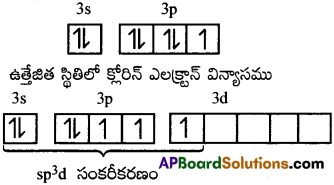
ClF3 ట్రైగోనల్ బై పిరమిడల్ నిర్మాణంలో ఉంటుందని భావిస్తాము.కాని ప్రయోగాత్మకంగా బంధకోణం 90°లతో T ఆకృతిలో ఉండును. ఈ విచలనానికి కారణం ఒంటరి జంట ఎలక్ట్రాన్లు.
ప్రశ్న 25.
OF2 ను ఆక్సిజన్ డై ఫ్లోరైడ్ అనాలి కానీ ఫ్లోరిన్ ఆక్సైడ్ అని కాదు. ఎందుకు?
జవాబు:
ఫ్లోరిన్ కు ఆక్సిజన్ కంటే ఋణవిద్యుదాత్మక ఎక్కువగా ఉంటుంది. అందువలన OF2 ను ఫ్లోరిన్ ఆక్సైడ్ అని కాకుండా ఆక్సిజన్ డైఫ్లోరైడ్ అని పిలుస్తారు.
ప్రశ్న 26.
అయోడిన్ నీటిలో కంటే KI లో బాగా కరుగుతుంది. వివరించండి.
జవాబు:
అయోడిన్ KI తో సంయోగం చెంది నీటిలో కరిగే KI3 సంక్లిష్టాన్ని ఏర్పరుస్తుంది. కావున అయోడిన్ నీటిలో కంటే KI లో ఎక్కువగా కరుగుతుంది.
ప్రశ్న 27.
హాలోజన్ల హైడ్రైడ్లలో
a) ఏది అత్యంత స్థిరమైనది?
b) ఏది బలమైన ఆమ్లం?
c) దేనికి కనిష్ట భాష్పీభవన స్థానం ఉంటుంది?
జవాబు:
a) హైడ్రోజన్ బంధాలను కలిగి ఉండుట కారణంగా HF అత్యంత స్థిరమైనది.
b) తక్కువ బంధ విచ్ఛేదన ఎంథాల్పీ కారణంగా HI బలమైన ఆమ్లం.
c) బలహీన వాండర్వాల్ బలాలను కలిగి ఉండుట వలన HClకు కనిష్ట భాష్పీభవన స్థానం ఉంటుంది.
ప్రశ్న 28.
Cl2 మరియు SO2 ల విరంజన క్రియలను పోల్చండి.
జవాబు:
Cl2 యొక్క విరంజన చర్యకు కారణం శాశ్వతమైన ఆక్సీకరణం
Cl2 + H2O → 2HCl + (O)
SO2 యొక్క విరంజన చర్యకు కారణం తాత్కాలికమైన క్షయకరణం.
SO2 + 2H2O → H2SO4 + 2[H]
తేమ సమక్షంలో మాత్రమే Cl2 మరియు SO2 లు రెండునూ విరంజన కారకాలుగా పని చేస్తాయి.
ప్రశ్న 29.
ఈ క్రింది వాటిలో హాలోజన్ల ఆక్సీకరణ స్థితులను తెల్పుము. [TS-15]
a) Cl2O b) ClO2– c) KBrO3 d) NaClO4
జవాబు:
a) Cl2O లో ‘Cl’ యొక్క ఆక్సీకరణ స్థితి +1
b) CIO2– ‘Cl’ యొక్క ఆక్సీకరణ స్థితి +3
c) KBrO3 లో ‘Br’ యొక్క ఆక్సీకరణ స్థితి +5
d) NaClO4, లో ‘Cl యొక్క ఆక్సీకరణ స్థితి +7
![]()
ప్రశ్న 30.
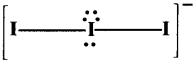
I3– అణువు ఆకృతిని వర్ణించండి.
జవాబు:
I3– లో కేంద్రక పరమాణువు I, sp³d సంకరీకరణంలో పాల్గొంటుంది. ట్రై గోనల్ బైపిరమిడ్ యొక్క రెండు ఆకీయ స్థానాలను ‘I’ పరమాణువులు యొక్క సంకర ఆర్బిటాల్లు ఆక్రమిస్తాయి. మరియు మిగిలిన మూడు లంబ మధ్య స్థానాలను మూడు ఒంటరి ఎలక్ట్రాన్ జంటలు ఆక్రమించి ఉంటాయి.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
HCl నుండి Cl2 ను మరియు Cl2 నుండి HClను ఎలా తయారు చేయగలరు? చర్యలను వ్రాయుము. [AP-16]
జవాబు:
MnO2 ను గాఢ HCl తో వేడి చేయుట ద్వారా క్లోరిన్ ను తయారు చేస్తారు.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Cl2 మరియు H2లను నేరుగా కలుపుట ద్వారా హైడ్రోజన్ క్లోరైడ్ను పొందవచ్చును.
H2 + Cl2 → 2HCl
ప్రశ్న 2.
ఈ క్రింది వాటికి తుల్య సమీకరణాలను వ్రాయుము.
a) MnO2 గాఢ H2SO4 సమక్షంలో NaCl ను వేడి చేయుట
b) Nal జలద్రావణం గుండా క్లోరినన్ను పంపిన.
జవాబు:
a) 4NaCl + MnO2 + 4H2SO4 → MnCl2 + 4NaHSO4 + 2H2O + Cl2.
b) Cl2 + 2Nal → 2NaCl + I2.
ప్రశ్న 3.
(a) BrF5 (b) IF7 ల నిర్మాణాలను వివరింపుము.
జవాబు:
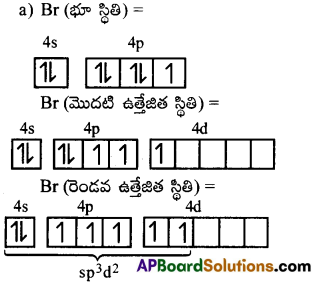
BrF5 లో బ్రోమిన్ sp³d² సంకరీకరణంలో పాల్గొంటుంది. ఊహించిన ఆకృతి ఆక్టాహైడ్రాల్ కాని ప్రయోగాత్మకంగా సమతల పిరమిడల్ ఆకృతిని సూచిస్తుంది. ఈ విచలనానికి కారణం ఒక ఒంటరి ఎలక్ట్రాన్ జంట.
b) I (భూ స్థితి) =
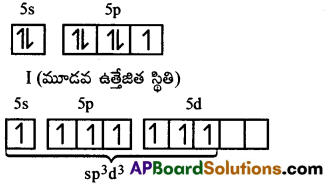
IF7 లో అయోడిన్ sp³d³ సంకరీకరణంలో పాల్గొంటుంది. కావున దీనికి పెంటాగోనల్ బై పిరమిడల్ ఆకృతి ఉంటుంది.
ప్రశ్న 4.
హాలోజన్ల హైడ్రైడ్లపై లఘువ్యాఖ్య వ్రాయుము.
జవాబు:
గ్రూపు 17 మూలకాలు అన్ని HX (X=F, Cl, Br, I) అనే రకము హైడ్రైడ్లను ఏర్పరుస్తాయి.
హైడ్రోజన్ పరంగా హాలోజన్ల చర్యాశీలత ఫ్లోరిన్ నుండి అయోడిన్ కు తగ్గుతుంది.
హైడ్రోజన్ బంధాల కారణంగా HF మాత్రమే ద్రవం మిగిలిన అన్ని వాయువులు.
బంధ విచ్ఛేదన శక్తి తగ్గుట కారణంగా గ్రూపులో పై నుండిక్రిందికి(HF>HCl>HBr>HI) ఉష్టీయస్థిరత్వం తగ్గుతుంది.
హాలైడ్ల స్థిరత్వం తగ్గుట వలన HF నుండి HI కు క్షయకరణ స్వభావం పెరుగుతుంది.
బంధ విఘటన శక్తి తగ్గుట వలన ఆమ్లాల ఆమ్ల స్వభావం HF నుండి HI కు పెరుగుతుంది.
ప్రశ్న 5.
ప్రయోగశాలలో క్లోరిన్ ను ఎలా తయారు చేస్తారు? ఈ క్రింది వాటితో అది ఎలా చర్య జరుపుతుంది.
(a)చల్లని విలీనNaOH (b) అధిక NH3 (c) KI [TS 22][AP 16,17]
జవాబు:
MnO2 ను గాఢ HCl తో చర్య నొందించుట ద్వారా ప్రయోగశాలలో క్లోరిన్ తయారు చేస్తారు.
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
a) క్లోరిన్ చల్లని, విలీన క్షార ద్రావణాలతో చర్య జరిపి క్లోరైడ్, హైపోక్లోరైట్ల మిశ్రమాన్ని ఇస్తుంది.
2NaOH + Cl2 → NaCl + NaOCl + 3H2O
b) అధిక అమ్మోనియాతో క్లోరిన్ చర్య జరిపి నైట్రోజన్తో పాటు అమ్మోనియం క్లోరైడ్ను ఇస్తుంది.
8NH3 + 3Cl2 → 6NH4Cl + N2
c) క్లోరిన్ KIతో చర్య జరిపి దానిలోని అయోడిన్ను స్థానభ్రంశం చెందిస్తుంది.
2KI + Cl2 → 2KCl + I2
![]()
ప్రశ్న 6.
అంతర హాలోజన్ సమ్మేళనాలు అంటే ఏమిటి? నిర్వచనాన్ని చిత్రించడానికి ఉదాహరణలు ఇవ్వండి. వాటిని ఏలా వర్గీకరిస్తారు?
జవాబు:
రెండు భిన్న హాలోజన్లు ఒక దానితో ఒకటి కలిసి ఏర్పరచే సమ్మేళనాలు అంతర హాలోజన్ సమ్మేళనాలు అంటారు. ఇవి నాలుగు రకాలు: XX’, XX’3, XX’5 మరియు XX’7. ఇచ్చట X పెద్ద హాలోజన్.
ఉదా: ClF3, IF7.
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
ClF3 ని ఎలా తయారు చేస్తారు? నీటితో ఇది ఎలా చర్య జరుపుతుంది. దాని నిర్మాణాన్ని వివరించండి.
జవాబు:
క్లోరిన్ ను అధిక ఫ్లోరిన్తో చర్య నొందించి ClF3 ని తయారు చేస్తారు.
![]()
CIF3 నీటితో చర్య నొందించినపుడు అది జల విశ్లేషణ చెంది హైడ్రోఫ్లోరిన్ ఆమ్లంను ఏర్పరుస్తుంది.
CIF3 + 2H2O → 3HF + HClO2
ClF3 లో Cl యొక్క భూస్థితి ఎలక్ట్రాన్ విన్యాసము
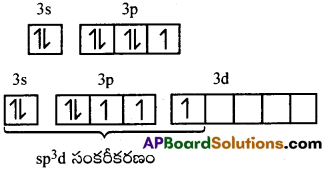
ఉత్తేజిత స్థితిలో Cl యొక్క ఎలక్ట్రాన్ విన్యాసము
ClF3 కి ఉండవలసిన నిర్మాణం ‘ట్రైగోనల్ బై పిరమిడల్’ కాని ప్రయోగపూర్వకంగా బంధకోణం 90° లతో వంగిన T- ఆకృతిని కలిగి ఉంటుంది. ఈ విచలనానికి కారణం ఒంటరి జంట ఎలక్ట్రాన్లు.
ప్రశ్న 2.
ప్రయోగశాలలో క్లోరిన్ను ఎలా తయారు చేస్తారు? ఈ క్రింది వాటిలో అది ఎలా చర్య జరుపుతుంది. [TS 15,16,19] [AP 15,18]
a) ఐరన్ b) వేడి,గాఢ NaOH c) ఆమ్లీకృత FeSO4 d) అయొడిన్ e) H2S f) Na2S2O3.
జవాబు:
సోడియం క్లోరైడ్, మాంగనీస్ డై ఆక్సైడ్ మరియు గాఢ H2SO4 ల మిశ్రమంను వేడి చేసి ప్రయోగశాలలో క్లోరినన్ను తయారు చేస్తారు.
4NaCl + 4H2SO4 + MnO2 → 4NaHSO4 + MnCl2 + 2H2O + Cl2
a) క్లోరిన్, ఐరన్తో చర్య జరిపి ఫెర్రిక్ క్లోరైడ్ను ఏర్పరుస్తుంది.
2Fe + 3Cl2 → 2FeCl3
b) క్లోరిన్, వేడి గాఢ NaOH తో చర్య జరిపి క్లోరైడ్, క్లోరేట్లను ఏర్పరుస్తుంది.
6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
c) H2SO4 సమక్షంలో క్లోరిన్ ఫెర్రస్ సల్ఫేట్ను ఫెర్రిక్ సల్ఫేట్గా ఆక్సీకరిస్తుంది.
2FeSO4 + H2SO4 + Cl2 → Fe2(SO4)3 + 2HCl
d) నీటి సమక్షంలో క్లోరిన్ అయొడిన్న అయొడేట్గా ఆక్సీకరిస్తుంది.
I2 + 6H2O + 5C2 → 2HIO3 + 10HCl
e) H2S ను క్లోరిన్ సల్ఫర్గా అవక్షేపితం చేస్తుంది.
H2S + Cl2 → 2HCl + S
f) క్లోరిన్, Na2S2O3 తో చర్య జరిపి సల్ఫర్ను అవక్షేపితం చేస్తుంది.
Na2S2O3 + Cl2 + H2O → Na2SO4 + 2HCl + S
ప్రశ్న 3.
ఫ్లోరిన్ అసంగత ప్రవర్తనను చర్చించండి.
జవాబు:
ఫ్లోరిన్ యొక్క అసంగత ప్రవర్తనకు కారణం (i) దాని అల్ప పరిమాణం (ii) అత్యధిక ఋణవిద్యుదాత్మకత (iii) F-F కు గల అల్ప బంధ విచ్ఛేదన ఎంథాల్పీ మరియు (iv) వేలన్సీ కర్పరంలో d-ఆర్బిటాల్లు లేకపోవుట.
కొన్ని ఉదాహరణలు:
a) d- ఆర్బిటాల్లు వేలన్సీ స్థాయిలో అందుబాటులో లేకపోవుట వలన ఇది దాని అష్టకంను విస్తరించుకోలేదు. కనుకనే -1 అను ఒకే ఒక ఆక్సీకరణ స్థితిని ప్రదర్శించును. ఇతర హాలోజన్లు d-ఆర్బిటాల్ను కలిగి ఉండుట వలన +1, +3, +5 మరియు +7 అను ధన ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి.
b) అతి స్వల్ప పరమాణు పరిమాణం కలిగి ఉండుటచే ‘F’ పరమాణువు నందు గల మూడు ఒంటరి ఎలక్ట్రాన్ జంట మధ్య వికర్షణ అధికంగా ఉండును. దీని ఫలితంగా F-F బంధ విచ్ఛేదన ఎంథాల్పీCl-Cl కంటే తక్కువగా ఉంటుంది.
c) ఇతర హాలోజన్లు అనేక ఆక్సో ఆమ్లాలను ఏర్పర్చగా ఇది ఆక్సో ఆమ్లాలను ఏర్పర్చదు.
ప్రశ్న 4.
విద్యుద్విశ్లేషణ పద్ధతి ద్వారా క్లోరిన్ను ఎలా తయారు చేస్తారు? దాని చర్యను (a) NaOH (b) NH3 తో వివిధ పరిస్థితులలో వివరించండి. [AP 15,16,22]
జవాబు:
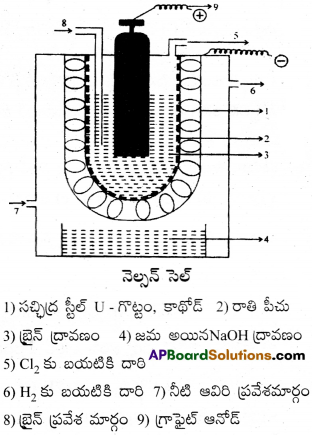
విద్యుద్విశ్లేషణ పద్దతి ద్వారా క్లోరిన్ తయారీ:
- నెల్సన్ ఘట్టములో బ్రైన్ ద్రావణం (Aq.NaCl Solution) ను విద్యుద్విశ్లేషణం గావించి క్లోరిన్ను తయారు చేస్తారు.
- నెల్సన్ ఘట్టము ‘U’ ఆకారపు సచ్ఛిద్ర స్టీలు గొట్టమును కలిగి ఉంటుంది..
- బ్రైన్ ద్రావణంను ‘U’ ఆకారపు పాత్రలో విద్యుద్విశ్లేష్యంగా తీసుకుంటారు.
- ఇది కాథోడ్ వలె పని చేస్తుంది.
- గ్రాఫైట్ కడ్డీని బ్రైన్ ద్రావణంలో ముంచుతారు. ఇది ఆనోడ్ వలె పనిచేస్తుంది.
- ఆనోడ్ వద్ద క్లోరిన్ బయటకు వచ్చును.
విద్యుద్విశ్లేషణ చర్యలు:
అయనీకరణము: 2NaCl → 2Na+ + 2Cl–
ఆనోడ్ వద్ద : 2Cl– → Cl2 + 2e–
కాథోడ్ వద్ద: 2H2O + 2e– → 2OH– + H2 ↑
2Na+ + 2OH– → 2NaOH
క్లోరిన్ చర్యలు:
a) (i) ఇది చల్లని విలీన క్షారాలతో చర్యనొంది క్లోరైడ్ మరియు హైపోక్లోరైట్లను ఇస్తుంది.
2NaOH + Cl2 → NaCl + NaOCl + H2O
(ii) ఇది వేడి, గాఢ క్షార ద్రావణాలతో చర్య జరిపి క్లోరైడ్ మరియు క్లోరేట్ల మిశ్రమాన్ని ఇస్తుంది.
6NaOH + 3Cl2 → 5 NaCl + NaClO3 + 3H2O
b) (i) అధిక క్లోరిన్ అమ్మోనియాతో చర్య జరిపి NCl3 ని ఏర్పరుస్తుంది.
NH3 + 3Cl2 → NCl3 + 3HCl
(ii) క్లోరిన్ అధిక అమ్మోనియాతో చర్య జరిపి N2 ను ఏర్పరుస్తుంది.
8NH3 + 3Cl2 → N2 + 6NH4Cl
![]()
ప్రశ్న 5.
క్లోరిన్ ఆక్సోఆమ్లా పేర్లు, నిర్మాణాలు వ్రాయండి. వాటి నిర్మాణాలను మరియు సాపేక్ష ఆమ్ల స్వభావాన్ని వివరించండి.
జవాబు:
క్లోరిన్ హైపో క్లోరస్ ఆమ్లం (HOCl), క్లోరస్ ఆమ్లం (HClO2), క్లోరిక్ ఆమ్లం (HClO3) మరియు పర్ క్లోరిక్ ఆమ్లం (HClO4) లాంటి నాలుగు ఆక్సో ఆమ్లాలను ఏర్పరుస్తుంది.
క్లోరిన్ యొక్క అన్ని ఆక్సో ఆమ్లాలు sp³ – సంకరీకణంలో పాల్గోంటాయి.
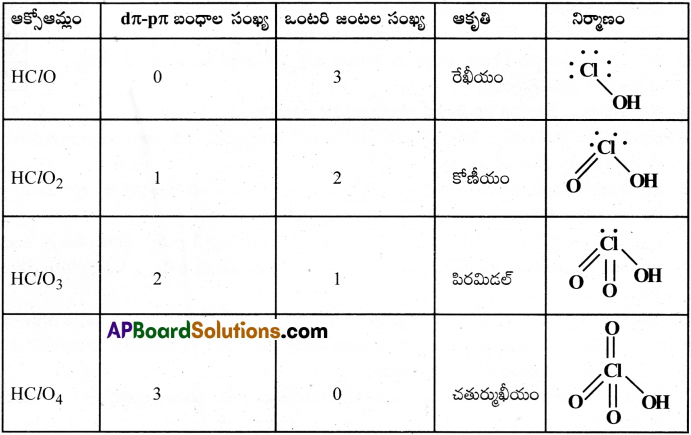
ఆమ్ల స్వభావం :
ఒకే హాలోజన్ ఏర్పర్చే ఆక్సోఆమ్లాల యొక్క ఆమ్లస్వభావం ఆక్సీకరణ సంఖ్య పెరుగుదలతోపాటు పెరుగుతుంది.
![]()
దీనిని ప్రోటాన్ విడుదల చేయగా ఏర్పడిన ఆనయాన్(సంయుగ్మ క్షారం) యొక్క సాపేక్ష స్థిరత్వం ద్వారా వివరించవచ్చు
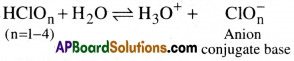
ఆనయాన్ నందు ఆక్సిజన్ల పరమాణువుల సంఖ్య ఎంత ఎక్కువగా ఉండే ఋణావేశ వితరణం pπ-dπ బంధం ద్వారా అంత అధికంగా జరుగుతుంది. కనుక ఆనయాన్కు అధిక స్థిరత్వం ఉంటుంది.
ఆనయాన్ స్థిరత్వం పెరిగే క్రమం:
ClO– < ClO–2 < ClO–3 < ClO–4
కావున ఆమ్ల స్వభావం కూడా అదే క్రమంలో పెరుగుతుంది.
HClO < HClO2 < HClO3 < HClO4