Students get through AP Inter 1st Year Chemistry Important Questions 3rd Lesson రసాయన బంధం – అణు నిర్మాణం which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 3rd Lesson రసాయన బంధం – అణు నిర్మాణం
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
అష్టక నియమం అంటే ఏమిటి? [Imp.Q][TS 22]
జవాబు:
“ఒక పరమాణువుకు స్థిరత్వం ఉండాలంటే దాని బాహ్యతమ శక్తి స్థాయిలో ఎనిమిది ఎలక్ట్రాన్లు ఉండాలి” అనే నియమాన్ని అష్టక నియమం అంటారు.
ప్రశ్న 2.
S, S-2 లకు లూయీ ఎలక్ట్రాన్ చుక్కల సంకేతాలు రాయండి.
జవాబు:
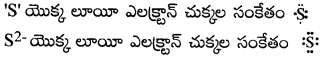
ప్రశ్న 3.
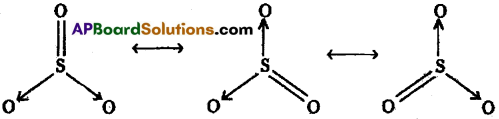
SO3 కి వీలయినన్ని రెజొనెన్స్ నిర్మాణాలు రాయండి.
జవాబు:
SO3 రెజోనెన్స్ నిర్మాణాలు:
ప్రశ్న 4.
AlCl3 + Cl– → AlCl4 చర్యలో Al పరమాణువుల సంకరీకరణంలో మార్పు ఏమైనా ఉంటే ఊహించి రాయండి. [Imp.Q]
జవాబు:
AlCl3, లో అల్యూమినియం sp² సంకరీకరణాన్ని కలిగి ఉండును. AlCl–4 లో అల్యూమినియం sp³ సంకరీకరణాన్ని కలిగి ఉండును. కావున ఇచ్చిన చర్యలో అల్యూమినియం sp² సంకరీకరణం నుండి sp³ కు మారును.
ప్రశ్న 5.
Ca2+, Zn2+ లలో ఏది స్థిరమైనది. ఎందువల్ల? [Imp.Q][TS 22]
జవాబు:
Zn2+ కన్నా Ca2+ అధిక స్థిరమైనది.
కారణం:
ఏదైనా పరమాణువు లేదా అయాను యొక్క సూడో జడవాయువు ఎలక్ట్రాన్ విన్యాసంలో కన్నా జడవాయువు ఎలక్ట్రాన్ విన్యాసంలోనే అధిక స్థిరత్వాన్ని కలిగి ఉండును.
Ca2+(2, 8, 8) జడవాయువు ఎలక్ట్రాన్ విన్యాసం కలిగి ఉన్నది. Zn2+ (2, 8, 18) సూడో జడవాయువు ఎలక్ట్రాన్ విన్యాసం కలిగి ఉన్నది.
![]()
ప్రశ్న 6.
Cl– అయాను Cl పరమాణువు కంటే స్థిరమైనది. ఎందువల్ల? [Imp.Q]
జవాబు:
క్లోరిన్ అణువునకు దాని సమీప జడ వాయువు ఆర్గాన్ ఎలక్ట్రాన్ విన్యాసం కంటే ఒక ఎలక్ట్రాన్ తక్కువగా ఉండును కావున అది అస్థిరము. కాని Cl– నకు ఆర్గాన్ ఎలక్ట్రాన్ విన్యాసము ఉంటుంది కావున ఇది స్థిరముగా ఉండును.
ప్రశ్న 7.
ఆర్గానన్ను Ar2 గా ఎందుకు రాయకూడదు?
జవాబు:
‘Ar’ పరమాణువు జంట ఎలక్ట్రాన్లతో కూడిన అష్టక విన్యాసాన్ని కలిగి స్థిరత్వాన్ని కలిగి ఉన్నది. కావున అది ఆర్గాన్ పరమాణువుతో ఎలక్ట్రాన్లను పంచుకోదు. కావున ఆర్గాన్ పరమాణువు ద్విపరమాణుక అణువులను ఏర్పరచదు.
ప్రశ్న 8.
ఒక పరమాణువు చుట్టూ నాలుగు బంధ జంటల ఎలక్ట్రాన్లుంటే వాటి మధ్య కనిష్ట వికర్షణలు ఉండేటట్లు ఎట్లా అమర్చాలి?
జవాబు:
ఒక పరమాణువు చుట్టూ నాలుగు బంధ జంటల ఎలక్ట్రాన్లుంటే వాటి మధ్య కనిష్ట వికర్షణలు ఉండేటట్లు అమర్చాలంటే టెట్రాహెడ్రల్ ఆకృతిలో అమర్చాలి. (బంధకోణం 109°28¹.)
ప్రశ్న 9.
A, B లు రెండు వేర్వేరు పరమాణువులయితే అవి ‘AB’ అణువునిస్తే ఆ అణువులో సమయోజనీయ బంధం ఎప్పుడు ఉంటుంది?
జవాబు:
- ఒక అణువునకు ధనవిద్యుదాత్మకత ఎక్కువగాను మరొక అణువునకు ఋణవిద్యుదాత్యకత ఎక్కువగా ఉండాలి.
- ఆ రెండింటి విద్యుదాత్మకతల భేదము 1.7 కంటే ఎక్కువగా ఉండాలి.
- ఒక అణువు నుండి మరొక అణువునకు ఎలక్ట్రాన్ల బదిలి జరగాలి.
ప్రశ్న 10.
స్థానీకృత ఆర్బిటాళ్ళు అంటే ఏమిటి?
జవాబు:
బంధకత పరమాణువుల మధ్యగల అతిపాత ఆర్బిటాళ్ళను స్థానీకృత ఆర్బిటాళ్ళు అంటారు.
![]()
ప్రశ్న 11.
a) C2H2 b) C2H4 ఈ రెండు అణువుల్లో వరసగా దేనిలో ఎన్ని సిగ్మా పై బంధాలయున్నాయో తెలపండి.
జవాబు:
a) H-C≡C-H.(C2H4) ఇందులో 3 సిగ్మా, 2 పై బంధాలుంటాయి. [TS 22]

ప్రశ్న 12.
BF3 + NH3 → F3B NH3 ఈ చర్యలో బోరాన్, నైట్రోజన్ పరమాణువుల సంకరీకరణంలో మార్పు ఉంటుందా? ఉంటే ఏమిటి? [Imp.Q]
జవాబు:
BF3లో B పరమాణువు sp² సంకరీకరణాన్ని మరియు NH3 లో N పరమాణువు sp³ సంకరీకరణాన్ని కలిగి ఉండును. [F3B←NH3] సమ్మేళనం ఏర్పడిన తరువాత ఇవి రెండు sp³. సంకరీకరణాన్ని కలిగి ఉండును.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
అయానిక సంయోగ పదార్థాల సాధారణ ధర్మాలు రాయండి.?
జవాబు:
1. భౌతిక స్థితి :
సాధారణంగా అయానిక పదార్థాల ఘన స్ఫటికాకృతిని కలిగి వుంటాయి.
2. చర్యాశీలత :
సజల ద్రావణాలలో అయానిక సమ్మేళనాల చర్యలన్నీ వేగంగా జరుగుతాయి.
3. సాదృశ్యం :
అయానిక బంధం దిశా లక్షణాలు లేనిది. కాబట్టి సాదృశ్యాలను చూపించవు.
4. ద్రావణీయత :
అయానిక సమ్మేళనాలు ధృవ ద్రావణులైన నీరు మరియు ధృవ అమ్మోనియాలో కరుగుతాయి.
5. విద్యుద్వాహకత :
సజల ద్రావణాల్లోను కరిగిన స్థితిలోనూ, అయానిక పదార్ధాలు విద్యుత్ను ప్రసరింపచేస్తాయి.
6. ధ్రవీభవన మరియు భాష్పీభవన స్థానాలు :
ఇవి అధిక ద్రవీభవన, బాష్పీభవన స్థానాలను కలిగి ఉండును.
ప్రశ్న 2.
σ, π- బంధాలంటే ఏమిటి? వాటి మధ్య భేదాలు వ్రాయండి?
జవాబు:
| σ-బంధము | π-బంధము |
| 1. ఆర్బిటాళ్ళ అంత్యఅతిపాతం వల్ల ఏర్పడే సంయోజనీయ బంధాన్నే σ- బంధము అంటారు. | 1. ఆర్బిటాళ్ళ పార్శ్వ అతిపాతం వల్ల ఏర్పడే సంయోజనీయ బంధాన్నే π- బంధము అని అంటారు. |
| 2. σ- బంధము బలమైన బంధం | 2. π-బంధము బలహీనమైన బంధం |
| 3. పరమాణువులు స్వేచ్ఛా భ్రమణతను కల్పిస్తుంది. | 3. పరమాణువుల స్వేచ్ఛా భ్రమణతను నిరోధిస్తుంది. |
| 4. ఇది స్వతంత్రమైనది. | 4. ఇది స్వతంత్రమైనది కాదు. |
| 5. σ-బంధాలు, అణువుల ఆకృతులను నిర్ధారిస్తాయి. | 5. π-బంధాలు, అణువుల ఆకృతులపై ఎలాంటి ప్రభావాన్ని చూపవు. |
| 6. రెండు పరమాణువుల మధ్య ఒక σ-బంధం మాత్రమే ఏర్పడుతుంది. | 6. రెండు పరమాణువుల మధ్య ఒకటి (లేదా) రెండు π-బంధాలు ఏర్పడవచ్చు. |
![]()
ప్రశ్న 3.
హైడ్రోజన్ బంధం అంటే ఏమిటి? విభిన్న హైడ్రోజన్ బంధాలను ఉదాహరణలతో వివరించండి. [AP,TS 16,17,18,19]
జవాబు:
హైడ్రోజన్ బంధం :
ఒక అణువులోని హైడ్రోజన్ పరమాణువుకు, అదే అణువులోని లేదా వేరొక అణువులోని అధిక ఋణవిద్యుదాత్మక పరమాణువుకు మధ్య గల బలహీనమైన స్ధిర విద్యుత్ ఆకర్షణ బలమును హైడ్రోజన్ బంధం అంటారు.
హైడ్రోజన్ బంధం ఏర్పడటానికి నియమములు : [TS 22]
- ఋణ విద్యుదాత్మకత గల పరమాణువు యొక్క పరిమాణం చిన్నదిగా వుండాలి.
- ఋణ విద్యుదాత్మకత ఎక్కువగా గల పరమాణువుతో మాత్రమే హైడ్రోజన్ బంధం ఏర్పడును.
హైడ్రోజన్ బంధం యొక్క బలం :
హైడ్రోజన్ బంధం యొక్క బలం 5 నుండి 10 K Cal/mol.ల మధ్య వుంటుంది. ఇది, కోవలెంట్ బంధం కంటే తక్కువగాను, వాండర్వాల్ బలాల ఆకర్షణల కంటే ఎక్కువగాను వుంటుంది.
హైడ్రోజన్ బంధాలలోని రకాలు :
i) అణ్వంతర హైడ్రోజన్ బంధాలు
ii) అంతరణుక హైడ్రోజన్ బంధాలు
i) అణ్వంతర హైడ్రోజన్ బంధం :
ఒకే అణువులోని హైడ్రోజన్ పరమాణువుకు మరియు అధిక ఋణవిద్యుదాత్మకత మూలకానికి మధ్య గల హైడ్రోజన్ బంధాన్ని అణ్వంతర హైడ్రోజన్ బంధం అంటారు.
ఉదా : ఆర్థో నైట్రోఫినాల్, O- హైడ్రాక్సీ బెంజాల్డిహైడ్లు అణ్వంతర హైడ్రోజన్ బంధాన్ని ఏర్పరుస్తాయి.
ii) అంతరణుక హైడ్రోజన్ బంధం :
ఒక సమ్మేళనంలోని రెండు వేరు, వేరు అణువుల మధ్య గల హైడ్రోజన్ బంధాన్ని అంతరణుక హైడ్రోజన్ బంధం అంటారు.
ఉదా : H2O, HF, NH3 అణువులు అంతరణుక హైడ్రోజన్ బంధాన్ని ఏర్పరుస్తాయి.
ప్రశ్న 4.
సమన్వయ సంయోజనీయ బంధం ఏర్పడే విధానాన్ని ఉదాహరణలతో వివరించండి. [TS 17,19][AP 16]
జవాబు:
సమన్వయ సంయోజనీయ బంధం ఒక ప్రత్యేక రకమైన సంయోజనీయ బంధం. ఈరకం బంధాలలో, బంధ నిర్మాణంలో పరమాణువులు పంచుకున్న ఎలక్ట్రాన్ జంటలను ఒక పరమాణువు మాత్రమే ప్రధానం చేస్తుంది. ఎలక్ట్రాన్ జంటలను ప్రధానం చేసే పరమాణువును “దాత” అని,ఎటువంటి ఎలక్ట్రాన్లను ప్రధానం చేయకుండా కేవలము వాటిని పంచుకునే పరమాణువుని “గ్రహీత” అని అంటారు. దాత పరమాణువులో 1 (లేదా) 2 ఒంటరి జంట ఎలక్ట్రానులు, మరియు గ్రహీత పరమాణువు అష్టకము పొందడానికి రెండు ఎలక్ట్రాన్ల కొరత ఉంటుంది. సమన్వయ సంయోజనీయ బంధాన్ని బాణం గుర్తుతో (→)సూచిస్తారు. ఈ బాణం దాత నుండి గ్రహీత దిశగా వుంటుంది.
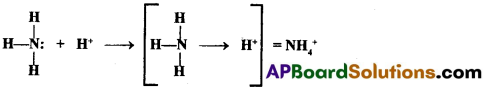
ఉదా : అమ్మోనియా అణువు ఏర్పడుట :
అమ్మోనియా అణువు H+ అయాన్తో కలిసి అమ్మోనియం అయానన్ను ఏర్పరుచును. NH3 అణువులో, మధ్యస్థ నైట్రోజన్ (N) పరమాణువు ఒక ఒంటరి జంట ఎలక్ట్రాన్ ను మరియు H+ అయాన్ ఖాళీ ఆర్బిటాలు కలిగి వుంటాయి. కావున NH3 లోని కేంద్రపరమాణువు N, ఒంటరి జంట ఎలక్ట్రాను, ఖాళీ ఆర్బిటాల్ గల H+ అయాను దానం చేస్తుంది. ఆవిధంగా అమ్మోనియాలోని N మరియు H+ అయాన్ల మధ్య సమన్వయ సంయోజనీయ బంధం ఏర్పడుతుంది.
సమన్వయ సంయోజనీయ బంధం యొక్క ధర్మాలు :
- సమన్వయ సంయోజనీయ ధర్మాలకు మరియు సంయోజనీయ సమ్మేళనాల ధర్మాలకు సారూప్యత వుంటుంది.
- ఇవి విద్యుద్వాహకాలు కావు. ఎందుకంటే ఇవి అయనీకరణం చెందవు.
- ఇవి అధృవ ద్రావణులైన బెంజీన్, CCl4 మొదలైన వాటిలో ఎక్కువగా కరుగుతాయి. నీరు లాంటి ధ్రువ ద్రావణులలో తక్కువగా కరుగుతాయి.
- వీటి ద్రవీభవన, బాష్పీ భవన స్థానాలు మరీ ఎక్కువగా లేదా మరీ తక్కువగా ఉండవు.
- వీటి సమ్మేళనాలు సాదృశ్యాన్ని ప్రదర్శిస్తాయి కారణం ఈ బంధం దృఢమైనది మరియు దిశాత్మకమైనది.
ప్రశ్న 5.
ద్విధ్రువ భ్రామకాన్ని నిర్వచించండి. దీని అనువర్తనాలేమిటి? [AP 17, 20]
జవాబు:
ద్విధ్రువ భ్రామకం :
ఒక ద్విపరమాణుక ధ్రువ అణువు ద్విధ్రువ భ్రామకం ఆ అణువులోని పరమాణువుల్లో ఒకదాని మీది విద్యుదావేశ పరిమాణం, ధన, ఋణ, విద్యుదావేశాల కేంద్రాల మధ్యదూరంల లబ్దంగా నిర్వచించవచ్చు. దీనిని µ తో సూచిస్తారు.
గణితాత్మకంగా µ = Q × r
ఇక్కడ µ = ద్విధ్రువ భ్రామకం; Q = ఆవేశం; r = ఆవేశాల మధ్య దూరం.
ద్విధ్రువ భ్రామకం విలువను డిబై (D) యూనిట్లలో లెక్కిస్తారు.
1 డిబై = 3.33564 × 10-30 కూలుంబ్. మీటర్
అనువర్తనాలు:
- ద్విధ్రువ భ్రామకం ద్వారా అణువుల ధ్రువ శీలతను తెలుసుకొనవచ్చు.
a. ధ్రువ అణువులకు ద్విధ్రువ భ్రామకం సున్నా కన్నా ఎక్కువ ఉండును.
b. అధ్రువ అణువులకు ద్విధ్రువ భ్రామకం విలువ సున్నాగా ఉండును. - దీని ద్వారా అణువుల ఆకృతిని ఊహించవచ్చు.
- దీని ద్వారా సంయోజనీయ బంధాల అయానిక శాత స్వభావాన్ని అంచనా వేయవచ్చు.

ప్రశ్న 6.
H2O అణువుకు ద్విధ్రువ భ్రామకం ఉన్నది కాని CO2 కు లేదు. ఎందువల్ల?
జవాబు:
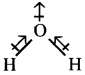
నీటి అణువు ద్విధ్రువ భ్రామకం: నీటి అణువు కోణీయ నిర్మాణం ఉంటుంది.
నీటి అణువు రెండు O-H బంధాల ఫలిత ద్విధ్రువభ్రామకం సున్నా కన్నా ఎక్కువగా ఉండును.
ఫలిత ద్విధ్రువ భ్రామకం > 0
CO2 అణువు ద్విధ్రువ భ్రామకం:
CO2 అణువు రేఖీయ నిర్మాణం కలిగి ఉండును. దీనిలో రెండుC = 0 బంధాల ఫలిత ద్విధ్రువ భ్రామకం సున్నాగా ఉండును. ఈ రెండు C = 0 బంధాలు, బంధ భ్రామకాలు పరిమాణంలో సమానంగాను, దిశలో వ్యతిరేకంగాను ఉండును.
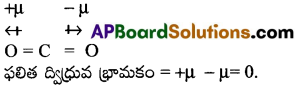
![]()
ప్రశ్న 7.
BF3, NF3 అణువుల్లో NF3 కి ద్విధ్రువ భ్రామకం ఉన్నది BF3 లేదు. ఎందువల్ల? [AP 17]
జవాబు:
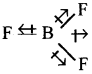
BF3 లో ద్విధ్రువ భ్రామకం విలువ సున్నా. BF3 లో బంధకోణం 120°.రెండు B-F బంధాల బంధ ద్విధ్రువాల సదిశ మొత్తం, మూడో B-F బంధం బంధ ద్విధ్రువానికి సమంగాను పూర్తి వ్యతిరేక దిశలోను ఉంటుంది. అందుకే మొత్తం అణువు ద్విధ్రువ భ్రామకం విలువ సున్నా. NF3 పరమాణువు పిరమిడాల్ ఆకృతిని కలిగి నైట్రోజన్ పై ఒక ఒంటరి ఎలక్ట్రాన్ జంటను కలిగి ఉన్నది. దీనిలో ఒంటరి జత ఎలక్ట్రాన్ ఆర్బిటాల్ ద్విధ్రువం, మూడు N-F బంధాల ద్విధ్రువాల ఫలిత ద్విధ్రువ భ్రామకానికి వ్యతిరేక
దిశలో ఉంటుంది.
ప్రశ్న 8.
NH3, NF3 రెండు అణువులు సూచ్యాకృతిలో ఉంటాయి. అయినా NH3 కి NF3. కంటే ద్విధ్రువ భ్రామకం ఎక్కువ ఎందువల్ల? [AP 16]
జవాబు:
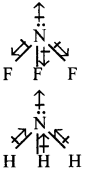
NH3 మరియు NF3 లలో నైట్రోజన్ పై ఒక ఒంటరి ఎలక్ట్రాన్ జంట కలిగి ఉండును.మరియు అవి పిరమిడాల్ ఆకృతిని కలిగి ఉన్నవి.
NH3 లో ఒంటరి జత ఎలక్ట్రాన్ల ఆర్బిటాల్ ద్విధ్రువం, మూడు N-H బంధాల ద్విధ్రువాల ఫలిత ద్విధ్రువ భ్రామకం ‘ఒకే దిశ’లో ఉండును.
NF3 లో ఒంటరి జత ఎలక్ట్రాన్ల ఆర్బిటాల్ ద్విధ్రువం, మూడు N-F బంధాల ద్విధ్రువాల ఫలిత ద్విధ్రువ భ్రామకం ‘వ్యతిరేక దిశ’లో ఉండును. కావున NF3 కన్నా NH3కు ద్విధ్రువ భ్రామకం ఎక్కువ.
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
అయానిక బంధం ఏర్పడటాన్ని సోదాహరణంగా వివరించండి. [TS 20]
జవాబు:
తక్కువ అయనీకరణ శక్తి ఉన్న ఒక పరమాణువు నుండి అధిక ఎలక్ట్రాన్ ఎఫినిటీ గల రెండవ పరమాణువుకు ఎలక్ట్రాన్ పంపిణీ జరిగినపుడు అయానిక బంధం ఏర్పడును. ఈ విధానంలో, ప్రతి పరమాణువు దాని సమీప జడవాయు విన్యాసం లేదా అష్టక విన్యాసాన్ని పొందుతుంది.
ఎలక్ట్రాన్లను వదులుకొన్న పరమాణువు కాటయాన్గాను మరియు ఎలక్ట్రానులను గ్రహించి పరమాణువు ఆనయాన్గాను మారును. “రెండు పరస్పర విరుద్ధ ఆవేశ అయాన్ల మధ్యగల బంధాన్నే అయానిక బంధము అంటారు”.
NaCl అయానిక బంధం ఏర్పడుట – వివరణ :
Na యొక్క ఎలక్ట్రాన్ విన్యాసం – 1s²2s²2p63s¹
Cl యొక్క ఎలక్ట్రాన్ విన్యాసం – 1s²2s²2p63s²3p5
సోడియం పరమాణువు ధన విద్యుదాత్మకత గల మూలకం మరియు దీనికి అయనీకరణశక్తి తక్కువ. అదే విధంగా క్లోరిన్ పరమాణువు ఋణ విద్యుదాత్మకత గల మూలకం. దీనికి ఎలక్ట్రాన్ ఎఫినిటీ ఎక్కువ. కావున Na ఒక ఎలక్ట్రాన్ను వదులుకుని క్లోరిన్ పరమాణువుకు బదిలీ చేస్తుంది. కావున Na పరమాణువు Na+ అయాన్ను, Cl పరమాణువు Cl– ను ఏర్పరుస్తుంది.
Na+ కాటయాన్ యొక్క ఎలక్ట్రాన్ విన్యాసం 1s²2s²2p6
Cl– అనయాన్ యొక్క ఎలక్ట్రాన్ విన్యాసం 1s²2s²2p63s²3p6
ఆ విధంగా, రెండు అయాన్లు అష్టక విన్యాసాన్ని పొందుతాయి. Na+ మరియు Cl– అయాన్లు బలమైన విద్యుదాకర్షణ బలాలతో బంధించబడి అయానిక బంధమును ఏర్పరుచును.
ప్రశ్న 2.
అయానిక సంయోగ పదార్థాలు ఏర్పడటానికి అనువైన పరిస్థితులు వివరించండి. [AP 18]
జవాబు:
అయానిక బంధం ఏర్పడుటకు అనుకూల పరిస్థితులు :
1. కాటయాన్ ఏర్పడటానికి అనువైన పరిస్థితులు :
అల్ప అయనీకరణ శక్తి :
అల్ప అయనీకరణ శక్తి వున్న పరమాణువులు ఎలక్ట్రాన్లను త్వరగా కోల్పోతుంది. కావున అవి సులభంగా కాటయానన్ను ఏర్పరుచును.
అధీక పరమాణు పరిమాణం :
పరమాణు పరిమాణం పెరిగిన కొద్ది, వేలన్సీ ఎలక్ట్రాన్లపై కేంద్రకం ఆకర్షణ తగ్గును. అందువల్ల చిన్న సైజు పరమాణువుల కంటే పెద్ద సైజు పరమాణువులు కాటయాన్ ను సాపేక్షంగా తేలికగా ఇస్తాయి.
కాటయాన్పై అల్ప ఆవేశం :
అయాన్పై ఆవేశం పెరిగిన కొద్దీ, కోల్పోవలసిన ఎలక్ట్రాన్లు ఎక్కువగును. కావున అల్ప ఆవేశం గల అయాన్లు, కాటయాన్లను త్వరగా ఏర్పరుస్తాయి.
2. ఆనయాన్ ఏర్పడటానికి అనువైన పరిస్థితులు :
అధిక ఎలక్ట్రాన్ ఎఫినిటీ మరియు అధిక ఋణ విద్యుదాత్మకత :
ఋణ విద్యుదాత్మకత, ఎలక్ట్రాన్ ఎఫినిటీ విలువలు పరమాణువు ఎలక్ట్రాన్లను గ్రహించే కొలమానాలు. అందుకని అధిక ఋణ విద్యుదాత్మకత, అధిక ఎలక్ట్రాన్ ఎఫినిటీ విలువలు కల పరమాణువులు ఆనయాన్లను త్వరగా ఏర్పరుస్తాయి.
అల్ప పరమాణు పరిమాణం :
చిన్న పరమాణువులు అవి గ్రహించిన ఎలక్ట్రాన్లను బలంగా పట్టుకుని వుంచుతాయి. కాబట్టి అవి ఆనయాన్లను తేలికగా ఏర్పరుచును.
అయాన్ పై తక్కువ ఆవేశం :
అయాన్పై ఋణావేశం పెరిగిన కొద్ది ఆనయాన్ స్థిరత్వం తగ్గుతుంది. కాబట్టి తక్కువ ఋణావేశం వున్న అయాన్లు ఆనయాన్లను త్వరగా ఏర్పరుస్తాయి.
![]()
ప్రశ్న 3.
క్రింది వాటిని వివరించండి. a) బంధకోణం b) బంధ ఎంథాల్పీ c) బంధ దైర్ఘ్యం d) బంధ క్రమం.
జవాబు:
(a) బంధకోణం:
బంధకత ఆర్బిటాళ్ళ మధ్య గల సరాసరి కోణాన్ని బంధకోణం అంటారు. దీన్ని డిగ్రీలలో కొలుస్తారు.
ఉదా: నీటి అణువులో H-O-H బంధ కోణం 104.5°
బంధకోణం ఆధారంగా అణువుల ఆకృతి మరియు కేంద్రక పరమాణువు చుట్టూ గల ఆర్బిటాళ్ళ అమరికను తెలుసుకోవచ్చు.
(b) బంధ ఎంథాల్పీ:
వాయుస్థితిలో ఉన్న అణువులో గల రెండు పరమాణువుల మధ్య గల బంధాన్ని విఘటనం చెందించుటకు అవసరమగు శక్తిని బంధ ఎంథాల్పీ అంటారు. దీనిని kJ/Mol. లలో కొలుస్తారు.
ఉదా: హైడ్రోజన్ అణువులో H-H బంధ ఎంథాల్పీ 435.8 kJ / Mol
బంధ ఎంథాల్పీ పెరిగినకొలది బంధ ధృడత్వం పెరుగును.
(c) బంధ దైర్ఘ్యం:
అణువులో బంధాలు ఏర్పరచుకొన్న రెండు పరమాణువుల కేంద్రకాల మధ్య సమతాస్థితి దూరాన్ని బంధ దైర్ఘ్యం అంటారు. దీనిని ఆంగ్ం(Å) యూనిట్లో కొలుస్తారు. ‘S’ స్వభావం పెరిగే కొలది బంధ ధైర్ఘ్యం తగ్గును.
C(sp³) – H బంధ దైర్ఘ్యం 1.093Å
C(sp²) – H బంధ దైర్ఘ్యం 1.087Å
బంధ దైర్ఘ్యం పెరిగే కొలది బంధ ఎంథాల్పీ పెరుగును.
(d) బంధ క్రమం: అణువులో గల రెండు పరమాణువుల మధ్య ఉన్న బంధాల సంఖ్యను బంధ క్రమం అంటారు.
ఉదా: H2 లో బంధ క్రమం 1
O2 లో బంధ క్రమం 2
బంధ క్రమం పెరిగిన కొలది బంధ దైర్ఘ్యం తగ్గును.
ప్రశ్న 4.
వేలన్స్ కర్పర ఎలక్ట్రాన్ జంటల వికర్షణ సిద్ధాంతం వివరించండి. దీని అనువర్తనాలు ఏమిటి?
జవాబు:
VSEPR అనగా Valence Shell Electron Pair Repulsion, వేలన్సీ స్థాయి ఎలక్ట్రాన్ జంట వికర్షణ సిద్ధాంతం. కొన్ని అణువులలోని బంధకోణాలలో విచలనాలను గురించి వివరించడానికి ఈ సిద్ధాంతము ప్రతిపాదించబడినది.
VSEPR సిద్ధాంతంలోని ప్రతిపాదనలు :
1. కేంద్రక పరమాణువు యొక్క వేలన్సీ స్థాయిలోవున్న ఎలక్ట్రాన్ జంటల మధ్య వికర్షణలే అణువు ఆకృతిని నిర్ధారిస్తాయి.
2. బంధ జంటల కంటే, ఒంటరి ఎలక్ట్రాన్ జంటలే మధ్యస్థ పరమాణువు చుట్టూ ఎక్కువ ప్రదేశాన్ని ఆక్రమించుకుంటాయి. ఒంటరి జంట ఎలక్ట్రాన్లు ఒక్క కేంద్రకంతోనే ఆకర్షించబడుతుంటాయి. కాని బంధ జంట ఎలక్ట్రాన్లు, రెండు కేంద్రకాలతో ఆకర్షించబడును. కావున ఒంటరి జంట ఎలక్ట్రాన్ల మధ్య వికర్ణణలు బంధ జంట ఎలక్ట్రాన్లు వికర్షణల కంటే ఎక్కువగా వుంటాయి.
3. కేంద్రక పరమాణువులో కేవలము బంధ జంటలు మాత్రమే ఉంటే, అణువు ఆకృతి మరియు బంధకోణాలు ఊహించిన విధంగానే ఉండును.
4. కేంద్రక పరమాణువు బంధ జంటలతో పాటు ఒంటరి జంటలను కూడా కలిగివుంటే, అణు ఆకృతి ఊహించిన దాని నుండి విచలనం చెందును. ఇది ఎలక్ట్రాన్ జంటల మధ్య వికర్షణల వల్ల జరుగుతుంది.
వివిధ రకాల ఎలక్ట్రాన్ జంటల మధ్య వికర్షణ బలాల క్రమం:
(ఒంటరి జంట – ఒంటరి జంట) > (ఒంటరి జంట – బంధ జంట) > (బంధ జంట – బంధ జంట)
5. వివిధ బంధాల మధ్య వికర్షణల క్రమం : త్రికబంధం > ద్విబంధం > ఏకబంధం
ఉదా: 1. BeCl2 లో రెండు Be-Cl బంధాలుంటాయి. రెండు బంధ జంటలు వ్యతిరేక దిశలలో వుంటాయి. రెండు బంధ జంటల మధ్య గల వికర్షణ బలాన్ని నిర్లక్ష్యం చేయవచ్చు. కావున బంధకోణం 180° గా ఉంటుంది.
2. H2O అణువులో ౦ రెండు ఒంటరి జంటలను కలిగి వుంటుంది. ఇక్కడ ఊహించిన బంధ కోణం 109°28¹. కాని (ఒంటరి జంట ఒంటరి జంట) మరియు (ఒంటరి జంట-బంధ జంట) ఎలక్ట్రాన్ల వికర్షణల వల్ల బంధకోణం 104°30¹కు తగ్గుతుంది.
3. CH4 అణువుల్లో, నాలుగు ఎలక్ట్రాన్ జంటలు కూడా బంధ జంటలే. అందుకని అణువుకు టెట్రాహెడ్రల్ నిర్మాణం వుంటుంది. దీనిలో బంధకోణం 109°28¹.
ప్రశ్న 5.
బంధ దిగ్విన్యాసాన్ని, అణు జ్యామితులను పౌలింగ్ -స్లేటర్ వేలన్సీ బంధ సిద్ధాంతం ఎలా వివరిస్తుంది?
జవాబు:
వేలన్సీ బంధ సిద్ధాంతం(VBT):
ఈ సిద్ధాంతం సంయోజనీయ అణువుల ఆకృతులను, బంధ దిగ్విన్యాసాన్ని గురించి వివరించును.
VBT లోని ముఖ్య ప్రతిపాదనలు :
1. సగం నిండిన ఒక పరమాణువు యొక్క ఒక ఆర్బిటాల్, సగం నిండిన మరియొక పరమాణువు యొక్క ఆర్బిటాల్తో అతిపాతం చెందినపుడు సంయోజనీయ బంధం ఏర్పడును.
2. అతిపాతం చెందే ఆర్బిటాల్లో వ్యతిరేక స్పిన్ గల బంధ ఎలక్ట్రాన్ జంటలు ఉండాలి.
3. బంధిత ఎలక్ట్రాన్ తప్ప మిగిలిన ఎలక్ట్రాన్లు తమ ఉనికిని పోగొట్టుకోవు. బంధంలో లేని ఎలక్ట్రాన్లను ఒంటరి జత ఎలక్ట్రాన్ లు లేదా అపబంధిత ఎలక్ట్రాన్లు అంటారు.
4. ఆర్బిటాల్ల అతిపాతం తీవ్రత ఎక్కువ అయినకొద్ది బంధ బలం పెరుగుతుంది.
5. ఎక్కువగా అతిపాతం చెందేవైపు సంయోజనీయ బంధం దిశ ఉంటుంది. S ఆర్బిటాల్ తప్ప మిగిలినవన్ని దిశాత్మకమైనవి. కావున వాటి అతిపాతం వల్ల ఏర్పడే బంధాలు కూడా దిశాత్మకమగును.
6. రెండు సంయోగం చెందే పరమాణువుల పరమాణు ఆర్బిటాల్లు అతిపాతం చెందటం వల్ల అంతర కేంద్రక అక్షంపై ఎలక్ట్రాన్ సాంద్రత పెరుగుతుంది. ఈ లక్షణమే అణువు యొక్క ఆకృతిని నిర్ణయిస్తుంది.
7. ఆర్బిటాల్ అక్షియ అతిపాతం వల్ల ఏర్పడే సంయోజనీయ బంధాన్నే σ–బంధము అంటారు.
8. ఆర్బిటాల్ల పార్శ్వ అతిపాతం వల్ల ఏర్పడే సంయోజనీయ బంధాన్నే π–బంధము అంటారు.
9. σ–బంధము ఎల్లపుడు π–బంధము కన్నా బలమైనది.
కారణం:
σ–బంధము అనేది అంతర కేంద్రక అక్షంపై ఆర్బిటాల్ల అంత్య అతిపాతం వల్ల ఏర్పడుతుంది. కావున బంధంలోని ఎలక్ట్రాన్ల జంట కేంద్రకాల మధ్య ఉంటుంది. కాని π– బంధం అనేది పార్శ్వ అతిపాతం వలన ఏర్పడును. ఇక్కడ బంధపు ఎలక్ట్రాన్ మేఘాలు అంతర కేంద్రక అక్షానికి కింద, పైన రెండు వైపులా అమరి వుంటాయి. అందుచేత σ–బంధము ఎల్లప్పుడూ π–బంధము కన్నా బలమైనది.
10. ముందుగా ఒక σ–బంధము ఏర్పడిన తరువాత మాత్రమే π–బంధము ఏర్పడటానికి అవకాశముంటుంది.
11. ద్విబంధ నిర్మాణంలో, ఒక σ–బంధము మరియు ఒక π–బంధము వుంటుంది.
12. త్రిబంధ నిర్మాణంలో, ఒక σ–బంధము, రెండు π–బంధాలు వుంటాయి.
ఉదాహరణలు :
1. H2 అణువు ఏర్పడుట :
ప్రతి హైడ్రోజన్ పరమాణువు 1s ఆర్బిటాల్లో ఒక ఎలక్ట్రాన్ వుంటుంది. రెండు హైడ్రోజన్ పరమాణువులోని 1s ఆర్బిటాళ్ళు అంత్య అతిపాతం జరిపి σ బంధాన్ని ఏర్పరుస్తాయి.

2. F2 అణువు ఏర్పడుట:
ఫ్లోరిన్ అణువులో అసంపూర్తిగా నిండిన 2pz ఆర్బిటాల్ వుంటుంది. రెండు ఫ్లోరిన్ పరమాణువులలో 2pz ఆర్బిటాళ్ళు అంత్య అతిపాతం జరిపి σ-బంధాన్ని ఏర్పరుస్తాయి.
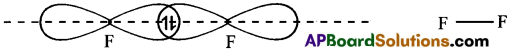
3. O2 అణువు ఏర్పడుట : ఆక్సిజన్ యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p²x 2p¹y 2p¹z
ఆక్సిజన్లో అసంపూర్తిగా నిండిన రెండు p-ఆర్బిటాళ్ళు వుంటాయి. ఒక ఆక్సిజన్ పరమాణువులోని 2py ఆర్బిటాల్, వేరొక ఆక్సిజన్ పరమాణువులోని 2py ఆర్బిటాల్తో అక్షీయ అతిపాతం జరిపి ఒక σ–బంధాన్ని ఏర్పరుస్తాయి. అదేవిధంగా రెండు ఆక్సిజన్ పరమాణువులోని 2pz ఆర్బిటాల్తో పార్శ్వ అతిపాతం చెంది ఒక π–బంధాన్ని ఏర్పరుస్తుంది. కావున ఒక బలమైన σ బంధము మరియు బలహీనమైన π- బంధము తో ద్విబంధము ఏర్పడును.
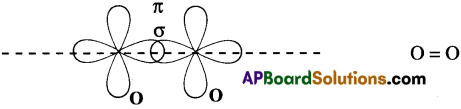
![]()
ప్రశ్న 6.
సంకరీకరణం అంటే ఏమిటి? S, P ఆర్బిటాళ్ళతో జరిగే విభిన్న రకాల సంకరకరణాల్ని వివరించండి. [TS 16,17,22]
జవాబు:
సంకరీకరణం :
ఒక పరమాణువులోని ఇంచుమించు సమశక్తిగల ఆర్బిటాల్లు ఒకదానితో ఒకటి సంకలనం చెంది సమాన సంఖ్యలో సమరూప ఆర్బిటాల్లు పునర్ పంపిణీ కావడాన్ని సంకరీకరణం అంటారు.
S మరియు P ఆర్బిటాల్లతో 3 రకాల సంకరీకరణాలు ఏర్పడును. అవి sp, sp², sp³ సంకరీకరణాలు.
1. sp సంకరీకరణం :
పరమాణువులోని బాహ్య కర్పరంలో ఒక S-ఆర్బిటాల్ మరియు ఒక P-ఆర్బిటాల్ సంకలనం చెంది రెండు సమరూప SP ఆర్బిటాళ్ళు ఏర్పడుటను SP సంకరీకరణం అంటారు. దీనిలో బంధకోణం 180° మరియు ఆకృతి రేఖీయం
ఉదా : BeCl2, CO2, C2H2.
BeCl2 ఏర్పడుట :
- BeCl2 అణువులో, కేంద్రక బెరీలియం పరమాణువు, దాని ఉద్రిక్త స్థితిలో సంకరీకరణంలో పాల్గోంటుంది.
- భూస్థితిలో Be(4) యొక్క ఎలక్ట్రాన్ విన్యాసం 1s²2s².
- ఉద్రిక్త స్థితిలో బెరీలియం యొక్క ఎలక్ట్రాన్ విన్యాసం 1s²2s¹ 2p¹x 2p0y 2p0z.
- ఉద్రిక్త స్థితిలో, కేంద్రక Be పరమాణువు sp సంకరీకరణంలో పాల్గొని రెండు sp సంకర ఆర్బిటాళ్ళను ఏర్పరుస్తాయి.
- బేరిలియం యొక్క రెండు sp ఆర్బిటాళ్ళు, రెండు క్లోరిన్ పరమాణువులోని P – ఆర్బిటాళ్ళతో అతిపాతం చెంది రెండు సిగ్మా బంధాలను ఏర్పరచును.
- దీనిలో బంధకోణం 180° మరియు BeCl2 అణువు ఆకృతి రేఖీయం
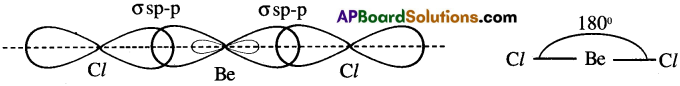
2. sp² సంకరీకరణం :
పరమాణువులోని బాహ్య కర్పరంలో ఒక s-ఆర్బిటాల్ మరియు రెండు p-ఆర్బిటాల్లు ఒకదానితో ఒకటి అతిపాతం చెంది మూడు సర్వసమాన sp² సంకర ఆర్బిటాళ్ళు ఏర్పడుటను sp² సంకరీకరణం అంటారు. దీనిలో బంధకోణం 120° మరియు ఆకృతి సమతల త్రిభుజం
Ex : BCl3, BF3, C2H4.
BCl3 అణువు ఏర్పడుట :
- BCl3లో కేంద్రక బోరాన్ (B) పరమాణువు, దాని ఉద్రిక్త స్థితిలో సంకరీకరణంలో పాల్గొంటుంది.
- భూస్థితిలో బోరాన్(B) యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s²2p¹
- ఉద్రిక్త స్థితిలో B యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s¹ 2p¹x 2p¹y 2p0z.
- ఉద్రిక్త స్థితిలో,కేంద్రక బోరాన్ పరమాణువు sp² సంకరీకరణంలో పాల్గొని మూడు sp² సంకర ఆర్బిటాళ్ళను ఏర్పరచును.
- బోరాన్ పరమాణువులోని మూడు sp² ఆర్బిటాళ్ళు, Cl పరమాణువులోని సగం నిండిన pz ఆర్బిటాళ్ళతో అక్షీయ అతిపాతం చెంది మూడు σ బంధాలను ఏర్పరచును.
- బంధకోణం 120° మరియు అణువు యొక్క ఆకృతి సమతల త్రిభుజం

3. sp³ సంకరీకరణం :
పరమాణువు బాహ్యశక్తి స్థాయిలో ఒక s- ఆర్బిటాల్ మరియు మూడు p-ఆర్బిటాల్లు ఒక దానికొకటి అతిపాతం చెంది నాలుగు సర్వసమాన sp³ సంకర ఆర్బిటాళ్ళు ఏర్పడుటను sp³ సంకరీకరణం అంటారు. దీనిలో బంధకోణం 109°28¹ మరియు ఆకృతి చతుర్ముఖీయం. Ex : CH4, H2O. [AP 18]
CH4 అణువు ఏర్పడుట :
- CH4లో కేంద్రక కార్బన్ పరమాణువు ఉద్రిక్త స్థితిలో సంకరీకరణం లో పాల్గొంటుంది.
- భూస్థితిలో C(6) యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p²
- ఉద్రిక్త స్థితిలో C యొక్క ఎలక్ట్రాన్ విన్యాసం 1s² 2s¹ 2p¹x 2p¹y 2p¹z.
- ఉద్రిక్త స్థితిలో, మధ్యస్థ కార్బన్ పరమాణువు sp³ సంకరీకరణం చెంది నాలుగు sp³ సంకర ఆర్బిటాళ్ళను ఏర్పరుస్తాయి.
- కార్బన్ పరమాణువులోని నాలుగు sp³ ఆర్బిటాళ్ళు, నాలుగు హైడ్రోజన్ పరమాణువులలోని సగం నిండిన s-ఆర్బిటాల్తో అతిపాతం జరిపి నాలుగు σ బంధాలను ఏర్పరుస్తాయి.
- CH4 అణువు యొక్క ఆకృతి టెట్రాహెడ్రల్ మరియు బంధకోణం 109°28¹

ప్రశ్న 7.
(a) N2 (b) O2. అణువులకు అణు ఆర్బిటాల్ శక్తి పటాలు రాయండి. ఈ రెండు అణువుల అయస్కాంత లక్షణాలేమిటి? వాటి బంధక్రమాలు గణించండి. [IPE ’14][TS 19]
జవాబు:
N2 అణువు MOED:
N(7) యొక్క ఎలక్ట్రాన్ విన్యాసం = 1s² 2s² 2P¹x 2P¹y 2P¹z
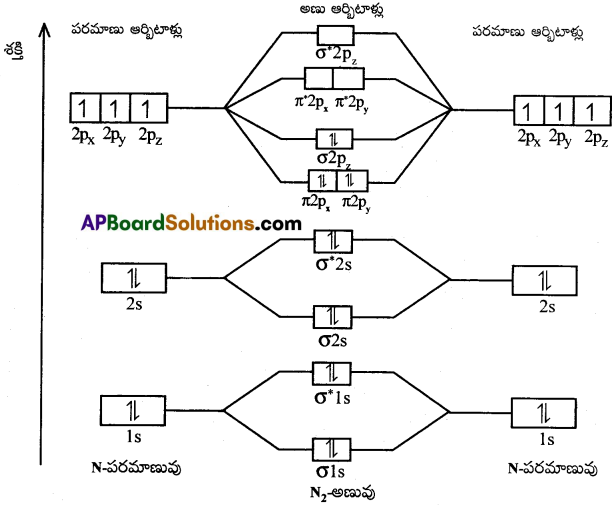
N2 అణువు యొక్క ఎలక్ట్రాన్ విన్యాసము:
(σ1s²)(σ*1s²)(σ2s²)(σ*2s²)(π2р²x = π2р²y)(σ2p²z)
ఇచ్చట బంధ ఎలక్ట్రాన్ల సంఖ్య (Nb) = 10
బంధంలో లేని ఎలక్ట్రాన్ల సంఖ్య (Na) = 4

N2 అణువులో ఒంటరి ఎలక్ట్రాన్లు లేవు. కావున ఇది డయా అయస్కాంత ధర్మాన్ని ప్రదర్శిస్తుంది.
O2 యొక్క MOED :
O (8) యొక్క ఎలక్ట్రాన్ విన్యాసము = 1s² 2s² 2p²x 2p¹y 2p¹z
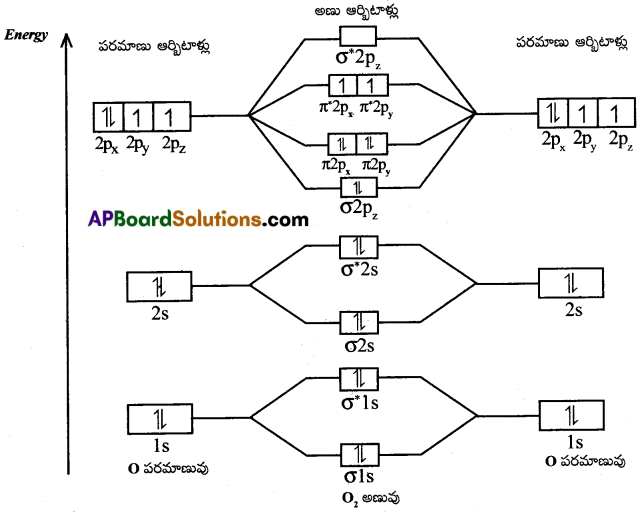
O2 అణువు యొక్క ఎలక్ట్రాన్ విన్యాసము:
σ(1s²)σ*(1s²)σ(2s²)σ* (2s²)σ(2p²z)(π2p²x = π2р²y)(π*2р¹x = π*2p¹y
ఇచ్చట బంధ ఎలక్ట్రాన్ల సంఖ్య (Nb) = 10
బంధంలో లేని ఎలక్ట్రాన్ల సంఖ్య (Na) = 6

O2, అణువులో ఒంటరి ఎలక్ట్రాన్లు కలవు. అందువల్ల అది పారా అయస్కాంత ధర్మాన్ని ప్రదర్శిస్తుంది.
Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
ఫాజాన్స్ నియమాలు రాసి, సరియైన ఉదాహరణలు ఇవ్వండి.? [AP 15,16,19,22]
జవాబు:
ఫాజాన్ నియమాలను రెండు పరమాణువుల మధ్య ఏర్పడే బంధ స్వభావాలను ఊహించడానికి ఉపయోగిస్తారు.
- కాటయాన్ పరిమాణం పెరిగే కొద్దీ బంధం యొక్క అయానిక స్వభావం పెరుగుతుంది.
ఉదా : క్షారలోహ అయాన్లలో అయానిక బంధ స్వభావం ఈ క్రమంలో వుంటుంది : Li+ < Na+ < K+ < Rb+ - ఆనయాన్ పరిమాణం తగ్గే కొద్దీ అయానిక స్వభావం పెరుగుతుంది.
- కాటయాన్ లేదా ఆనయాన్ లేదా రెండింటికి తక్కువ ఆవేశాలుంటే అవి అయానిక బంధ నిర్మాణానికి అనుకూలంగా వుంటాయి.
- జడవాయు విన్యాసం గల కాటయాన్లు అయానిక సమ్మేళనాలను, మిధ్యాజడవాయు విన్యాసం గల కాటయాన్లు సంయోజనీయ బంధ నిర్మాణానికి అనుకూలంగా వుంటాయి.
![]()
ప్రశ్న 2.
బంధ క్రమం అంటే ఏమిటి? కింది అణువుల్లో బంధ క్రమమెంత? [AP 19][[IPE ’14][TS 15]
a) N2 b) O2 c) O+2 d) O–2
జవాబు:
బంధ క్రమం:
అణువులో గల రెండు పరమాణువుల మధ్య ఉన్న బంధాల సంఖ్యను బంధ క్రమం అంటారు.
బంధ క్రమం (B.O) = \(\frac{1}{2}\) (Nb – Na)
Nb = బంధక ఆర్బిటాళ్లలో ఎలక్ట్రాన్ల సంఖ్య.
Na = అపబంధక ఆర్బిటాళ్లలో ఎలక్ట్రాన్ల సంఖ్య.
a) N2 అణువులో అణు ఆర్బిటాల్ ఎలక్ట్రాన్ విన్యాసం.

ప్రశ్న 3.
NH3 అణువులో నైట్రోజన్ పరమాణువు sp³, సంకరీకరణ స్థితిలో ఉన్నా బంధకోణం 109°28¹ కాకుండా వేరేగా ఉంది.వివరించండి. [May’09]
జవాబు:
i) VSEPR సిద్ధాంతం ఆధారంగా అమ్మోనియా (NH3) అణువు ఆకృతి :
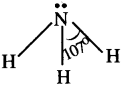
NH3 అణువులో, కేంద్రక నైట్రోజన్ పరమాణువు యొక్క వేలన్సీ కక్ష్యలో నాలుగు ఎలక్ట్రాన్ జంటలు వుంటాయి. NH3 అణువు ఆకృతి టెట్రాహెడ్రల్ మరియు H-N-H బంధకోణం 109°28¹ గా వుండాలి. నాలుగు ఎలక్ట్రాన్ జంటలలో, మూడు బంధ జంటలు మరియు ఒక ఒంటరి జంట ఎలక్ట్రానులు వుంటాయి. VSEPR సిద్ధాంతం ప్రకారం, ఒంటరి జంట మరియు బంధ జంట ఎలక్ట్రాన్ల మధ్య వికర్షణ బలాలు అధికంగా వుంటాయి. కావున బంధ కోణం 107°కు తగ్గుతుంది. అందువలన NH3 అణువు ఆకృతి పిరమిడల్ (సూచ్ఛాకృతి) గా మారును.
ii) VSEPR సిద్ధాంతం ఆధారంగా H2O అణువు ఆకృతి :
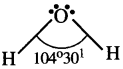
H2O అణువులో, కేంద్రక ఆక్సిజన్ (O) పరమాణువు యొక్క వేలన్సీ కక్ష్యలో నాలుగు ఎలక్ట్రాన్ జంటలు వుంటాయి. కావున H2O అణువు ఆకృతి టెట్రాహెడ్రల్ మరియు H-O- H ల మధ్య బంధకోణం 109°28¹ గా వుండాలి. నాలుగు ఎలక్ట్రాన్ జంటలలో, రెండు బంధ జంటలు మరియు రెండు ఒంటరి ఎలక్ట్రాన్ జంటలు వుంటాయి. VSEPR సిద్ధాంతం ప్రకారం బంధ జంట బంధ జంట మధ్య వికర్షణ కన్నా ఒంటరి జంట-ఒంటరి జంట మధ్య వికర్షణ ఎక్కువ. కావున బంధకోణం 104°30¹ కు తగ్గుతుంది. అందువలన H2O అణువు ఆకృతి V కోణీయంగా మారును..
ప్రశ్న 4.
PCl5 అణువు ఏర్పడటంలో P సంకరీకరణం వివరించండి. [AP 17,18,20,22] [TS 15,16,18,20]
జవాబు:
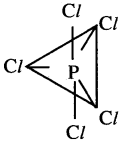
PCl5 అణువు యొక్క నిర్మాణం:
ఫాస్పరస్ P ఉద్రిక్త స్థితిలో, ఒక S-ఆర్బిటాల్, మూడు P-ఆర్బిటాళ్ళు మరియు ఒక d-ఆర్బిటాల్ కలిసి అయిదు sp³d సంకర ఆర్బిటాళ్ళను ఏర్పరుస్తాయి. ఈ సంకర ఆర్బిటాళ్ళు ట్రైగోనల్ బై పిరమిడల్ యొక్క అయిదు మూలలలో అమరి వుంటాయి. ఈ ఆర్బిటాళ్ళ బంధకోణాలు 120°, 90°. బంధంలో పాల్గొనని ఎలక్ట్రానులను కలిగిఉన్న, P యొక్క అయిదు sp³ d సంకర ఆర్బిటాళ్ళు, Cl పరమాణువులోని 3pz ఆర్బిటాళ్ళతో అక్షీయ అతిపాతం చెంది అయిదు బలమైన sp³ d-p సిగ్మా బంధాలను ఏర్పరుస్తాయి. PCl5 అణువు ఆకృతి ట్రైగోనల్ బై పిరమిడల్ మరియు Cl-P-Cl బంధకోణాలు 120°, 90°.
![]()
ప్రశ్న 5.
SF6 ఏర్పడటంలో సంకరీకరణం వివరించండి. [AP 19][IPE ‘10,14][TS 17,19]
జవాబు:
ఏదైనా పరమాణువు యొక్క బాహ్య కక్ష్యలోని ఒక S-ఆర్బిటాల్, మూడు p-ఆర్బిటాల్లు మరియు రెండు d- ఆర్బిటాల్లు ఒకదానికొకటి సంకలనం చెంది ఆరు సర్వసమాన సంక sp³d² ఆర్బిటాళ్లను ఏర్పరచుటను sp³d² సంకరీకరణం అంటారు.
SF6 అణువు ఏర్పడుట:
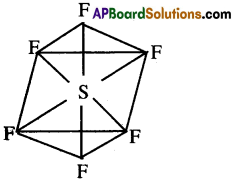
సల్ఫర్ S ఉద్రిక్త స్థితిలో, ఒక s-ఆర్బిటాల్, మూడు p-ఆర్బిటాల్లు మరియు రెండు d-ఆర్బిటాల్లు కలిసి ఆరు sp³d² సంకర ఆర్బిటాళ్ళను ఏర్పరుస్తాయి. ఈ సంకర ఆర్బిటాళ్ళు ఆక్టాహెడ్రన్ ఆకృతియొక్క 6 మూలలలో అమరి వుంటాయి. బంధకోణం 90°. బంధంలో పాల్గొనని ఎలక్ట్రానులను కలిగిఉన్న, S యొక్క ఆరు sp³d ఆర్బిటాళ్ళు F లోని P- ఆర్బిటాళ్ళతో అక్షీయ అతిపాతం చెంది ఆరు sp³d²-p సిగ్మా బంధాలను ఏర్పరుస్తాయి. SF6 అణువు యొక్క ఆకృతి ఆక్టాహెడ్రల్ మరియు F-S-F బంధకోణం 90°.