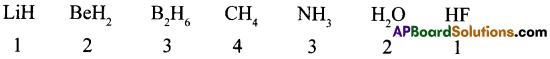Students get through AP Inter 1st Year Chemistry Important Questions 2nd Lesson మూలకాల వర్గీకరణ – ఆవర్తన ధర్మాలు which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 2nd Lesson మూలకాల వర్గీకరణ – ఆవర్తన ధర్మాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
మెండలీవ్ ఆవర్తన నియమ పద్ధతికి, ఆధునిక ఆవర్తన నియమ పద్ధతికి గల తేడా ఏమిటి?
జవాబు:
మెండలీవ్ ప్రకారం మూలకాల భౌతిక రసాయన ధర్మాలు పరమాణు భారాలకు ఆవర్తన ప్రమేయాలు.
నూతన ఆవర్తన నియమం ప్రకారం మూలకాల భౌతిక రసాయన ధర్మాలు పరమాణు సంఖ్యలకు ఆవర్తన ప్రమేయాలు.
ప్రశ్న 2.
ఆవర్తన పట్టికలో మూడో పీరియడ్, పదిహేడో గ్రూప్ లో ఉన్న మూలకం పరమాణు సంఖ్యను తెలపండి.
జవాబు:
3వ పీరియడ్ మరియు 17వ గ్రూపులో ఉండు మూలకం క్లోరిన్ ‘Cl’.(Z = 17)
ప్రశ్న 3.
ప్రాతినిధ్య మూలకాలంటే ఏమిటి? వాటి వేలన్సీ కక్ష్య విన్యాసాన్ని తెలపండి.
జవాబు:
పరివర్తన మూలకాలు మరియు ‘0’ గ్రూపు మూలకాలు కాకుండా మిగిలిన మూలకాలను ‘ప్రాతినిధ్యమూలకాలు’ అంటారు.వీటి వేలన్సీ కక్ష్యలు ఎలక్ట్రాన్లతో అసంపూర్ణంగా నిండి ఉంటాయి. సాధారణ వేలన్సీ కక్ష్య ఎలక్ట్రాన్ విన్యాసం: ns1 to 2 np0 to 5.
ప్రశ్న 4.
‘X’ అనే మూలకం పరమాణు సంఖ్య 34. ఆవర్తన పట్టికలో దాని స్థానాన్ని తెలపండి.
జవాబు:
వేలన్సీ స్థాయి ఎలక్ట్రాన్ విన్యాసము, 34X is [Ar] 3d10104s²4p4.
ఈ మూలకం(X) నాల్గవ పీరియడ్కు మరియు VIA గ్రూపుకు చెంది ఉంటుంది. (p- బ్లాక్ మూలకము)
ప్రశ్న 5.
పరివర్తన మూలకాల అభిలాక్షణిక ధర్మాలకు కారణమయ్యే అంశాలు ఏవి?
జవాబు:
చిన్న పరమాణు పరిమాణం, అధిక కేంద్రక ఆవేశం, d-ఆర్బిటాల్ లో ఒంటరి ఎలక్ట్రాన్లు ఉండటం మొ॥ పరివర్తన మూలకాల విలక్షణ ధర్మాలకు కారణమైన అంశాలు.
![]()
ప్రశ్న 6.
d- బ్లాక్, f- బ్లాక్ మూలకాల బాహ్య కక్ష్యల ఎలక్ట్రాన్ విన్యాసాన్ని ఇవ్వండి.
జవాబు:
d-బ్లాక్ మూలకాల బాహ్య కక్ష్య విన్యాసం (n-1) d1-10 ns1-2.
f-బ్లాక్ మూలకాల బాహ్య కక్ష్య విన్యాసం (n-2)f1-14 (n-1)d0-1ns²
ప్రశ్న 7.
మెండలీవ్ ఆవర్తన పట్టికలోని అసంగత మూలకాల జంటలు ఏవి?
జవాబు:
అసంగత జంటలు:
ఆధునిక మెండలీవ్ ఆవర్తన పట్టికలో నాలుగు జతల మూలకాల్లో పరమాణు భారాల వరసలు అపక్రమంలో ఉన్నాయి.
ఉదా: 1. Te (127.6); I (126.9)
2. Co (58.93) ; Ni (58.69).
ప్రశ్న 8.
N-3, O-2, F–, Na+, Mg+2, Al+3. లను పరిశీలించండి.
(a) వీటిలో గల సారూప్యత ఏమిటి ? (b) వీటిని అయానిక వ్యాసార్థ పెరుగుదల క్రమంలో అమర్చండి.
జవాబు:
ఇవ్వబడిన అయాన్లు N-3, O-2, F–, Na+, Mg+2 మరియు Al+3.
(a) అన్ని అయాన్లు ఒకే ఎలక్ట్రాన్ల సంఖ్య కలిగి ఉన్నవి. కావున వీటిని సమ ఎలక్ట్రాన్ జాతులు అంటారు.
(b) అయానిక వ్యాసార్థ పెరుగుదల Al+3 < Mg+2 < Na+ < F– < O+2 < N-3
వివరణ:
సమ ఎలక్ట్రాన్ జాతులలో కేంద్రక ఆవేశం పెరిగేకొలది అయానిక వ్యాసార్థం తగ్గును.
ప్రశ్న 9.
‘O’ అయొనైజేషన్ ఎంథాల్పీ ‘N’ కంటే తక్కువ. విశదీకరించండి.
జవాబు:
N యొక్క ఎలక్ట్రాన్ విన్యాసం [He] 2s²2p³. O యొక్క ఎలక్ట్రాన్ విన్యాసం [He] 2s² 2p4
వివరణ:
N లో సగం నిండిన ఎలక్ట్రాన్ విన్యాసం వల్ల దానికి స్థిరత్వం ఎక్కువ. సాపేక్షంగా ఆక్సిజన్కు నైట్రోజన్తో పోలిస్తే తక్కువ స్థిరత్వం గల ఎలక్ట్రాన్ విన్యాసం ఉంది. అందువల్ల ఆక్సిజన్ యొక్క అయొనైజేషన్ ఎంథాల్పీ నైట్రోజన్ కన్నా తక్కువ.
ప్రశ్న 10.
లోహాలకు, అలోహాలకు ఉన్న ముఖ్యమైన తేడాలు ఏవి?
జవాబు:
| లోహాలు | అలోహాలు |
| 1. ఇవి సాధారణంగా ఘనరూపంలో ఉంటాయి. (Hg తప్ప). | 1. ఇవి ఘన (లేదా) ద్రవ (లేదా) వాయు రూపంలో, ఉంటాయి. |
| 2. అధిక ద్రవీభవన మరియు బాష్పీభవన కలిగి ఉంటాయి. | 2. తక్కువ ద్రవీభవన మరియు బాష్పీభవన స్థానాలు కలిగి ఉంటాయి. |
| 3. మంచి ఉష్ణ మరియు విద్యుద్వాహకాలు | 3. ఇవి మంచి ఉష్ణ మరియు విద్యుద్వాహకాలు కాదు. |
![]()
ప్రశ్న 11.
s, p, d, f-బ్లాక్ మూలకాల బాహ్య ఎలక్ట్రాన్ విన్యాసాన్ని ఇవ్వండి.
జవాబు:
| బ్లాక్ | బాహ్య ఎలక్ట్రాన్ విన్యాసం |
| a) s- బ్లాక్ | ns1-2 |
| b) p-బ్లాక్ | ns2np1-6 |
| c) d-బ్లాక్ | (n – 1)d1-9ns1-2 |
| d) f-బ్లాక్ | ns2 (n – 1)d0 or 1 (n – 2)f1-14 |
ప్రశ్న 12.
B, Al, Mg, K. లోహ స్వభావం పెరిగే క్రమాన్ని రాయండి.
జవాబు:
ఇవ్వబడిన మూలకాలు B, Al, Mg మరియు K.
లోహ స్వభావం పెరిగే క్రమం
![]()
ప్రశ్న 13.
పరిరక్షక ప్రభావం అంటే ఏమిటి? అది ఏ విధంగా అయొనైజేషన్ ఎంథాల్పీ (I.E) తో సంబంధం కలిగి ఉంది?
జవాబు:
ఆర్బిటాల్లోని అంతర ఎలక్ట్రానులు బాహ్య ఎలక్ట్రాన్లకు – కేంద్రకం మధ్య ఆకర్షణలపై కనబరిచే ప్రభావాన్ని పరిరక్షక ప్రభావం అంటారు. పరిరక్షక ప్రభావము I.E లకు అనులోమాను పాతంలో ఉంటుంది.
ప్రశ్న 14.
ఆక్సిజన్, హైడ్రోజన్ పరంగా ఆర్సినిన్కు సాధ్యమయ్యే వేలన్సీ ఎంత?
జవాబు:
ఆర్సినిక్ రెండు ఆక్సైడ్ నిస్తుంది. అవి As2O3 మరియు As2O5 లు.
As2O3 లో ఆర్సినిక్ వేలన్సీ ‘3’ మరియు As2O5 లో ఆర్సినిక్ వేలన్సీ ‘5′.
ప్రశ్న 15.
అధిక రుణ విద్యుదాత్మకత కల మూలకం ఏది? దానికి అత్యధిక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉందా? ఎందుకు ఉంది? ఎందుకు లేదు?
జవాబు:
అత్యధిక ఋణవిద్యుదాత్మకత కలిగిన మూలకము ఫ్లోరిన్(F). కాని ఫ్లోరిన్కు అత్యధిక EA విలువ లేదు. క్లోరిన్ (Cl) కు ఫ్లోరిన్ కన్నా అధిక EA విలువ ఉంటుంది.
కారణం:
ఫ్లోరిన్ పరమాణువు క్లోరిన్ పరమాణువు కంటే చిన్నది కావడం వల్ల ఇది జరుగుతుంది. ఫ్లోరిన్లో బలమైన అంతర్ ఎలక్ట్రాన్ వికర్షణలు కూడా ఉంటాయి. కాబట్టి ఫ్లోరిన్ పరమాణువుకు ఎలక్ట్రాన్కు చేర్చినప్పుడు విడుదలైన శక్తిలో కొంత భాగం అంతర్ ఎలక్ట్రాన్ వికర్షణలను అధిగమించడానికి వినియోగమవుతుంది. కాబట్టి నికరంగా విడుదలైన శక్తి క్లోరిన్లో కంటే ఫ్లోరిన్లో తక్కువగా ఉంటుంది.
ప్రశ్న 16.
కర్ణ సంబంధము అనగానేమి? దానికి ఒక ఉదాహరణ వ్రాయండి. [TS 22] [May’2010]
జవాబు:
కర్ణ సంబంధం :
ఆవర్తన పట్టికలో రెండో పీరియడ్లోని మొదటి మూలకానికి మూడో పీరియడ్లోని తరువాత గ్రూపు రెండో మూలకానికి మధ్య గల సారూప్య సంబంధాన్నే “కర్ణ సంబంధం” అంటారు.
ఉదా: (Li, Mg); (Be, Al); (B, Si)
![]()
ప్రశ్న 17.
మూడవ పిరియడ్ లో ఆక్సైడ్ల స్వభావము Na2O నుండి Cl2O7 నకు ఎలా మారుతుంది?
జవాబు:
Na2O నుండి Cl2O7 వరకు క్షారస్వభావము తగ్గును మరియు ఆమ్ల స్వభావము పెరుగును.
Na,O, MgO SiO,, P,O, SO,, Clzo, AlO, ద్విస్వభావ
ప్రశ్న 18.
ఐరన్ పరమాణువు, వాటి అయాన్ల వ్యాసార్థాలు పాటించే. క్రమం Fe > Fe+2 > Fe+3 విశదీకరించండి.
జవాబు:
లోహపరమాణువుల మీద ధనావేశము పెరిగితే ఫలిత కేంద్రక ఆవేశము పెరుగును. అందువలన పరిమాణము తగ్గును.
ప్రశ్న 19.
ఒక మూలకం రెండో అయొనైజేషన్ ఎంథాల్పీ (IE2) కంటె మొదటి అయొనైజేషన్ ఎంథాల్పీ (IE1) తక్కువ. ఎందుకు?
జవాబు:
ఒక ఎలక్ట్రాన్ను తొలగించిన తరువాత మిగిలిన ఎలక్ట్రాన్ లమీద ఫలిత కేంద్రక ఆవేశము పెరుగును.
అందువలన కేంద్రకము మరియు బాహ్య ఎలక్ట్రాన్ల మధ్య ఆకర్షణ పెరుగును కావున IE2 > IE1.
ప్రశ్న 20.
“లాంధనైడ్ సంకోచము” అనగానేమి? వాటి ప్రభావాలను తెలపండి? [TS 22]
జవాబు:
(n-2)f ఎలక్ట్రాన్ల పరిరక్షక ప్రభావం తక్కువగా వుండడం వల్ల, లాంధనమ్ శ్రేణిలోని పరమాణు పరిమాణం మరియు అయానిక వ్యాసార్థాలలో క్రమ తగ్గుదలనే “లాంధనైడ్ సంకోచం” అని అంటారు.
ప్రభావాలు:
- లాంధనైడ్ సంకోచ ప్రభావం వల్ల మూలకాల స్పటిక నిర్మాణాలు, కొన్ని ధర్మాలు ఒకే విధంగా ఉంటాయి.
- ఈ ప్రభావం కారణంగా లాంథనైడ్ మూలకాలను వాటి మిశ్రమాల నుండి వేరుచేయుట కష్టం.
ప్రశ్న 21.
ఆక్సిజన్ IE1 < నైట్రోజన్ IE1 కాని ఆక్సిజన్ IE2 > నైట్రోజన్ IE2– విశదీకరించండి.
జవాబు:
N లో సగం నిండిన ఆర్బిటాళ్ళు (2p³) కలవు. కావున ఆక్సిజన్ IE1 < నైట్రోజన్ IE1
O+ అయాన్లో సగం నిండిన ఆర్బిటాళ్ళు (2p³) కలిగి ఉండును. కావున ఆక్సిజన్ IE2 > నైట్రోజన్ IE2.
![]()
ప్రశ్న 22.
Na+, Ne లకు ఒకే ఎలక్ట్రాన్ విన్యాసం ఉన్నప్పటికీ, Na+ కు Ne కంటే ఎక్కువ అయనీకరణ శక్మపు విలువను కలిగి ఉంది-విశదీకరించండి.
జవాబు:
Na+, Ne లకు ఒకే ఎలక్ట్రాన్ విన్యాసం ఉన్నప్పటికి Na+ కు Ne కంటే ఎక్కువ అయనీకరణ శక్మం విలువ ఉంది.
వివరణ:
Na+ అయాన్, Ne లకు ఎలక్ట్రాన్ విన్యాసం 1s²2s²2p6.
Na+ అయాన్లో Ne లో కంటే కేంద్రక ఆవేశం ఎక్కువగా ఉండును.
ప్రశ్న 23.
a) అత్యధిక అయొనైజేషన్ ఎంథాల్పీ ఉన్న మూలకం ఏది?
b) అత్యధిక అయొనైజేషన్ ఎంథాల్పీ విలువ గల గ్రూపు ఏది?
c) అత్యధిక ఎలక్ట్రాన్ అఫినిటీని చూపే మూలకం ఏది?
d) మెండలీవ్ కాలానికి తెలియని మూలకాల పేర్లు ఏమిటి?
e) ఏవైనా రెండు వారధి మూలకాల పేర్లు తెలపండి.
జవాబు:
a) అత్యధిక I.E1 కలిగిన మూలకం ‘హీలియం’.
b) అధిక I.E1 కలిగిన గ్రూపు శూన్య గ్రూపు (లేదా) జడవాయువుల గ్రూపు.
c) అధిక ఎలక్ట్రాన్ ఎఫినిటీ కలిగిన మూలకం క్లోరిన్.
d) మెండలీవ్ కాలానికి తెలియని మూలకాలు జెర్మేనియం (ఎకాసిలికాన్), స్కాండియం (ఎకా అల్యూమినియం), గాలియం (ఎకాబోరాన్).
e) మూడవ పీరియడ్ మూలకాల్ని వారధి మూలకాలు అంటారు. ఉదా: సోడియం, మెగ్నిషియం.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
పరివర్తన మూలకాలు అనగానేమి? ఈ మూలకాల ధర్మాలలో ఏవైనా అయిదింటిని తెలియజేయుము.
జవాబు:
పరివర్తన మూలకాల్లో బాహ్య కక్ష్యలోని ns, (n-1)d ఎలక్ట్రాన్లు అసంపూర్తిగా నిండి వుంటాయి. ఈ లోహాలు సాధారణంగా రసాయనికంగా చర్యాశీలత గల S-బ్లాకు మూలకాలకు మరియు చర్యాశీలత లేని 13, 14 వ గ్రూపులకు మధ్య వారధి వలె వుండును. కావున ఈ మూలకాలను పరివర్తన మూలకాలు అని పిలుస్తారు.
పరివర్తన మూలకాల ధర్మాలు :
- ఇవన్నీ గట్టి లోహాలు. వీటికి అధిక ద్రవీభ్రవన స్థానం, బాష్పీభవన స్థానం వుంటాయి.
- ఇవన్నీ మంచి ఉష్ణ, విద్యుద్వాహకాలు
- ఇవి రంగు గల అయన్లను ఏర్పరుస్తాయి.
- ఇవి ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి.
- ఇవి పారా అయస్కాంత స్వభావాన్ని కలిగి వుంటాయి.
- ఇవి సంక్లిష్ట సమ్మేళనాలను ఏర్పరుస్తాయి.
- ఇవి ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
ప్రశ్న 2.
3వ పీరియడ్లో ఏ మూలకానికి అత్యధిక IE1 ఉన్నది? ఈ పీరియడ్లో IE1 లో మార్పును విశదీకరించండి?
జవాబు:
(i) 3వ పీరియడ్లో ఉన్న ఆర్గాన్(Ar) నకు అత్యధిక I.E ఉండును.
(ii) పీరియడ్లో ఎడమ నుండి కుడికి కేంద్రక ఆవేశం క్రమంగా పెరుగతూ ఉంటుంది. అందువల్ల I.E కూడా పెరుగును. కావున I.E పెరగవలసిన క్రమం Na < Mg < Al < Si < S < Cl < Ar.
నిజానికి I.E పెరిగే క్రమం Na < Mg > Al < Si < P > S < Cl < Ar.
కారణాలు:
- Al యొక్క 3s-ఉపకర్పరాలు పూర్తిగా నిండి ఉండటం మరియు Al యొక్క ‘s’ ఆర్బిటాళ్ళకు ‘P’ ఆర్బిటాళ్ల కంటే ఎక్కువగా చొచ్చుకుపోవు స్వభావం ఉండటం వలన Al యొక్క I.E Mg కన్నా తగ్గింది.
- ‘P’ లో సగం నిండిన p-ఆర్బిటాళ్ళ(3s²3p³) వలన దానికి అధిక స్థిరత్వం. తద్వారా ‘S’ కన్నా అధిక I.E.
![]()
ప్రశ్న 3.
వ్యాసార్థంలో మాతృక పరమాణువుల కంటే ఎందుకు కాటయాన్ చిన్నగా ఉంటుందో, ఆనయాన్ పెద్దగా ఉంటుందో విశదీకరించండి.
జవాబు:
కాటయాన్ అనగా ధనావేశిత అయాన్. ఇది పరమాణువు (లేదా) మూలకం ఎలక్ట్రాన్ కోల్పోయినప్పుడు ఏర్పడును.
M → M+ + eΘ
కాటయాన్ నందు కేంద్రక ఆవేశం ఎక్కువగా ఉంటుంది. కావున పరిమాణం తగ్గును, వ్యాసార్థం కూడా కాటయాన్లో తగ్గును.
అనయాన్ అనగా ఋణావేశిత అయాన్. ఇది పరమాణువు (లేదా) మూలకం ఎలక్ట్రాన్ గ్రహించినప్పుడు ఏర్పడును.
M + e– → MΘ
అనయాన్నందు తక్కువ కేంద్రక ఆవేశం ఉంటుంది. కావున పరిమాణం పెరుగును, వ్యాసార్థం కూడా పెరుగును.
ప్రశ్న 4.
కింద వాటి సాధారణ బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసాలను తెలపండి. (a) ఉత్కృష్ట వాయువులు (b) ప్రాతినిధ్య మూలకాలు (c) పరివర్తన మూలకాలు (d) అంతర పరివర్తన మూలకాలు
జవాబు:
| వర్గీకరింపబడిన మూలకాలు | సాధారణ బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసము |
| a) ఉత్కృష్ణ వాయువులు | ns2np6 |
| b) ప్రాతినిధ్య మూలకాలు | ns1-2 np0-5 |
| c) పరివర్తన మూలకాలు | (n – 1)d1-10ns1-2 |
| d) అంతర పరివర్తన మూలకాలు | (n – 2)f1-14 (n – 1)d0,1ns2 |
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
ఆధునిక ఆవర్తన నియమాన్ని నిర్వచించండి. దీని ఆధారంగా విస్తృత ఆవర్తన పట్టిక నిర్మాణం ఎలా జరిగిందో వివరించుము?
జవాబు:
ఆధునిక ఆవర్తన నియమం:
“మూలకాల భౌతిక, రసాయన ధర్మాలు వాటి పరమాణు సంఖ్య లేదా ఎలక్ట్రాన్ విన్యాసాల ఆవర్తన ప్రమేయాలు”.
- ఆధునిక ఆవర్తన పట్టికలో, మూలకాలను వాటి పరమాణు సంఖ్యలు పెరిగే క్రమంలో అమర్చారు.
- మూలకాల ఎలక్ట్రాన్ విన్యాసం మీద ఆధారపడి ఆవర్తన పట్టిక నిర్మించబడినది.
నిర్మాణం :
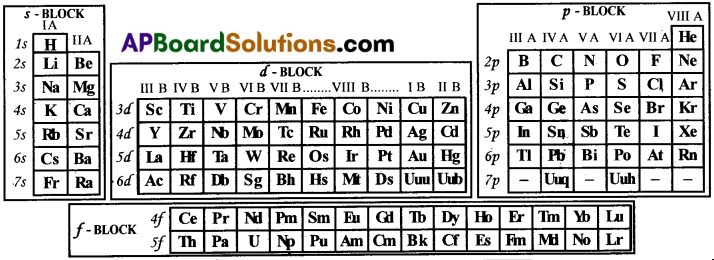
ఆవర్తన పట్టికలో అడ్డువరుసలతో “7 పీరియడ్లు”, నిలువు వరుసలతో 18 గ్రూపులు ఉండును. ఆవర్తన పట్టికను s,p,d,f అనే 4 బ్లాకులుగా వర్గీకరించారు.
పీరియడ్లు :
- మొదటి పీరియడ్లో రెండు మూలకాలు ఉండును. అవి H మరియు He.దీనిని “అతిపొట్టి పీరియడ్” అని అంటారు.
- రెండవ పీరియడ్లో 8 మూలకాలు ఉండును. అవి Li నుండి Ne వరకు వుంటాయి. దీనిని “పొట్టి పీరియడ్” అంటారు.
- మూడవ పీరియడ్లో 8 మూలకాలు వుంటాయి. అవి Na నుండి Ar వరకు వుంటాయి. దీనిని కూడా “పొట్టి పీరియడ్” అంటారు.
- నాల్గవ పీరియడ్లో K నుండి Kr వరకు 18 మూలకాలు వుంటాయి. దీనిని “పొడుగు పీరియడ్” అంటారు.
- ఐదవ పీరియడ్లో Rb నుండి Xe వరకు 18 మూలకాలు వుంటాయి. దీనిని కూడా “పొడుగు పీరియడ్” అంటారు.
- ఆరవ పీరియడ్లో Cs నుండి Rn వరకు 32 మూలకాలు వుంటాయి. దీనిని “అతిపొడుగు పీరియడ్” అంటారు.
- ఏడవ పీరియడ్ అసంపూర్తిగా నిండి వుంటుంది. ఇది Fr నుండి ప్రారంభమవుతుంది.
- 14 లాంధనైడ్లు మరియు 14 ఆక్సినైడ్లు ఆవర్తన పట్టిక క్రింది భాగంలో అమర్చబడినవి.
- ఆవర్తన పట్టికలో ప్రతి పీరియడ్ క్షారలోహాలతో ప్రారంభమై జడవాయువులతో ముగుస్తుంది.
- మూలకాల భౌతిక, రసాయన ధర్మాలు పీరియడ్లలో క్రమంగా మారుతూ వుంటాయి.
గ్రూపులు :
1.ఆధునిక పట్టికలోని 18 గ్రూపులను IUPAC నియమం ప్రకారం 1 నుండి 18 సంఖ్యలతో సూచిస్తారు.
ప్రారంభకాలంలో గ్రూప్ సంఖ్యలు:
IA(1), IIA(2), IIIA to VIIB (3 to 7) VIII (8,9,10), IB(11), IIB(12), IIIA to VIIA (13 to 17) and O group(18).
2. సున్న గ్రూపు మూలకాలను ఆవర్తన పట్టిక కుడి వైపు అమర్చారు. వీటిని ఉత్కృష్ణ వాయువులు లేదా విరళ వాయువులు అని కూడా అంటారు. ఇది అష్టక విన్యాసాన్ని కలిగి వుంటుంది.
3. ఒకే గ్రూపులో ఉన్న అన్ని మూలకాల వేలన్సీలు సమానంగా వుంటాయి. అందుచేత, గ్రూపులలో అన్ని మూలకాలు సమాన ధర్మాలను చూపుతాయి.
బ్లాకులు :
ప్రధాన కర్పరం నుండి ఉపకర్పరంలోకి భేదాత్మక ఎలక్ట్రాన్ ప్రవేశించడం ఆధారంగా చేసుకొని మూలకాలను బ్లాకులుగా వర్గీకరించారు. అవి s- బ్లాకు, p-బ్లాకు, d-బ్లాకు, f-బ్లాకులు.
ప్రశ్న 2.
మూలకాల s,p,d,f బ్లాకుల వర్గీకరణ గూర్చి విశదీకరించండి. [AP 17,19,20][TS 19]
జవాబు:
“భేదాత్మక ఎలక్ట్రాన్” “ప్రధాన కర్పరం నుండి ఉపకర్పరంలోకి ప్రవేశించడాన్ని’ ఆధారంగా చేసుకొని మూలకాలను నాలుగు బ్లాకులుగా వర్గీకరించడం జరిగింది. అవి – బ్లాకు, p-బ్లాకు, d- బ్లాకు, f-బ్లాకు.
1. S-బ్లాకు మూలకాలు :
- భేదాత్మక ఎలక్ట్రాన్, S-ఉపస్థాయిలోకి ప్రవేశించే మూలకాలను S-బ్లాకు మూలకాలు అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం ns1-2.
- అన్ని S-బ్లాకు మూలకాలను రెండు గ్రూపులలో అమర్చినారు. అవి 1వ గ్రూపు (IA), 2వ గ్రూపు (IIA)
- IAగ్రూపు మూలకాలను క్షారలోహాలు అని మరియు IIA గ్రూపు మూలకాలను క్షారమృత్తిక లోహాలు అంటారు.
- IA గ్రూపు మూలకాల సాధారణ ఎలక్ట్రాన్ విన్యాసం ns¹ మరియు IIA గ్రూపు ఎలక్ట్రాన్ విన్యాసం ns²
- వీటిని ఆవర్తన పట్టికలో ఎడమవైపున ఉంచారు.
2. p-బ్లాకు మూలకాలు :
- భేదాత్మక ఎలక్ట్రాన్, p-ఉపశక్తి స్థాయిలోకి ప్రవేశించే మూలకాలను p-బ్లాకు మూలకాలు అని అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం ns² np1 to 6
- p-బ్లాకు మూలకాలను 6 గ్రూపులలో అమర్చినారు. అవి 13వ గ్రూపు (IIIA) నుండి 18వ గ్రూపు వరకు వుంటాయి (ఎందుకంటే p-ఉపశక్తి స్థాయిలో 6 ఎలక్ట్రానులు వుండవచ్చు)
- p-బ్లాకు మూలకాలు 13వ గ్రూపు అనగా IIIA గ్రూపుతో ప్రారంభమై 18వ గ్రూపు అనగా సున్న గ్రూపుతో అంతమగును.
i) 13వ గ్రూపు (లేదా) IIIA గ్రూపును “బోరాన్ కుటుంబం” అంటారు.
ii) 14వ గ్రూపు (లేదా) IVA గ్రూపును “కార్బన్ కుటుంబం” అంటారు. iii) 15వ గ్రూపు (లేదా) VA గ్రూపును “నైట్రోజన్ కుటుంబం” అంటారు.
iv) 16వ గ్రూపు (లేదా) VIA గ్రూపును “చాల్కోజన్ కుటుంబం” అని అంటారు.
v) 17వ గ్రూపు (లేదా) VIIA గ్రూపును “హాలోజన్ కుటుంబం” అంటారు.
vi) 18వ గ్రూపు (లేదా) సున్న గ్రూపు మూలకాలను “జడ వాయువులు” అని అంటారు. - వీటిని ఆవర్తన పట్టికలో కుడివైపున ఉంచారు.
3. d-బ్లాకు మూలకాలు :
- భేదాత్మక ఎలక్ట్రాన్, (n-1) d ఉప కక్ష్యలోకి ప్రవేశించే మూలకాలను d-బ్లాకు మూలకాలు అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం (n-1)d1 to 9 ns1 or 2
- అన్నీ d-బ్లాకు మూలకాలను 10గ్రూపులలో అమర్చారు. అవి 3వ గ్రూపు (IB) నుండి 12 గ్రూపు (VIIB) వరకు
- d-బ్లాకు మూలకాలను మరలా 4 పరివర్తన శ్రేణులుగా వర్గీకరించారు. (భేదాత్మక ఎలక్ట్రాన్ (n-1)d ఉపశక్తి స్థాయి మీద ఆధారపడుతుంది కావున అవి 3d శ్రేణి, 4d శ్రేణి, 5d శ్రేణి మరియు 6d శ్రేణి.
- వీటిని ఆవర్తన పట్టికలో మధ్యలో ఉంచారు.
4. f-బ్లాకు మూలకాలు :
- భేదాత్మక ఎలక్ట్రాన్, (n–2)f ఉపశక్తి స్థాయిలోకి ప్రవేశించే మూలకాలను f-బ్లాకు మూలకాలు అని అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 2) f1 to 14 (n – 1)d0 or 1 ns².
- f-బ్లాకు మూలకాలను 14 వరుసలుగా అమర్చారు.
- f-బ్లాకు మూలకాలను మరలా 2 శ్రేణులుగా వర్గీకరించారు. అవి
4f- శ్రేణి. వీటిని లాంథనైడ్లు అని అంటారు మరియు 5f- శ్రేణి. వీటినే ఆక్టినైడ్లు అని అంటారు. - వీటిని ఆవర్తన పట్టికలో ప్రత్యేకంగా అడుగుభాగాన ఉంచారు.
![]()
ప్రశ్న 3.
మూలకాల విన్యాసాలను వాటి లక్షణాలను మూలకాల వర్గీకరణ తీరుతో అన్వయించండి.
జవాబు:
మూలకాల రసాయన ధర్మాలు మరియు వాటి ఎలక్ట్రాన్ విన్యాసం ఆధారంగా, మూలకాలను ఆవర్తన పట్టికలో 4 రకాలుగా విభజించారు.
- ఉతృష్ట వాయువులు
- ప్రాతినిధ్య మూలకాలు
- పరివర్తన మూలకాలు
- అంతర పరివర్తన మూలకాలు
I. నోబుల్ వాయువులు/జడ వాయువులు / విరళ వాయువులు :
- సున్న గ్రూపు (18వ గ్రూపు) మూలకాలనే జడ వాయువులు అని అంటారు.
అవి He, Ne, Ar, Kr, Xe మరియు Rn. - He (1s²) తప్ప మిగిలిన మూలకాల సాధారణ బాహ్య ఎలక్ట్రాన్ విన్యాసం ns² np6
ధర్మాలు:
- ఈ మూలకాల బాహ్య కక్ష్యలో 8 ఎలక్ట్రానులు ఉండుట వలన రసాయనికంగా జడత్వంను ప్రదర్శించును.
- జడ వాయువులు అన్ని ఏకపరమాణుకాలుగా వుంటాయి.
- ఇవి వాయుస్థితిలో వుంటాయి (సాధారణ పరిస్థితులలో)
II. ప్రాతినిధ్య మూలకాలు :
- సున్న గ్రూపు మూలకాలు కాకుండా, మిగిలిన S-బ్లాకు మరియు p-బ్లాకు మూలకాలను కలిపి ప్రాతినిధ్య మూలకాలు అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం ns1 or 2 np0 to 5
ధర్మాలు :
- ఈ మూలకాలు రసాయనికంగా చురుకైనవి. ఎందుకనగా దీనిలోని వేలన్సీ స్థాయిలో ఎలక్ట్రానులు అసంపూర్తిగా నిండి వుంటాయి. ఈ మూలకాలు ఎలక్ట్రాన్లను వదులుకొని (లేదా) గ్రహించి జడ వాయు విన్యాసాన్ని పొందుతాయి.
- ఈ మూలకాలు అయానిక మరియు సంయోజనీయ బంధాలను ఏర్పరుస్తాయి.
- Be తప్ప మిగిలిన S బ్లాకు మూలకాలు అన్ని లోహాలే.
p- బ్లాకు మూలకాలలో లోహాలు, అలోహాలు మరియు అర్ధలోహాలు కూడా వుంటాయి.
III. పరివర్తన మూలకాలు :
- d-బ్లాకు మూలకాలను పరివర్తన మూలకాలు అంటారు.
- వీటి సాధారణ ఎలక్ట్రాను విన్యాసం (n-1)d1 to 10 np1 or 2.
ధర్మాలు :
- ఇవన్నీ గట్టి, భారీ లోహాలు.
- వీటికి అధిక ద్రవీభవన స్థానాలు, బాష్పీభావన స్థానాలు మరియు సాంద్రతలు వుంటాయి.
- ఇవి మంచి ఉష్ణ, విద్యుద్వాహకాలు
- ఒకటి కంటే ఎక్కువ ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి.
- పారా అయస్కాంత ధర్మాన్ని ప్రదర్శిస్తాయి.
- ఈ మూలకాలు ఇత్తడి, కంచు లాంటి మిశ్రమలోహాలను ఏర్పరుస్తాయి.
- ఇవి మంచి ఉత్ప్రేరకాలుగా పనిచేస్తాయి.
- ఈ మూలకాలు రంగు గల మూలకాలను ఏర్పరుస్తాయి (d-d పరివర్తనల వల్ల)
- ఈ మూలకాలు, ఇతర మూలకాలతో సంక్లిష్ట సమ్మేళనాలను ఏర్పరుస్తాయి.
IV. అంతర పరివర్తన మూలకాలు :
- f- బ్లాకు మూలకాలనే అంతర పరివర్తన మూలకాలు అని అంటారు.
- వీటి సాధారణ ఎలక్ట్రాన్ విన్యాసం (n – 2) f1 to 14 (n – 1)d0 or 1 ns².
ధర్మాలు:
- ఇవన్నీ లోహాలు, వీటికి అధిక ద్రవీభవన స్థానాలు, బాష్పీభవన స్థానాలు వుంటాయి.
- ఈ మూలకాలు వివిధ ఆక్సీకరణ స్థితులను ప్రదర్శిస్తాయి.
- పారా అయస్కాంత ధర్మాన్ని ప్రదర్శిస్తాయి.
- ఇవి రంగు గల మూలకాలను ఏర్పరుస్తాయి.
- ఇవి సంక్లిష్ట సమ్మేళనాలను ఏర్పరుస్తాయి.
ప్రశ్న 4.
ఆవర్తన ధర్మము అనగానేమి? ఈ క్రింది ధర్మాలు గ్రూపులో మరియు పీరియడ్లలో ఏవిధంగా మారతాయి. వివరించండి?
a) పరమాణు వ్యాసార్ధం b) ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ c) ఋణ విద్యుదాత్మకత d) అయనీకరణ శక్తి. [IPE ‘10,11,14,14][AP 15][TS 15,16,18][AP 16,17,18]
జవాబు:
ఆవర్తన ధర్మము :
ఆవర్తన పట్టికలో మూలకాల ధర్మాలు, క్రమంగా ఎలక్ట్రాన్ విన్యాసంతో పాటు మారతాయి. ఈ మార్పుల సరళి క్రమ వ్యవధులలో పునరావృతమవుతుంది. ఇలా ఒక ధర్మం పునరావృతమవడాన్నే ‘ఆవర్తనం ధర్మం’ అంటారు.
a) పరమాణు వ్యాసార్ధం:
పరమాణు కేంద్రక మధ్య బిందువు నుండి బాహ్య శక్తి స్థాయిలో గల ఎలక్ట్రాన్ మేఘానికి మధ్య గల దూరాన్ని పరమాణు వ్యాసార్ధం అంటారు.
i) గ్రూపులలో పై నుండి క్రిందకు పరమాణు వ్యాసార్ధం పెరుగుతుంది.
కారణం :
గ్రూపులలో బేధపరిచే ఎలక్ట్రాన్ కొత్త కక్ష్యలోకి ప్రవేశిస్తుంది. అందుచేత పరమాణు వ్యాసార్ధం పెరుగుతుంది.
ii) పీరియడ్లలో ఎడమ నుండి కుడికి పరమాణు వ్యాసార్ధం తగ్గుతుంది.
కారణం :
పీరియడ్లలో భేదపరిచే ఎలక్ట్రాన్ అదే బాహ్యకక్ష్యలోకి చేరతాయి. కావున కేంద్రకం యొక్క ఆకర్షణ, వేలన్సీ ఎలక్ట్రాన్లపై పెరుగుతాయి. అందుచేత పరమాణు వ్యాసార్ధం తగ్గుతుంది.
b) ఎలక్ట్రాన్ ఎఫినిటీ (లేదా ఎంథాల్పీ) :
వాయుస్థితిలో ఉన్న ఒంటరి తటస్థ పరమాణువుకు ఎలక్ట్రాన్ను చేర్చి దానిని అయాన్గా మార్చినప్పుడు విడుదలయ్యే శక్తిని “ఎలక్ట్రాన్ ఎఫినిటీ” అంటారు.
ఎలక్ట్రాన్ ఎఫినిటీ (EA) పరమాణు పరిమాణంపై ఆధారపడుతుంది.
i) గ్రూపులలో పై నుండి క్రిందకు ఎలక్ట్రాన్ ఎఫినిటీ విలువలు తగ్గుతాయి.
కారణం :
గ్రూపులలో పరమాణు పరిమాణం పెరుగుతుంది. దీని వల్ల ఎలక్ట్రాన్ మీద కేంద్రకం యొక్క ఆకర్షణ తగ్గుతుంది. కావున పరమాణువు కొత్త ఎలక్ట్రానన్ను చేర్చుకోవడానికి ఆపేక్ష తక్కువగా వుంటుంది. కావున గ్రూపులలో EA తక్కువగా వుంటుంది.
ii) పీరియడ్లలో ఎడమ నుండి కుడికి ఎలక్ట్రాన్ ఎఫినిటీ పెరుగుతుంది.
కారణం :
పీరియడ్లలో పరమాణు వ్యాసార్ధం తగ్గుతుంది. దీనివల్ల కేంద్రకం యొక్క ఆకర్షణ ఎలక్ట్రాన్లపై పెరుగుతుంది. కావున కొత్త ఎలక్ట్రాన్ చేరడానికి ఆపేక్ష ఎక్కువ. ఆవిధంగా ఎలక్ట్రాన్ ఎఫినిటీ విలువలు పీరియడ్లలో ఎడమ నుండి కుడికి పెరుగుతాయి.
(c) ఋణ విద్యుదాత్మకత (EN) :
బంధంలో సమిష్టిగా పంచుకున్న ఎలక్ట్రాన్ జంటలను ఒక మూలక పరమాణువు తనవైపుకు ఆకర్షించుకునే ప్రవృత్తినే ఆ మూలకం యొక్క “ఋణ విద్యుదాత్మకత” అంటారు.
i) గ్రూపులలో పై నుండి క్రిందకు ఋణ విద్యుదాత్మకత తగ్గుతుంది.
కారణం :
గ్రూపులో పరమాణు పరిమాణం పెరగడం మరియు బాహ్య ఎలక్ట్రాన్ల మీద కేంద్రకం యొక్క ఆకర్షణ తక్కువగా వుండడం వల్ల ఋణ విద్యుదాత్మకత విలువలు గ్రూపులో పై నుండి క్రిందకు తగ్గుతాయి.
ii) పీరియడ్లలో ఎడమ నుండి కుడికి ఋణ విద్యుదాత్మకత విలువలు పెరుగుతాయి.
కారణం :
పీరియడ్లలో పరమాణు పరిమాణం తగ్గడం మరియు బాహ్య కక్ష్యలోని ఎలక్ట్రాన్ మీద కేంద్రకం యొక్క ఆకర్షణ పెరుగుతుంది. అందుచేత ఋణ విద్యుదాత్మకత విలువలు పీరియడ్లలో ఎడమ నుండి కుడికి పెరుగుతాయి.
d) అయనీకరణ శక్తి (IP) :
వాయుస్థితిలోని ఒంటరి తటస్థ పరమాణువు నుండి ఒక ఎలక్ట్రాన్ ను తీసివేయడానికి కావలసిన కనీసపు శక్తినే అయనీకరణ శక్తి అంటారు.
i) గ్రూపులలో పై నుండి క్రిందకు అయనీకరణ శక్తి తగ్గుతుంది.
కారణం :
గ్రూపులో పరమాణు పరిమాణం పెరగడం మరియు బాహ్య ఎలక్ట్రాన్ల మీద కేంద్రకం యొక్క ఆకర్షణ తక్కువగా వుండడం వల్ల అయనీకరణ శక్తి విలువలు గ్రూపులో పై నుండి క్రిందకు తగ్గుతాయి.
ii) పీరియడ్లలో ఎడమ నుండి కుడికి అయనీకరణ శక్తి విలువలు పెరుగుతాయి.
కారణం :
పీరియడ్లలో పరమాణు పరిమాణం తగ్గడం మరియు బాహ్య కక్ష్యలోని ఎలక్ట్రాన్ మీద కేంద్రకం యొక్క ఆకర్షణ పెరుగుతుంది. అందుచేత అయనీకరణ శక్తి విలువలు పీరియడ్లలో ఎడమ నుండి కుడికి పెరుగుతాయి.
ప్రశ్న 5.
IE1, IE2 లను నిర్వచించండి. ఏదైనా పరమాణువుకు IE2 > IE1 గా ఎందుకు ఉంటుంది? ఒక మూలకపు IE ని ప్రభావితం చేసే అంశాలను చర్చించండి. [AP 22][TS 22][AP,TS 16,17,18,19]
జవాబు:
i) ప్రథమ అయనీకరణ శక్తి (IE1):
వాయు స్థితిలో వున్న ఒంటరి తటస్థ పరమాణువు యొక్క బాహ్య స్థాయి నుంచే ఒక ఎలక్ట్రాను తొలగించుటకు కావలసిన శక్తిని ప్రథమ అయనీకరణ శక్తి అంటారు.
M(వా) + I.E1 → M+(వా) + e–.
ద్వితీయ అయనీకరణ శక్తి(IE2):
ఏక ధనాత్మక అయాన్ నుండి ఎలక్ట్రాన్ తీసివేయడానికి కావలసిన కనీసపు శక్తినే ద్వితీయ అయనీకరణ శక్తి అని అంటారు.
M+(వా) + I.E2 → M++(వా) + e–
ii) ద్వితీయ అయనీకరణ శక్తి ప్రథమ అయనీకరణ శక్తి కన్నా ఎక్కువ.
కారణం:
తటస్థ పరమాణువులో ఎలక్ట్రాన్ల సంఖ్య ప్రోటాన్ సంఖ్యకు సమానం. కానీ ఏకమాత్ర ధనావేశిత అయాన్లో ప్రోటాన్ల సంఖ్య ఎలక్ట్రాన్ల సంఖ్య కన్నా అధికం. అందువలన ఏకమాత్ర ధనావేశిక అయాన్ యొక్క కేంద్రకము తటస్థ పరమాణువు యొక్క కేంద్రకం కంటే ఎలక్ట్రాన్లను ఎక్కువ బలంగా ఆకర్షిస్తుంది. అందువలన ఏక మాత్ర ధనావేశిత అయాన్ నుండి ఎలక్ట్రాన్ తొలగించుటకు అధికశక్తి అవసరమవుతుంది. (అయాన్ పై ఆవేశం పెరిగినపుడు అయనీకరణ శక్తి కూడా పెరుగుతుంది).
iii) అయనీకరణ శక్తిని ప్రభావితం చేయు అంశాలు :
a) పరమాణు వ్యాసార్థం:
పరమాణు వ్యాసార్థం పెరిగిన కొలదీ, కేంద్రక ఆకర్షణ వేలన్సీ ఎలక్ట్రాన్లపై తగ్గుతుంది. కావున I.E విలువలు తగ్గుతాయి.
b) కేంద్రక ఆవేశం:
కేంద్రక ఆవేశం పెరిగిన కొద్ది, కేంద్రక ఆకర్షణ వేలన్సీ ఎలక్ట్రాన్ల మీద పెరుగుతుంది.
కావున I.E విలువలు పెరుగుతాయి.
c) యవనికా ప్రభావం (లేదా) పరిరక్షక ప్రభావం:
అంతర శక్తి స్థాయిలోని ఎలక్ట్రాన్లు కేంద్రక ఆకర్షణను బాహ్యస్ధాయి ఎలక్ట్రాన్లపై పడకుండా అడ్డుకుంటాయి. దీనిని పరిరక్షణ ప్రభావం లేదా యవనిక ప్రభావం అంటారు.
అంతర కక్షల సంఖ్య పెరిగే కొలదీ కేంద్రక ఆకర్షణ బాహ్య స్థాయి ఎలక్ట్రాన్లపై తగ్గుతుంది. అందువలన పరిరక్షణ ప్రభావం పెరిగే కొలదీ అయనీకరణ శక్తి విలువ తగ్గుతుంది.
iv) ఎలక్ట్రాన్లు ఆర్బిటాళ్ళ లోపలకి చొచ్చుకునిపోయే విస్తృతి :
ఇవ్వబడిన కర్పరాలలో, వేలన్సీ ఎలక్ట్రానులు కేంద్రకం వైపుకు చొచ్చుకుని పోయే సామర్ధ్యం s > p > d > f గా వుండును. కావున ‘ns’ ఎలక్ట్రాన్లు కేంద్రకాన్ని బలంగా పట్టుకుని వుంటాయి. ఇదే వరుసలో అయనీకరణశక్తి విలువులు కూడా క్రమంగా తగ్గుతాయి.
v) పూర్తిగా (లేదా) సగం నిండిన ఉపకర్పరాలు వుండడం :
పూర్తిగా లేదా సగము నిండిన ఉపకక్ష్యలు ఉన్న పరమాణువులు మిగిలిన వాటి కంటే స్థిరంగా ఉంటాయి. అందువలన అలాంటి మూలకాలకు ఊహించిన దాని కన్నా కొంచెం అధికంగా అయనీకరణ శక్తి ఉంటుంది.
![]()
ప్రశ్న 6.
క్రింది వాటిని విశదీకరించండి.
(a) సంయోజకత (b) కర్ణ సంబంధం (c) గ్రూప్ 1 లో ఆక్సైడ్లో స్వభావంలో మార్పు
జవాబు:
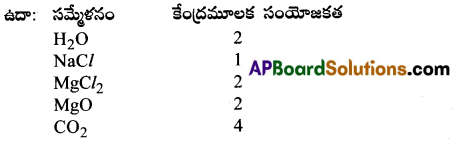
(a) సంయోజకత :
ఒక మూలకము యొక్క సంయోగ సామర్థ్యమును ‘సంయోజకత’ అంటారు. (లేదా) ‘ఏదైనా మూలక పరమాణువుతో సంయోగం చెందే హైడ్రోజన్ పరమాణువుల సంఖ్యను (లేదా) క్లోరిన్ పరమాణువుల సంఖ్యను (లేదా) ఆక్సిజన్ పరమాణువుల సంఖ్యకు రెట్టింపు సంఖ్యను ఆ మూలకపు సంయోజకత అంటారు.
∴ సంయోజకత = హైడ్రోజన్ పరమాణువుల సంఖ్య
= క్లోరిన్ పరమాణువుల సంఖ్య
= 2 × ఆక్సిజన్ పరమాణువుల సంఖ్య
సంయోజకత యొక్క ఆవర్తన క్రమం:
1. ప్రతి పీరియడ్ యొక్క సంయోజకత ‘1′ తో మొదలై ‘0’ తో అంతమగును.

2. గ్రూప్లో 4వ గ్రూప్ వరకు సంయోజకత గ్రూపు సంఖ్యకి సమానమగును. మరియు 5వ గ్రూప్ నుండి సంయోజకత (8- గ్రూప్ సంఖ్య) అగును.
ప్రాధాన్యత:
సమ్మేళనాల సాంకేతికాలు వ్రాయటంలో మూలక సంయోజకత ఉపయోగపడును.
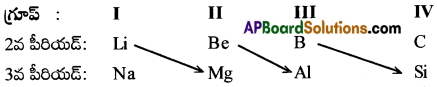
(b) కర్ణ సంబంధం :
ఆవర్తన పట్టికలో రెండో పీరియడ్లోని ఒక మూలకానికి మూడో పీరియడ్లోని తరువాత గ్రూపు రెండో మూలకానికి మధ్య గల సారూప్య సంబంధాన్నే “కర్ణ సంబంధం” అంటారు.
ఉదా: (Li-Mg); (Be-Al); (B-Si)
(c) మొదటి గ్రూప్ లో ఆక్సైడ్ స్వభావం :
IA గ్రూపు మూలకాలన్ని క్షార లోహాలే. వీటి ఆక్సైడ్లు క్షార స్వభావాన్ని కలిగి ఉండును.ఈ క్షార ఆక్సైడ్లు నీటిలో కరిగి క్షార ద్రావణాలను ఏర్పరుచును. ఇవి ఎర్ర లిట్మస్ ను నీలి రంగులోకి మార్చును.
ఉదా: Na2O + H2O → 2NaOH
గ్రూప్ పై నుంచి క్రిందకు పోయే కొలది, ఈ ఆక్సైడ్ క్షార స్వభావం పెరుగును.
Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
Z = 114 గల మూలకాన్ని ఏ పీరియడ్, ఏ గ్రూప్లో ఉంచుతారు?
జవాబు:
Z = 114 మూలకం ఎలక్ట్రాన్ విన్యాసం, [Rn] 5f14 6d10 7s² 7p²
Z = 114 గల మూలకం 7వ పీరియడ్ IVA గ్రూపులో ఉంచబడును.
ప్రశ్న 2.
(a) లారెన్స్ బర్క్లీ ప్రయోగశాల (b) సీబర్గ్ గ్రుప్ వీరిచే నామకరణం చేయబడిన మూలకాలు ఏవై ఉంటాయి?
జవాబు:
(a) లారెన్స్ బరీ (ప్రయోగశాల – లాంథనైడ్)
(b) సీబర్గ్ గ్రుప్ – ఆక్టినైడ్
ప్రశ్న 3.
ఒకే గ్రూప్ లోని మూలకాలు సారూప్య భౌతిక, రసాయన ధర్మాలను ఎట్లా కలిగి ఉంటాయి?
జవాబు:
ఒకే గ్రూపులోని మూలకాలు ఒకే సంఖ్యలో వేలన్సీ ఎలక్ట్రాన్లను కలిగి ఉంటాయి. మరియు ఒకే రకమైన బాహ్య కక్ష్య ఎలక్ట్రాన్ విన్యాసం కలిగి ఉంటాయి. కావున ఒకే రకమైన భౌతిక, రసాయన ధర్మాలు కలిగి ఉంటాయి.
![]()
ప్రశ్న 4.
ఆవర్తన పట్టికలో f-బ్లాక్ మూలకాల స్థానాన్ని సమర్థించండి.
జవాబు:
పరమాణు సంఖ్య ఆధారంగా లాంథనైడ్ మూలకాలను వర్గీకరణ పట్టిక ప్రధాన భాగంలో తీసుకుంటే అది మూలకాల వర్గీకరణ అవశ్యకతను నాశనం చేస్తుంది మరియు మూలకాల సౌష్ఠవ అమరిక కూడా దెబ్బతింటుంది. అందువల్ల ప్రధాన భాగం నుండి విడదీసి వర్గీకరణ పట్టిక క్రింది భాగంలో అమర్చుట జరిగింది.
ప్రశ్న 5.
డొబరైనర్ త్రిక నియమాన్ని, న్యూలాండ్ అష్టక నియమాన్ని నిర్వచించి ఒక్కొక్క ఉదాహరణను ఇవ్వండి.
జవాబు:
a) డొబరైనర్ త్రిక నియమం:
డోబరైనర్ ప్రకారం ప్రతి త్రికంలో మధ్య ఉన్న మూలక పరమాణు భారం మిగిలిన రెండు మూలకాల పరమాణు భారాల మధ్య ఉంటుంది.
![]()
b) న్యూలాండ్ అష్టక నియమం:
న్యూలాండ్ ప్రకారం మూలకాలను పరమాణు భారాలు పెరిగే క్రమంలో అమర్చినపుడు ప్రతి ఎనిమిదవ మూలకం మొదటి మూలక ధర్మాలతో పోలి ఉంటుంది.. ఈ సంబంధం సంగీత స్వరాలలో ఎనిమిదవ స్వరం మొదటి స్వరంతో పోలిక ఉంటుంది.
ప్రశ్న 6.
పీరియడ్లో, గ్రూప్లో పరమాణు వ్యాసార్థం ఎలా మార్పు చెందుతుంది? మార్పును ఎట్లా విశదీకరిస్తారు?
జవాబు:
పీరియడ్లో:
పీరియడ్లో ఎడమ నుంచి కుడికి కక్ష్యలు పెరగవు కాని కేంద్రకావేశం పెరుగుతుంది. కాబట్టి పరమాణు వ్యాసార్థం క్రమంగా తగ్గుతుంది.
గ్రూపులో:
గ్రూపులో పైనుండి కిందికి కక్ష్యల సంఖ్య పెరుగుతాయి కాబట్టి పరమాణు వ్యాసార్థం కూడా అదే క్రమంలో పెరుగుతుంది.
ప్రశ్న 7.
అయొనైజేషన్ ఎంథాల్పీని నిర్వచించినప్పుడు, భూస్థితిలోని ఒంటరి పరమాణువు అను పదానికి గల ప్రాముఖ్యం ఏమిటి?. (సూచన: పోల్చడానికి అవసరమైంది.)
జవాబు:
వాయుస్థితిలోని ఒంటరి తటస్థ పరమాణువు యొక్క బాహ్య కర్పరంలోని ఒక ఎలక్ట్రాన్ను తీసివేయుటకు కావలసిన శక్తిని అయనీకరణ శక్తి (ప్రథమ అయనీకరణ శక్తి) అంటారు.
ప్రశ్న 8.
భూస్థితిలో హైడ్రోజన్ పరమాణువులోని ఎలక్ట్రాన్ శక్తి 2.18 × 10-18J. హైడ్రోజన్ పరమాణువు అయొనైజేషన్ ఎంథాల్పీని J mol-1 లలో లెక్కకట్టండి.
జవాబు:
భూస్థితిలో హైడ్రోజన్ పరమాణువులోని ఎలక్ట్రాన్ శక్తి E1 = -2.18 × 10-18J
ఒక మోల్ పరమాణువులకు E1 = -2.18 × 10-18J × 6.023 × 1023 = 13.13 × 105 J/mole
హైడ్రోజన్ పరమాణువు అయొనైజేషన్ ఎంథాల్పీ = E∞ – E1 = 0 (-13.13 × 105 J/mole)
= +13.13 × 105 J/mole
![]()
ప్రశ్న 9.
కింది ప్రతి జంటలో, దేనికి అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది? [TS 22]
(a) O, F (b) F, Cl
జవాబు:
(a) ఫ్లోరిన్క ఆక్సిజన్ కంటే అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ కలిగియుండును.
(b) క్లోరిన క్కు ఫ్లోరిన్ కంటే అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ కలిగియుండును.
ప్రశ్న 10.
ఆవర్తన పట్టిక సహాయంతో కింది మూలకాలను గుర్తించండి.
(a) బాహ్య ఉపస్థాయిలో 5 ఎలక్ట్రాన్లు ఉన్నాయి.
(b) రెండు ఎలక్ట్రాన్లు పోగొట్టుకోగలది.
(c) రెండు ఎలక్ట్రాన్లను గ్రహించగలది.
జవాబు:
(a) బాహ్య కర్పరంలో ‘5′ ఎలక్ట్రాన్లు కలిగి ఉండేవి 15 వ గ్రూపు మూలకాలు.
ఉదా: N, P, As………….(ns²np³)
(b) రెండు ఎలక్ట్రాన్లను కోల్పోయేవి IIA గ్రూపు మూలకాలు.
ఉదా: Mg, Ca …….(ns².)
(c) రెండు ఎలక్ట్రాన్లను గ్రహించేవి VIA గ్రూపు మూలకాలు.
ఉదా : O, S, Se…….(ns² np4)
ప్రశ్న 11.
B, C, N, F, Si ల సరైన అలోహ స్వభావ పెరుగుదల క్రమాన్ని రాయండి.
జవాబు:
ఇవ్వబడిన మూలకాలు B,C,N,F, Si.
వీటిలో అలోహ స్వభావం పెరిగే క్రమం:
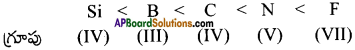
ప్రశ్న 12.
N, O, F, CI ల సరైన రసాయన చర్యాశీలత పెరుగుదల క్రమాన్ని వాటి ఆక్సీకరణ ధర్మం పరంగా రాయండి.
జవాబు:
ఆక్సీకరణ ధర్మం పరంగా రసాయన చర్య శీలత పెరుగుదల క్రమం: F > O > Cl > N.
ప్రశ్న 13.
రుణ విద్యుదాత్మకత అంటే ఏమిటి? మూలకాల స్వభావాన్ని తెలుసుకోవడానికి ఇది ఎలా ఉపయోగమవుతుంది?
జవాబు:
సమయోజనీయ బంధంతో బంధితమై ఉన్న రెండు పరమాణువులలో, ఒక పరమాణువు బంధజంట ఎలక్ట్రాన్లను తనవైపుకు ఆకర్షించుకునే స్వభావాన్ని ఋణవిద్యుదాత్మకత అంటారు.
మూలకాల లోహ ధర్మాలకి ఋణవిద్యుదాత్మకత విలోమానుపాతంలో ఉంటుంది. కావున ఋణవిద్యుదాత్మకత ద్వారా మూలకాల రసాయనబంధ స్వభావాన్ని మరియు చర్యతలను అంచనా వేయవచ్చు.
ప్రశ్న 14.
మూలకాల ఋణ విద్యుదాత్మకత, లోహ, అలోహ లక్షణాలకు సంబంధం ఏమిటి?
జవాబు:
సాధారణంగా ఋణవిద్యుదాత్మక విలువలు అలోహ స్వభావాన్ని సూచిస్తాయి.
అల్ప ఋణ విద్యుదాత్మక విలువలు అల్ప అలోహ స్వభావాన్ని మరియు అధిక లోహ స్వభావాన్ని సూచిస్తాయి. ఋణ విద్యుదాత్మకత ∝ అలోహ స్వభావం.
![]()
ప్రశ్న 15.
ద్విస్వభావిక ఆక్సైడ్ అంటే ఏమిటి? 13వ గ్రూప్ మూలకం ఏర్పరచే ద్విస్వభావిక ఆక్సైడ్ ఫార్ములాని ఇవ్వండి.
జవాబు:
ఆమ్ల, క్షార ఆక్సైడ్ స్వభావం గల ఆక్సైడ్ను ద్విస్వభావ ఆక్సైడ్ అంటారు. ఉదా: Al2O3.
13వ గ్రూపు మూలకం ఏర్పరచే ద్విస్వభావ ఆక్సైడ్. ఉదా: Al2O3.
![]()
ప్రశ్న 16.
అధిక సంఖ్యలో జతగూడని 2p ఎలక్ట్రాన్లు ఉన్న మూలకం పరమాణు సంఖ్య ఎంత?
జవాబు:
అది ఏ గ్రూప్కు చెందింది? అధిక సంఖ్యలో జతగూడని 2p ఎలక్ట్రాన్లు కలిగిన మూలకం నైట్రోజన్ పరమాణు సంఖ్య ‘7’ (Z = 7)

ప్రశ్న 17.
సోడియంకు బలమైన లోహ స్వభావం ఉంటుంది? క్లోరిన్కు బలమైన అలోహ స్వభావం ఉంటుంది. విశదీకరించండి.
లేదా
సోడియం బలమైన లోహం కాగా, క్లోరిన్ బలమైన అలోహం -ఎందుకు?
జవాబు:
‘Na’ ఒక క్షార లోహము. ఇది IA- గ్రూపు మూలకం. దీనికి ఎలక్ట్రాన్ కోల్పోయే సామర్థ్యం కలదు మరియు ఇది ధన విద్యుదాత్మకత కలిగియుండును. కావున దీనికి బలమైన లోహ స్వభావం ఏర్పడినది.
‘Cl’ ఒక హాలోజన్. ఇది VIIA- గ్రూపు మూలకం. దీనికి ఎలక్ట్రాన్ సంగ్రహించే సామర్థ్యం కలదు మరియు ఇది ఋణ విద్యుదాత్మకత కలిగియుండును. కావున దీనికి బలమైన అలోహ స్వభావం ఏర్పడినది.
ప్రశ్న 18.
శూన్య గ్రూప్ మూలకాలను ఉత్కృష్ణ లేదా తటస్థ వాయువులని ఎందుకు అంటారు?
జవాబు:
శూన్య గ్రూపు మూలకాన్ని బాహ్య ఎలక్ట్రాన్ విన్యాసం ns²np6 (He తప్ప).
ఇవి స్థిరమైన అష్టక విన్యాసం కలిగి ఉండి రసాయనికంగా జఢత్వాన్ని కలిగి ఉంటాయి. కావున వీటిని జడవాయువులు (లేదా) తటస్థ వాయువులు అంటారు.
ఈ మూలకాలు ఎలక్ట్రాన్లను కోల్పోవడం గానీ, జరగదు అందువలన వీటిన ఉత్కృష్ణ వాయువులు అంటారు.
ప్రశ్న 19.
ప్రతి జంటలో, తక్కువ అయనీకరణ శక్తి ఉన్న దానిని గుర్తించి, కారణాన్ని తెలపండి.
a. I, I– b. Br, K c. Li, Li+ d. Ba, Sr e. O, S f. Be, B g. N, O
జవాబు:
(a) I నకు I కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం:
I కన్నా I పరిమాణం ఎక్కువ మరియు తక్కువ ప్రభావశీల కేంద్రక ఆవేశం ఉంటుంది.
(b) K నకు ‘Br’ కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం:
పీరియడ్లో ఎడమ నుండి కుడికి అయనీకరణ శక్తి సాధారణంగా పెరుగుతుంది.
(c) ‘Li’ నకు Li+ కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం:
‘Li’ నకు Li+ కంటే తక్కువ ప్రభావశీల కేంద్రక ఆవేశం కలదు. (లేదా) Li యొక్క పరిమాణం Li+ కన్నా ఎక్కువ.
(d) Ba నకు ‘Sr’ కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం: గ్రూపులో పై నుండి క్రిందకు IE తగ్గును.
(e) ‘S’ నకు ‘O’ కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం:
గ్రూపులో పై నుండి క్రిందకు IE తగ్గును. (లేదా) ‘S’ పరిమాణం ‘O’ కంటే ఎక్కువ.
(f) ‘B’ నకు ‘Be’ కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం:
‘Be’ లో పూర్తిగా నిండిన ఎలక్ట్రాన్ విన్యాసం (1:22s2) ఉంటుంది.
(g) ‘O’ నకు ‘N’ కంటే తక్కువ అయనీకరణ శక్తి ఉంటుంది.
కారణం:
‘N’ లో సగం నిండిన ఎలక్ట్రాన్ విన్యాసం(1s22s22p3) ఉంటుంది.
ప్రశ్న 20.
(a) N, O (b) F, Cl జంటలో దేనికి ఎక్కువ రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది? విశదీకరించండి.?
జవాబు:
(a) ఆక్సిజన్ నైట్రోజన్ కంటే అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ కలిగి ఉంటుంది. దీనికి కారణం నైట్రోజన్లో స్థిరమైన సగం నిండిన ఎలక్ట్రాన్ విన్యాసం కలిగి ఉండును.
(b) క్లోరిన్కు ఫ్లోరిన్ కంటే అధిక రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీని కలిగి ఉంటుంది. దీనికి కారణం ‘F’ యొక్క తక్కువ పరమాణు పరిమాణం మరియు అధిక ఎలక్ట్రాన్ వికర్షణలు.
ప్రశ్న 21.
క్లోరిన్ ఎలక్ట్రాన్ అఫినిటి ఫ్లోరిన్ కంటే ఎక్కువ -విశదీకరించండి.
జవాబు:
క్లోరిన్ యొక్క ఎలక్ట్రాన్ అఫినిటి ఫ్లోరిన్ కంటే ఎక్కువ. దీనికి గల కారణం ఫ్లోరిన్ పరమాణువు క్లోరిన్ పరమాణువు కంటే చిన్నది మరియు ఫ్లోరిన్ యొక్క 2p ఉపకర్పరంలో బలమైన అంతర్ ఎలక్ట్రాన్ వికర్షణలు ఉంటాయి.
![]()
ప్రశ్న 22.
కింది ప్రతి జంటలో దేనికి ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ ఉంది?
a) F, Cl– b) O, O– c) Na+, F d) F, F–
జవాబు:
a) ‘F’ కు Cl– కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు.
b) ‘O’ కు O– కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు.
c) ‘F’ కు Na+ కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు.
d) ‘F’ కు F– కంటే ఎక్కువ ఎలక్ట్రాన్ ఎఫినిటీ కలదు.
ప్రశ్న 23.
కింది వాటిని అయానిక వ్యాసార్థ పెరుగుదల క్రమంలో అమర్చండి.
a) Cl–, P-3, S-2, F–. b) Al+3, Mg+2, Na+, O-2, F– c) Na+, Mg+2, K+
జవాబు:
a) అయానిక వ్యాసార్థ పెరుగుదల క్రమం: F– < Cl– < S-2 < P-3
b) అయానిక వ్యాసార్థ పెరుగుదల క్రమం: Al+3 < Mg+2 < Na+ < F– < O-2
c) అయానిక వ్యాసార్థ పెరుగుదల క్రమం: Mg+2 < Na+ < K+
ప్రశ్న 24.
Mg+2, O-2 రెండు ఒకే ఎలక్ట్రాన్ విన్యాసాన్ని కలిగి ఉన్నప్పటికి, పరిమాణంలో కంటే తక్కువ.
జవాబు:
Mg+2 మరియు O-2 అయాన్లు సమ ఎలక్ట్రాన్ జాతులు.
సమ ఎలక్ట్రాన్ జాతులనందు కేంద్రక ఆవేశం పెరిగే కొలది అయాన్ పరిమాణం తగ్గును. కావున Mg+2 పరిమాణం
O-2 కంటే తక్కువ.
ప్రశ్న 25.
B, Al, C, Si మూలకాలలో
a. దేనికి అత్యధిక ప్రథమ అయొనైజేషన్ ఎంథాల్పీ ఉంది?
b. దేనికి ఎక్కువ రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ ఉంది?
c. దేనికి అత్యధిక పరమాణు వ్యాసార్థం ఉంది?
d. దేనికి ఎక్కువ లోహ స్వభావం ఉంది?
జవాబు:
(a) అధిక I.E కలిగిన మూలకం కార్బన్.
(b) ఎక్కువ ఋణాత్మక గ్రాహ్య ఎంథాల్పీ కలిగిన మూలకం కార్బన్ (-122 kJ/mole).
(c) ఎక్కువ పరమాణు వ్యాసార్థం కలిగినది Al (1.43 Å).
(d) అధిక లోహ స్వభావం కలిగినది ‘Al’.
ప్రశ్న 26.
N, P, O, S మూలకాలను గమనించండి. వాటిని
a) ప్రథమ అయొనైజేషన్ ఎంథాల్పీ పెరుగుదల క్రమంలో
b) రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ పెరుగుదల క్రమంలో
c) అలోహ స్వభావం పెరిగే క్రమంలో రాయండి.
జవాబు:
a) మొదటి అయనీకరణ శక్తి పెరుగుదల క్రమం: S < P < O < N
b) రుణాత్మక ఎలక్ట్రాన్ గ్రాహ్య ఎంథాల్పీ పెరుగుదల క్రమం: N < P < O < S
c) అలోహ స్వభావం పెరుగుదల క్రమం: P < N < S < O.
ప్రశ్న 27.
ఇచ్చిన క్రమంలో అమర్చండి:
a. ఎలక్ట్రాన్ గ్రాహ్య EA పెరుగుదల : O, S, Se
b. IE1 పెరుగుదల : Na, K, Rb
c. వ్యాసార్థం పెరుగుదల : I–, I+, I
e. EA పెరుగుదల : F, Cl, Br, I
d. ఋణ విద్యుదాత్మకత పెరుగుదల: F, Cl, Br, I
f. వ్యాసార్థం పెరుగుదల: Fe, Fe+2, Fe+2.
జవాబు:
(a) ఎలక్ట్రాన్ ఎఫినిటీ పెరుగుదల క్రమం: O < Se < S
(b) IE, పెరుగుదల క్రమం : Rb < K < Na
(c) వ్యాసార్థం పెరుగుదల క్రమం : I+ < I < I–.
(d) ఋణవిద్యుదాత్మక పెరుగుదల క్రమం : I < Br < Cl < F
(e) ఎలక్ట్రాన్ ఎఫినిటీ పెరుగుదల క్రమం : I < Br < F < Cl
(f) వ్యాసార్థం పెరుగుదల క్రమం : Fe+3 < Fe+2 < Fe.
ప్రశ్న 28.
a. ఏవైనా రెండు వారధి మూలకాల పేర్లు తెలపండి.
b. కర్ణ సంబంధం చూపే ఏదైనా రెండు జంటలను తెలపండి.
c. రెండు పరివర్తన మూలకాల పేర్లు తెలపండి.
d. రెండు విరళ మృతిక మూలకాల పేర్లు తెలపండి.
e. రెండు ట్రాన్స్ యురానిక్ మూలకాల పేర్లు తెలపండి.
జవాబు:
(a) రెండవ పీరియడ్ మూలకాలను వారధి మూలకాలు అంటారు. ఉదా: బెరీలియం, బోరాన్.
(b) (i) ‘Li’ మరియు ‘Mg’ కర్ణ సంబంధాన్ని కలిగి ఉంటాయి.
(ii) ‘Be’ మరియు ‘Al కర్ణ సంబంధాన్ని కలిగి ఉంటాయి.
(c) స్కాండియం, క్రోమియం, కోబాల్ట్ మొదలగునవి పరివర్తన మూలకాలు.
(d) లాంథనైడ్లను విరళ మృత్తికలు అంటారు. ఉదా: సీరియం, ప్రసోడైమియం.
(e) నెప్ట్యూనియం, కాలిఫోర్నియం, ఫెర్మియంలు ట్రాన్స్ురోనిక్ మూలకాలకు ఉదాహరణలు.
ప్రశ్న 29.
విరళ మృత్తికా లోహాలు, ట్రాన్స్ యురానిక్ మూలకాలు అంటే ఏమిటి?
జవాబు:
లాంథనైడ్లను విరళ మృత్తికలు అంటారు. యురేనియం తరువాత వుండే f- బ్లాకు మూలకాలను ట్రాన్స్ యురేనిక్ మూలకాలు అంటారు.
ప్రశ్న 30.
సమ ఎలక్ట్రానిక్ శ్రేణులంటే ఏమిటి? కింద ఉన్న ప్రతి పరమాణువు, అయాన్లకు సంబంధించిన సమ ఎలక్ట్రానిక్ శ్రేణులను తెలపండి. (a) F– (b) Ar (c) He (d) Rb+
జవాబు:
సమానమైన సంఖ్యలో ఎలక్ట్రాన్లను కలిగి ఉండే శ్రేణులను సమ ఎలక్ట్రాన్ శ్రేణులు అంటారు.
(a) F– శ్రేణి – N-3, O-2, F–, Ne, Na+, Mg+2, A+3
(b) Ar శ్రేణి – P-3, S-2, Cl–, Ar, K+, Ca+2
(c) ‘He’ శ్రేణి – H–, He, Li+, Be+2
(d) Rb+ శ్రేణి – As-3, Se-2, Br, Kr, Rb+, Sr+2
ప్రశ్న 31.
గ్రూప్, పీరియడ్లో లోహ స్వభావంలో మార్పు పై వివరణ ఇవ్వండి.
జవాబు:
![]()
గ్రూపులో పై నుండి కిందకు ధనవిద్యుదాత్మకత పెరుగుతుంది. కావున లోహ స్వభావం కూడ పెరుగును. పీరియడ్లో ఎడమ నుండి కుడికి ఋణవిద్యుదాత్మకత పెరుగును. కావున లోహ స్వభావం తగ్గును.
![]()
ప్రశ్న 32.
ఈ క్రింది ధర్మాలు గ్రూపులో మరియు పీరియడ్లలో ఏ విధంగా మారతాయి?
a) ధన విద్యుదాత్మకత b) వేలన్సీ
జవాబు:
a) ధన విద్యుదాత్మకత :
ఒక పరమాణువు ఎలక్ట్రాన్లను వదులుకోవడానికి చూపించే సుముఖతను ధనవిద్యుదాత్మకత అని అంటారు.
i) గ్రూపులో పై నుండి క్రిందకు ధన విద్యుదాత్మకత పెరుగుతుంది.
కారణం :
గ్రూపులలో పరమాణు పరిమాణం పెరగడం వల్ల ధనవిద్యుదాత్మకత పెరుగుతుంది.,
ii) పీరియడ్లలో ఎడమ నుండి కుడికి ధనవిద్యుదాత్మకత తగ్గుతుంది.
కారణం :
పీరియడ్లో పరమాణు వ్యాసార్ధం తగ్గడం వల్ల ధనవిద్యుదాత్మకత తగ్గుతుంది.
b) వేలన్సీ:
ఒక పరమాణువు సంయోగం చెందే సామర్థ్యాన్ని “వేలన్సీ” అంటారు. హైడ్రోజన్ పరమాణువుకు వేలన్సీ “1” గా తీసుకుంటారు. మిగిలిన మూలకాలు వేలన్సీలను హైడ్రోజన్తో పోలుస్తారు.
మూలకాల వేలన్సీఅనునది ఒక ఆవర్తన ధర్మం. సున్న గ్రూపు మూలకాల వేలన్సీ సున్న.
గ్రూపులలో అన్ని మూలకాలకు వేలన్సీ సమానంగా వుంటుంది.
పీరియడ్లలో మూలకాల వేలన్సీలు 1 నుంచి 4 వరకు పెరిగి అక్కడనుండి 1 కి తగ్గును.