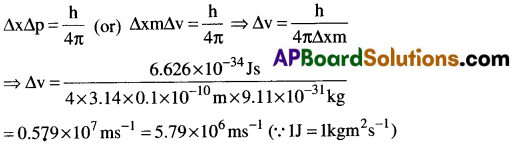Students get through AP Inter 1st Year Chemistry Important Questions 1st Lesson పరమాణు నిర్మాణం which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 1st Lesson పరమాణు నిర్మాణం
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
పరమాణు ఆర్బిటాల్ అనగానేమి?
జవాబు:
పరమాణువులో, కేంద్రకం చుట్టూ ఎలక్ట్రాన్ను కనుగొనే సంభావ్యత గరిష్టంగా (95%)గల త్రిమితీయ ప్రదేశాన్ని పరమాణు ఆర్బిటాల్ అని అంటారు.
ప్రశ్న 2.
జీమాన్ ఫలితము అనగానేమి?
జవాబు:
బలమైన అయస్కాంత క్షేత్రంలో వర్ణపట రేఖల విభజననే జీమాన్ ఫలితము అని అంటారు.
ప్రశ్న 3.
స్టార్క్ ఫలితము అనగానేమి?
జవాబు:
బలమైన విద్యుత్ క్షేత్రంలో వర్ణపట రేఖల విభజననే స్టార్క్ ఫలితము అంటారు.
ప్రశ్న 4.
పౌలీవర్జన నియమాన్ని తెలపండి.
జవాబు:
“పరమాణువులోని ఏ రెండు ఎలక్ట్రానులకు, నాలుగు క్వాంటం సంఖ్యలు సమానంగా ఉండవు”.
ప్రశ్న 5.
ఆఫ్ బౌ నియమాన్ని తెలపండి. [AP 19]
జవాబు:
పరమాణు భూస్థాయిలో ఎలక్ట్రానులు మొదటిగా అందుబాటులో వుండే కనిష్టశక్తి ఆర్బిటాల్లోకి ప్రవేశించడానికి ప్రయత్నిస్తాయి. శక్తి పెరిగే క్రమంలో ఈ ఆర్బిటాల్లు వరుసగా ఎలక్ట్రానులతో భర్తీ అవుతాయి.
![]()
ప్రశ్న 6.
హుండ్ నియమాన్ని తెలపండి. [AP 19]
జవాబు:
హుండ్ నియమం :
సమాన n, l విలువలు గల సమశక్తి ఆర్బిటాళ్ళ సమితిలో అందుబాటులో వుండే ఆర్బిటాళ్ళలో మొదటగా సమాంతర స్పిన్ గల ఒక్కొక్క ఎలక్ట్రాన్ చేరిన తరువాత మాత్రమే ఎలక్ట్రానులు జతకూడతాయి.
ప్రశ్న 7.
హైసన్బర్గ్ అనిశ్చితత్వ నియమం వివరించండి.
జవాబు:
“కేంద్రకం చుట్టూ తిరిగే ఎలక్ట్రాన్ యొక్క స్థానాన్ని కాని, ద్రవ్యవేగాన్ని కాని ఒకేసారి ఖచ్చితంగా కనుగొనుట అసాధ్యం”.
∆x.∆p ≥ h/4 π
ప్రశ్న 8.
హైసన్బర్గ్ అనిశ్చితత్వ నియమం ప్రాముఖ్యాన్ని వివరించండి.
జవాబు:
- ఈ నియమం ప్రకారం, ఎలక్ట్రాన్కు స్థిరమైన కక్ష్య వుండే అవకాశం లేదు.
- ఈ నియమం సూక్ష్మాతి సూక్ష్మ కణాలకు మాత్రమే ప్రాముఖ్యం ఇస్తుంది. స్థూల కణాలకు వర్తించదు.
ప్రశ్న 9.
హైడ్రోజన్ వర్ణపటంలో పరిశీలించిన రేఖ శ్రేణులు ఏమిటి?
జవాబు:
లైమన్, బామర్, పాషన్, బ్రాకెట్ మరియు ఫన్డ్ శ్రేణులు.
ప్రశ్న 10.
బామర్ శ్రేణి విద్యుదయస్కాంత వర్ణపటంలో ఏ ప్రాంతానికి చెందింది?
జవాబు:
బామర్ శ్రేణి (n=2) విద్యుదయస్కాంత వర్ణపటంలో దృగ్గోచర ప్రాంతానికి చెందును.
ప్రశ్న 11.
సల్ఫర్ పరమాణువులో ఎన్ని ‘p’ ఎలక్ట్రాన్లు ఉన్నాయి?
జవాబు:
సల్ఫర్ యొక్క పరమాణు సంఖ్య 16.
కావున దాని ఎలక్ట్రాన్ విన్యాసం 1s² 2s² 2p6 3s² 3p4
మొత్తం‘p’ ఎలక్ట్రాన్లు = 6 + 4 = 10.
ప్రశ్న 12.
3d ఎలక్ట్రాన్ ప్రధాన క్వాంటమ్ సంఖ్య (n), ఎజిముతల్ క్వాంటమ్ సంఖ్య (l) విలువలు ఎంత?
జవాబు:
3d-ఎలక్ట్రాన్ కు ప్రధాన క్వాంటం సంఖ్య(n) = 3 మరియు ఎజిముతల్ క్వాంటం సంఖ్య (l) = 2
![]()
ప్రశ్న 13.
ఇచ్చిన పరమాణు సంఖ్య (Z) పరమాణు ద్రవ్యరాశి (A) గల పరమాణు పూర్తి గుర్తు ఏమిటి?
(I) Z = 4, A = 9; (II) Z = 17, A = 35; (III) Z = 92, A = 233
జవాబు:
(I) 94Be.
(II) 3517Cl
(III) 23392U
ప్రశ్న 14.
136C, 168O, 2412Mg, 5626Fe, 8838Sr. కేంద్రకాలలో ఉండే న్యూట్రాన్ల, ఎలక్ట్రాన్ల సంఖ్య ఎంత?
జవాబు:
136Cలో న్యూట్రాన్ల సంఖ్య = 13 – 6 = 7; 168O = 16 – 8 =8; 1; 2412Mg = 24 – 12 = 12; 5626Fe = 56 – 26 = 30 8838Sr = 88 – 38 = 50. కేంద్రకంలో ఎలక్ట్రాన్లు ఉండవు.
ప్రశ్న 15.
పరమాణు ఆర్బిటాల్క n విలువ 2 అయిన l, ml లకు సాధ్యమైన విలువలేమి?
జవాబు:
n = 2, అయితే l = 0, 1 అప్పుడు m = 0, -1, +1 అగును.
ప్రశ్న 16.
ఇక్కడ ఇచ్చిన ఆర్బిటాల్లో ఏవి సాధ్యం? 2s, 1p, 3f, 2p.
జవాబు:
2s, 2p
ప్రశ్న 17.
ఈ కింది ఎలక్ట్రాన్ విన్యాసాలు ఏ మూలకాలకు చెందినవి?
(I) 1s² 2s² 2p6 3s² 3p¹ (II) 1s² 2s² 2p6 3s² 3p6 (III) 1s² 2s² 2p5 (IV) 1s² 2s² 2p²
జవాబు:
(I) అల్యూమినియం
(II) ఆర్గాన్
(III) ఫ్లోరిన్
(IV) కార్బన్
ప్రశ్న 18.
n = 4, ms = +1/2 తో పరమాణువులో ఉండే ఎలక్ట్రాన్ల సంఖ్య ఎంత?
జవాబు:
ms = +1/2 తొ ఉండే ఎలక్ట్రాన్ల సంఖ్య = n² = 4² = 16.
ప్రశ్న 19.
n = 5 లో ఉండే ఉపకర్పరాల సంఖ్య ఎంత?
జవాబు:
n = 5 లో ఉండే ఉపకర్పరాల సంఖ్య అయిదు (s, p, d, f, g)
![]()
ప్రశ్న 20.
కృష్ణ పదార్థం అంటే ఏమిటి?
జవాబు:
వికిరణాల శక్తిని పూర్తిగా శోషించుకునే లేదా ఉద్గారించే పదార్థాన్నే కృష్ణ పదార్థం అని అంటారు.
ఉదా : లోపలి భాగం ప్లాటినం బ్లాక్తో పూయబడి, చిన్న రంధ్రంతో ఉన్న బోలు గోళం కృష్ణ వస్తువుగా పనిచేస్తుంది.
ప్రశ్న 21.
హైడ్రోజన్ పరమాణువులో ఎలక్ట్రాన్ n = 4 కక్ష్య నుంచి n = 5 కక్ష్యకు మార్పు చెందినప్పుడు గ్రహించిన కాంతిరేఖ వర్ణపట శ్రేణిలో దేనికి చెందుతుంది.
జవాబు:
తగినంత శక్తిని గ్రహించిన ఎలక్ట్రాన్ n = 4 కక్ష్య నుంచి n = 5 కక్ష్యకు మార్పు చెందును.
అప్పుడు n = 5 కక్ష్యలో ఉన్న ఎలక్ట్రాన్ తిరిగి n = 4 కక్ష్యలోకి దూకినప్పుడు శక్తి విడుదలగును.
అప్పుడు ఏర్పడే వర్ణపటం పరారుణ ప్రాంతంలోని బ్రాకెట్ శ్రేణికి చెందును.
ప్రశ్న 22.
కింద ఇచ్చిన వికిరణాలు పౌనఃపున్యాలు పెరిగే క్రమంలో ఏర్పరచండి (a) X-కిరణాలు (b) దృగ్గోచర వికిరణాలు (c) సూక్ష్మతరంగ వికిరణాలు (d) రేడియో తరంగ వికిరణాలు
జవాబు:
పౌనఃపున్యాలు పెరిగే క్రమం:
రేడియో తరంగ వికిరణాలు < సూక్ష్మతరంగ వికిరణాలు < దృగ్గోచర వికిరణాలు < X-కిరణాలు
ప్రశ్న 23.
విద్యుదయస్కాంత వికిరణాల కణస్వభావాన్ని వివరించండి.
జవాబు:
ప్లాంకా క్వాంటం సిద్ధాంతం ప్రకారం ఎలక్ట్రాన్ల యొక్క కణస్వభావం ద్వారా కృష్ణవస్తువు వికిరణము, కాంతి విద్యుత్ ఫలితము మరియు హైడ్రోజన్ యొక్క వర్ణపటములను వివరించవచ్చును.
![]()
ప్రశ్న 24.
(i) dz² ఆర్బిటాల్ (ii) dx²-y² ఆర్బిటాల్ ల ఆకారాల్ని గీయండి.
జవాబు:

Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
కక్ష్య (ఆర్బిట్)కు, ఆర్బిటాలు గల భేదాన్ని వివరించండి.
జవాబు:
| ఆర్బిట్ | ఆర్బిటాల్ |
| 1. ఇది కేంద్రకం చుట్టూ ఎలక్ట్రాన్ తిరిగే నిర్దిష్ట వృత్తాకార మార్గం. | 1. ఇది కేంద్రకం చుట్టూ ఎలక్ట్రాన్ అత్యధికంగా ఉండే ప్రాంతము. |
| 2. ఎలక్ట్రాన్ ఒక తలములో తిరిగే మార్గాన్ని ఇది సూచించును. | 2. ఇది కేంద్రకం చుట్టూ గల త్రిపరిమాణ అంతరళాములో ఎలక్ట్రాన్ పరిభ్రమించు ప్రదేశము. |
| 3. ‘n’వ ఆర్బిట్ లో ఉండే గరిష్ట ఎలక్ట్రాన్ల సంఖ్య 2n². | 3. ఒక ఆర్బిటాల్లో రెండు కంటే ఎక్కువ ఎలక్ట్రాన్లు ఉండలేవు. |
| 4. ఆర్బిట్లు వృత్తాకారములో ఉండును. | 4. ఆర్బిటాల్లు వివిధ ఆకారాలలో ఉండును. ‘ s-ఆర్బిటాల్ గోళాకారములో, p-ఆర్బిటాల్ డంబెల్ ఆకారములో ఉండును. |
| 5. ఆర్బిట్లకు దిశా ధర్మం ఉండదు. కావున పరమాణు ఆకృతులను ఇవి తెలియజేయలేవు. | 5. s- ఆర్బిటాల్క తప్ప మిగిలిన వాటికి దిశా ధర్మము కలదు. కావున ఇవి పరమాణు ఆకృతులను తెలియచేయును. |
| 6. ఆర్బిట్ యొక్క భావన హైసెన్బర్గ్ సూత్రమునకు విరుద్ధముగా ఉండును. | 6. ఆర్బిటాల్ భావన హైసెన్బర్గ్ సూత్రమునకు అనుగుణంగా ఉండును. |
![]()
ప్రశ్న 2.
శోషణ, ఉద్గార వర్ణపటాల మధ్య తేడాలను వివరించండి. [TS 22][AP 15]
జవాబు:
| ఉద్గార వర్ణపటం | శోషణ వర్ణపటం |
| 1. వికిరణ శక్తి ఉద్గారం చెందడం వల్ల ఈ వర్ణపటం ఏర్పడుతుంది. | 1. వికిరణ శక్తి అధిశోషణం చెందడం ఈ వర్ణపటం ఏర్పడుతుంది. |
| 2. ఎలక్ట్రానులు క్రింది శక్తి స్థాయి నుండి పై శక్తి స్థాయికి దూకినపుడు ఈ వర్ణపటం ఏర్పడుతుంది. | 2. ఎలక్ట్రానులు పై శక్తి స్థాయి నుండి క్రింది శక్తి స్థాయికి దూకినపుడు, ఈ వర్ణపటం ఏర్పడుతుంది. |
| 3.ఇదినల్లని ప్రదేశంపై ప్రకాశవంతమైన గీతలతో ఉండును. | 3. ఇది తెల్లటి ప్రదేశంపై నల్లని గీతలతో ఉండును. |
ప్రశ్న 3.
ఐన్స్టీన్ సిద్ధాంతమునుపయోగించి కాంతి విద్యుత్ ప్రభావాన్ని వివరించండి.
జవాబు:
ప్లాంక్స్ క్వాంటమ్ సిద్ధాంతమునుపయోగించి కాంతి విద్యుత్ ప్రభావాన్ని ఐన్స్టీన్ వివరించగలిగినాడు. శోషించబడే లేదా విడుదలయ్యే శక్తి, ఫోటాన్స్ అనే కాంతి కణాల రూపంలో ఉంటుంది. ఫోటాన్ రూపంలో ఉన్న కణాలు ఉద్రేక స్థితి నుండి భూస్థాయిలోకి దూకినపుడు శక్తి విడుదలవుతుంది. ఆ శక్తి భేదము క్వాంటమ్ యొక్క శక్తి అవుతుంది. కావున ∆E = E2 – E1 = h ν ఒక ఫోటాన్ క్షారలోహ ఉపరితలాన్ని ఢీ కొన్నపుడు, ఆ ఫోటాన్ యొక్క శక్తి ఆ లోహములోని ఎలక్ట్రాన్ ద్వారా గ్రహించబడుతుంది. ఆ శక్తిలో కొంత భాగం ఎలక్ట్రానన్ను లోహం ఆకర్షణ బలాల నుండి విడుదల చేస్తుంది. ఫోటాన్ శక్తిలోని మిగిలిన భాగం, విడుదలైన ఎలక్ట్రాన్ గతిజశక్తిగా మారుతుంది.
కావున hν = w+ KE = hν0 + \(\frac{1}{2}\) m0V²
ఇక్కడ W అనునది ‘పని ప్రమేయము’. ఇది లోహంలో ఎలక్ట్రానుల మీద గల ఆకర్షణ బలాలను అధిగమించే శక్తి.
ప్రశ్న 4.
హైడ్రోజన్ పరమాణువు బోర్ కక్ష్యలో తిరుగుతున్న ఎలక్ట్రాన్ కక్ష్య చుట్టుకొలత డీబ్రోలీ తరంగదైర్ఘ్యానికి పూర్ణాంక గుణిజంగా ఉంటుందని చూపించండి.
జవాబు:
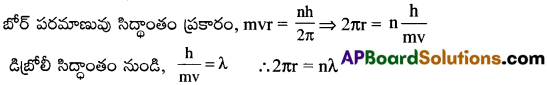
కావున ఎలక్ట్రాన్ కక్ష్య చుట్టు కొలత డిబ్రోలీ తరంగదైర్ఘ్యం (1)నకు పూర్ణాంక గుణిజంగా ఉండును.
ప్రశ్న 5.
“నోడల్ తలం” అంటే ఏమిటి ? 2p, 3d ఆర్బిటాల్లలో ఎన్ని నోడల్ తలాలుంటాయి?
జవాబు:
ఎలక్ట్రాన్ కనుగొనే సంభావ్యత శూన్యంగా గల ప్రదేశాన్ని “నోడల్ తలము” అని అంటారు.
ఆర్బిటాల్లోని నోడల్ తలాల సంఖ్య, అజిముతల్ క్వాంటం సంఖ్య l కు సమానము.
‘S’ ఆర్బిటాల్కు నోడల్ తలాల సంఖ్య = 0
‘p’ ఆర్బిటాల్కు నోడల్ తలాల సంఖ్య = 1
‘d’ ఆర్బిటాల్కు నోడల్ తలాల సంఖ్య = 2
ప్రశ్న 6.
ఒక మూలకపు పరమాణువులో 29 ఎలక్ట్రాన్లు, 35 న్యూట్రాన్లు ఉన్నాయి. (i) ప్రోటాన్ సంఖ్యను (ii) మూలకం ఎలక్ట్రాన్ విన్యాసాన్ని రాబట్టండి.
జవాబు:
(i) మూలకం = x: ఎలక్ట్రాన్ల సంఖ్య = 29; న్యూట్రాన్ల సంఖ్య = 35; ప్రోటాన్ల సంఖ్య =?
‘x’ అనే మూలకం తటస్థం కావున ఎలక్ట్రాన్ల సంఖ్య = ప్రోటాన్ల సంఖ్య.
∴ ప్రోటాన్ల సంఖ్య = 29
(ii) Z = 29 కావున ఆ మూలకం Cu: Cu ఎలక్ట్రాన్ విన్యాసం → 1s²2s²2p63s²3p64s¹3d10
ప్రశ్న 7.
ఈ కింది క్వాంటమ్ సంఖ్యల సమితులు అసాధ్యమైనవేవి? కారణాలతో వివరించండి.
(a) n = 0, l = 0, ml = 0, ms = +1/2
(b) n = 1, l = 0, ml = 0, ms = −1/2
(c) n = 1, l = 1, ml = 0, ms = +1/2
(d) n = 2, l = 1, ml = 0, ms = +1/2
(e) n = 3, l = 3, ml = -3, ms = +1/2
(f) n = 3, l = 1, ml = 0, ms = +1/2
జవాబు:
ఈ క్రింది క్వాంటం సంఖ్యలు సాధ్యం కావు.
(a) n = 0, 1 = 0, ml = 0, ms = +1/2
కారణం:
‘n’ అనునది ప్రధాన క్వాంటం సంఖ్య దీని విలువలు 1 నుండి n వరకు ఉండును. కావున n విలువ సున్నా అగుట అసాధ్యం.
(c) n = 1, l = 1, ml = 0, ms = +1/2
కారణం:
‘l’ విలువలు 0 నుండి (n-1) వరకు ఉండును. కాని n = 1 అయినప్పుడు ‘l’ విలువ సున్నా అగును. కావున అది ఒకటికి సమానం కాదు.
(e) n = 3, l = 3, ml = -3, ms = +1/2
కారణం:
n = 3 అయినప్పుడు ‘7’ కు సాధ్యమగు విలువలు 0,1,2. కావున ‘l’ విలువ 3కు సమానం కాదు.
![]()
ప్రశ్న 8.
బోర్ పరమాణు నమూనాలోని లోపాలు ఏమిటి? [Mar’13][AP 15,18]
జవాబు:
బోర్ లోపాలు:
- బోర్ నమూనా హైడ్రోజన్ పరమాణువు యొక్క ‘సూక్ష్మ వర్ణపటాన్ని’ వివరించలేకపోయింది.
- బోర్ నమూనా He, Li, Be వంటి బహు ఎలక్ట్రాన్ పరమాణువుల వర్ణపటాలను వివరించలేకపోయింది.
- బోర్ నమూనా జీమన్ ఫలితము (అయస్కాంత క్షేత్రంలో వర్ణపట రేఖల విభజన) ను వివరించలేకపోయింది.
- బోర్ నమూనా స్టార్క్ ఫలితము (విద్యుత్ క్షేత్రంలో వర్ణపట రేఖల విభజన) ను వివరించలేకపోయింది.
- రసాయన బంధాల ద్వారా అణువులను ఏర్పరిచే పరమాణువుల సామర్థ్యాన్ని బోర్ నమూనా వివరించలేదు.
- బోర్ నమూనా డీ-బ్రోగ్లీ వివరించిన ఎలక్ట్రాన్ ద్వంద్వ స్వభావాన్ని వివరించలేకపోయింది.
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
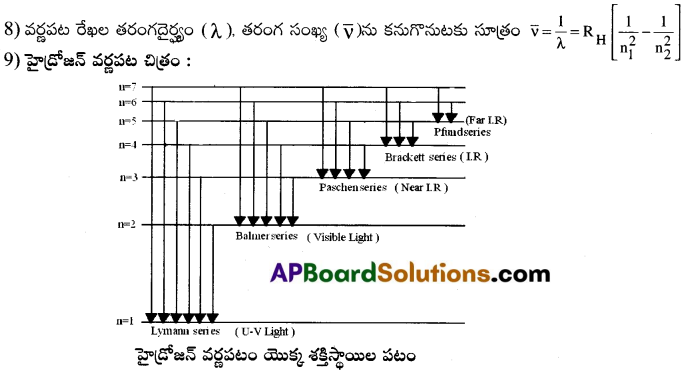
హైడ్రోజన్ బోర్ పరమాణు నమూనాలోని ముఖ్యమైన ప్రతిపాదనలు తెలపండి. ఈ నమూనా హైడ్రోజన్ వర్ణపటంలోని వివిధ రేఖలను ఎలా వివరిస్తుందో తెలియచేయండి. హైడ్రోజన్ వర్ణపటం యొక్క నమూనా చిత్రం గీయండి. [AP 17,18,19,20,22][TS 16,17,18,20,22]
జవాబు:
హైడ్రోజన్ బోర్ పరమాణు నమూనాలోని ముఖ్యమైన ప్రతిపాదనలు:
(a) కక్ష్యలు :
- హైడ్రోజన్ పరమాణువులోని ఎలక్ట్రాన్ కేంద్రకం నుండి స్థిర వ్యాసార్థాలుగల వృత్తాకార మార్గాలలో నిర్ణీత శక్తులతో తిరుగుతూ ఉండును. ఈ వృత్తాకార మార్గాల్నే కక్ష్యలు (ఆర్బిట్లు) లేదా స్థిర శక్తి స్థాయి అంటారు. ఈ కక్ష్యలు కేంద్రకం చుట్టూ ఏకకేంద్రక వృత్తాలుగా వ్యాపించి ఉంటాయి.
- ఈ కక్ష్యలను 1,2,3,4 …… సంఖ్యలతో సూచిస్తారు. వీటిని ప్రధాన క్వాంటం సంఖ్యలు (n) అంటారు. n విలువ పెరిగిన కొద్దీ కక్ష్య యొక్క శక్తి మరియు పరిమాణము పెరుగును.
(b) కక్ష్యలోని ఎలక్ట్రాన్ యొక్క శక్తి :
- ఎలక్ట్రానులు కక్ష్యలో తిరుగుతున్నంతసేపు దాని శక్తి స్థిరం. అది శక్తిని కోల్పోవడం కాని, శోషించుకోవడం కాని జరుగదు. అందుకే వీటిని “స్థిర కక్ష్యలు” లేదా “స్థిరశక్తిస్థాయిలు” అంటారు.
- శక్తిని గ్రహించుకున్న ఎలక్ట్రాన్, అది ఉన్న శక్తి స్థాయి నుండి అధిక శక్తి స్థాయికి దూకుతుంది.
- అధిక శక్తి స్థాయి గల కక్ష్యలకు శక్తి ఎక్కువగాను మరియు స్థిరత్వము తక్కువగాను ఉంటుంది.
- అధిక శక్తి స్థాయి గల కక్ష్య నుండి అల్ప శక్తి స్థాయి గల కక్ష్యకు ఎలక్ట్రాన్ దూకినపుడు శక్తి, ఫోటాన్ రూపంలో విడుదలగును.
- శక్తి ఇలా ఫోటాన్లుగా పరివర్తన చెందినపుడు రేఖీయ వర్ణపటం ఏర్పడుతుంది.
- “శక్తి మార్పు” మాత్రం అవిరళంగా మార్పు చెందదు.
(c) వికిరణం యొక్క పౌనఃపున్యం:
దిగువ శక్తి స్థాయిలో ఉన్న ఒక ఎలక్ట్రాన్ యొక్క శక్తి E1 మరియు ఎగువ శక్తి స్థాయిలో ఉన్నప్పుడు E2 అయితే వాటి శక్తి తేడా ∆E = E2 – E1 = h ν. ఇక్కడ, h అనేది ప్లాంక్ స్థిరాంకం, ν అనునది పౌనఃపున్యం.
![]()
(d) ఎలక్ట్రాన్ యొక్క కోణీయ ద్రవ్యవేగం :
తిరుగుతున్న ఎలక్ట్రాన్ యొక్క కోణీయ ద్రవ్యవేగం (mvr), \(\frac{h}{2 \pi}\)నకు క్వాంటీకరణము చెందును.
కావున, mvr = n × \(\frac{h}{2 \pi}\)
ఇక్కడ, m = ఎలక్ట్రాన్ ద్రవ్యరాశి, V = రేఖీయ వేగం, r = ఆర్బిట్ వ్యాసార్థం
h = ప్లాంక్ స్థిరాంకం, n = సరళ పూర్ణాంకం 1,2,3…..
హైడ్రోజన్ వర్ణపటం – బోర్ వివరణ:
- హైడ్రోజన్ వాయువు ద్వారా ‘విద్యుదుత్సర్గాన్ని పంపినప్పుడు, హైడ్రోజన్ పరమాణువులలోని ఎలక్ట్రానులు వివిధ పరిమాణాలలో శక్తిని శోషించుకొనును.
- అప్పుడు అవి అధిక శక్తి స్థాయిలలోనికి ప్రవేశించును.
- అధిక శక్తి స్థాయిలలో, శక్తి ఎక్కువ కాని స్థిరత్వం తక్కువ.
- కావున, ఉద్రిక్త ఎలక్ట్రానులు తిరిగి అల్పశక్తి స్థాయి కక్ష్యలోకి పడిపోతాయి.
- ఇది ఒకే దశలో (లేదా) అనేక దశలలో జరగవచ్చును.
- ఇలా విడుదలైన శక్తి, వర్ణపట రేఖల రూపంలో హైడ్రోజన్ వర్ణపటంగా కనిపిస్తుంది.
- అధిక శక్తి స్థాయి నుండి ఎలక్ట్రాను
(i) n = 1 వ కక్ష్యలోకి. దూకినపుడు UV కిరణాలు వెలువడును. ఈ శ్రేణినే ‘లైమన్ శ్రేణి’ అంటారు.
(ii) n = 2 వ కక్ష్యలోకి దూకినపుడు దృగ్గోచర కిరణాలు వెలువడును. ఈ శ్రేణినే ‘బామర్ శ్రేణి’ అంటారు.
(iii) n = 3,4,5 కక్ష్యలోకి దూకినపుడు పరారుణ కిరణాలు వెలువడును. ఈ శ్రేణులను వరుసగా ‘ఫ్యాషన్, బ్రాకెట్, ఫండ్ శ్రేణులు’ అంటారు.
ప్రశ్న 2.
శోషణ, ఉద్గార వర్ణపటాలను వివరించండి. హైడ్రోజన్ పరమాణువులో రేఖా వర్ణపటాల సాధారణ వర్ణన పై చర్చించండి.
జవాబు:
ఉద్గార వర్ణపటం:
- వికిరణ శక్తి క్వాంటాలుగా ఉద్గారం చెందడం వలన ఈ వర్ణ పటం ఏర్పడుతుంది.
- ఎలక్ట్రాన్లు పై శక్తి స్థాయి నుండి క్రింది శక్తి స్థాయికి దూకినప్పుడు ఈ వర్ణ పటం ఏర్పడుతుంది.
- ఇది నల్లని ప్రదేశం పై ప్రకాశవంతమైన గీతలతో ఉండును.
శోషణ వర్ణపటం:
- వికిరణ శక్తి అధిశోషణం చెందడం వలన ఈ వర్ణపటం ఏర్పడుతుంది.
- ఎలక్ట్రాన్లు క్రింది శక్తి స్థాయి నుండి పై శక్తి స్థాయికి దూకినప్పుడు ఈ వర్ణ పటం ఏర్పడుతుంది.
- ఇది తెల్లని ప్రదేశం పై నల్లని గీతలతో ఉండును.
హైడ్రోజన్ వర్ణపటం:
హైడ్రోజన్ వాయువు ద్వారా అత్యల్ప పీడనం వద్ద విద్యుదుత్సర్గాన్ని పంపినప్పుడు, ప్రకాశవంతమైన కాంతి హైడ్రోజన్ పరమాణువుల నుంచి వెలువడును.
ఈ కాంతిని పట్టకము గుండా పంపించినప్పుడు విభిన్న సన్నని రేఖలతో కూడిన విచ్ఛిన్న వర్ణపటం ఏర్పడినది. దీనినే హైడ్రోజన్ ఉద్గార వర్ణపటం అని అంటారు.
అధిక శక్తి స్థాయి నుండి ఎలక్ట్రాను
(i) n = 1 వ కక్ష్యలోకి దూకినపుడు UV కిరణాలు వెలువడును. ఈ శ్రేణినే ‘లైమన్ శ్రేణి’ అంటారు.
(ii) n = 2 వ కక్ష్యలోకి దూకినపుడు దృగ్గోచర కిరణాలు వెలువడును. ఈ శ్రేణినే ‘బామర్ శ్రేణి’ అంటారు.
(iii) n = 3,4,5 కక్ష్యలోకి దూకినపుడు పరారుణ కిరణాలు వెలువడును. ఈ శ్రేణులను వరుసగా ‘ఫ్యాషన్, బ్రాకెట్, ఫండ్ శ్రేణులు’ అంటారు.
హైడ్రోజన్ వర్ణపటం యొక్క శక్తిస్థాయిల పటం పైన చూపబడినది.
![]()
ప్రశ్న 3.
హైడ్రోజన్ పరమాణువు బోర్ సిద్ధాంత విజయాలను వివరించండి.
జవాబు:
హైడ్రోజన్ పరమాణువు బోర్ సిద్ధాంత విజయాలు:
1. పరమాణు నిర్మాణము
1) బోర్ సిద్ధాంతం ప్రధాన క్వాంటమ్ సంఖ్యలను ప్రతిపాదించెను:
కేంద్రకం చుట్టూ తిరిగే ఎలక్ట్రాన్ యొక్క శక్తి స్థాయిలను n = 1,2,3…..అనే ప్రధాన క్వాంటం సంఖ్యలతో సూచిస్తారు.
2) బోర్ సిద్ధాంతం పరమాణువు యొక్క స్థిరత్వాన్ని వివరించగలిగింది:
బోర్ సిద్ధాంతం ప్రకారం ఒక నిర్ణీత కక్ష్యలో తిరిగే ఎలక్ట్రాన్ శక్తిని కోల్పోవడం జరగదు. అందువల్ల అది కేంద్రకంలోకి పడిపోదు. కావున పరమాణువు స్థిరంగా ఉంటుంది.
3) బోర్ సిద్ధాంతం హైడ్రోజన్ పరమాణు వర్ణ పటాన్ని వివరించింది:
హైడ్రోజన్ వర్ణపటంలోని విభిన్న రేఖలుశక్తి యొక్క ఉద్గారం క్వాంటాలుగా వికిరణం చెందటం వలన ఏర్పడెను. ఉద్రిక్త ఎలక్ట్రాన్ అధిక శక్తి స్థాయి నుండి తక్కువ శక్తి స్థాయికి దూకినప్పుడు ఇది ఏర్పడును.
4) వికిరణం యొక్క పౌనఃపున్యం:
దిగువ శక్తి స్థాయిలో ఉన్న ఒక ఎలక్ట్రాన్ యొక్క శక్తి E, మరియు ఎగువ శక్తి స్థాయిలో ఉన్నప్పుడు E, అయితే వాటి శక్తి తేడా ∆E = E2 – E1 =.h ν. ఇక్కడ h అనేది ప్లాంక్ స్థిరాంకం, ν అనునది పౌనఃపున్యం.
కావున వికిరణం యొక్క పౌనఃపున్యం ν = \(\frac{\Delta E}{h}=\frac{E_2-E_1}{h}\) -(దీనినే బోర్ పౌనఃపున్యం నియమం అంటారు)
ప్రయోగాత్మకంగా కనుగొన్న పౌనఃపున్యం విలువలు బోర్ సిద్ధాంతం ద్వారా లెక్కించిన పౌనఃపున్య విలువలతో చక్కగా ఏకీభవించినవి.
5) బోర్ సిద్ధాంతం లోని rn = 0.529 × n² Å అనే సూత్ర సహాయంతో హైడ్రోజన్ పరమాణువు లోని ‘n’వ కక్ష్యా వ్యాసార్థాన్ని లెక్కించవచ్చును.
పై సూత్రము ద్వారా ‘n’ విలువ పెరిగిన కొద్ది”r’ విలువ పెరుగునని తెలియచున్నది.
n = 1 అయినప్పుడు ఏర్పడే మొదటి శక్తి స్థాయిని ‘బోర్ ఆర్బిట్’ అని పిలుస్తారు.
6) బోర్ సిద్ధాంతంలోని En = -RH(\(\frac{1}{n^2}\)) , n = 1, 2, 3….(or) En = \(\frac{13.6}{n^2}\) eV / atom అనే సూత్ర
సహాయంతో హైడ్రోజన్ పరమాణువులోని n వ కక్ష్యలో తిరిగే ఎలక్ట్రాన్ శక్తిని కనుగొనవచ్చును.
ఇందులో RH అనునది రిడ్బర్గ్ స్థిరాంకం దీని విలువ 2.178 × 10-18J
పై సూత్ర సహాయంతోనే హైడ్రోజన్ వర్ణపటం యొక్క శక్తిస్థాయి పటాన్ని రూపొందించారు.
ఎలక్ట్రాన్ పై కేంద్రక ప్రభావం లేనప్పుడు దాని శక్తిని ‘సున్నా’గా పరిగణిస్తారు. ఈ సందర్భంలో ‘n’ కు ‘∞’ విలువను ఆపాదించారు.
ఎప్పుడైతే ఎలక్ట్రాన్ కేంద్రకంచే ఆకర్షించబడి, ‘n’ కక్ష్యలో ఉండినట్లైతే శక్తి ఉద్గారం అవుతుంది. అందువల్ల ఎలక్ట్రాన్ శక్తి తగ్గుతుంది. దీని వలననే పై సమీకరణంనకు ఋణగుర్తు ఇవ్వబడినది.
7) బోర్ సిద్ధాంతమును ఉపయోగించి వివిధ కక్ష్యలలో తిరుగు ఎలక్ట్రాన్ యొక్క రేఖీయ వేగాన్ని గణించవచ్చు.
8) బోర్ సిద్ధాంతమును ఉపయోగించి ఎలక్ట్రాన్ కోణీయ ద్రవ్యవేగంను కనుగొనవచ్చు.
9) బోర్ సిద్ధాంతమును హైడ్రోజన్ పరమాణువు వలె ఒక ఎలక్ట్రాన్ మాత్రమే ఉన్న He+, Li2+, Be3+వంటి అయాన్లకు కూడా వర్తింపచేయవచ్చు.
ప్రశ్న 4.
n, l మరియు ml క్వాంటమ్ సంఖ్యలు ఎలా వచ్చాయి? వాటి ప్రాముఖ్యాన్ని వివరించండి. [ IPE ’04, 06,10, 10, 14][TS 15,17,18,19][AP,TS 16,17]
జవాబు:
క్వాంటమ్ సంఖ్యలు n, l, ml మరియు s లు
i) కేంద్రకం చుట్టూ ఉన్న ప్రదేశంలో ఎలక్ట్రాన్ యొక్క స్థానాన్ని వివరిస్తాయి.
ii) వివిధ శక్తి స్థాయిలను వాటి యొక్క పరిమాణము, ఆకారము మరియు భ్రమణములను వివరిస్తాయి.
ఇవి ప్రోడింగర్ సమీకరణంను సాధించినప్పుడు వచ్చినవి.
1. ప్రధాన క్వాంటం సంఖ్య (n) :
i) దీనిని “బోర్” ప్రతిపాదించాడు.
ii) దీనిని ‘n’ చే సూచిస్తారు.
iii) n విలువలు 1,2,3,4….. వీటికి అనురూపంగా ఉండే కర్పరాలు K,L,M,N…..
ప్రాముఖ్యత : n విలువ సూచించే అంశాలు
i) కక్ష్య యొక్క పరిమాణము (rn)
ii) కక్ష్య యొక్క శక్తి (En)
n వ కక్ష్యలోని గరిష్ట ఎలక్ట్రానుల సంఖ్య = 2n²
2. అజిముతల్ క్వాంటం సంఖ్య :
i) దీనిని సోమర్ ఫీల్డ్ ప్రతిపాదించాడు. ii) దీనిని ‘7’ తో సూచిస్తారు.
iii) l విలువలు 0,1,2,….,(n−1).
ప్రాముఖ్యత : l విలువ సూచించే అంశాలు
i) ఉపకర్పరం యొక్క ఆకృతి
ii) ఎలక్ట్రాన్ కోణీయ ద్రవ్యవేగం
s, p, d, f ఉపకర్పరాల యొక్క / విలువలు 0,1,2,3.
ఆర్బిటాల్ ల ఆకృతులు: S-ఆర్బిటాల్ ఆకృతి గోళాకారం, p-ఆర్బిటాల్ ఆకృతి డంబెల్, d-ఆర్బిటాల్ ఆకృతి డబల్ – డంబెల్, f- ఆర్బిటాల్ ఆకృతి నాలుగు ముడతల డంబెల్.
3. అయస్కాంత క్వాంటం సంఖ్య :
i) దీనిని ‘లాండే’ ప్రతిపాదించారు.
ii) దీనిని ‘m’ (లేదా) ml తో సూచిస్తారు.
iii) m విలువలు ‘-l’ నుంచి ‘l’ వరకు ‘0’ తో సహా వుంటాయి.
ఇచ్చిన l విలువకు ఉండే మొత్తం m విలువల సంఖ్య = 2l + 1
ప్రాముఖ్యత : m విలువ, ఆర్బిటాల్ స్థాన నిర్దేశకతను తెలుపుతుంది. ఇది జీమన్ ఫలితాన్ని వివరిస్తుంది.
4. స్పిన్ క్వాంటం సంఖ్య :
i) దీనిని ఉలెన్బెక్ మరియు గౌడ్ స్మిత్లు ప్రతిపాదించారు.
ii) దీనిని ‘s’ తో సూచిస్తారు.
iii) ‘s’ విలువలు + మరియు +\(\frac{1}{2}\) మరియు –\(\frac{1}{2}\) సూచిస్తారు.
ప్రాముఖ్యత: ఈ కాంటం సంఖ్య ఎలక్ట్రాన్ యొక్క భ్రమణం (సవ్యదిశ (లేక) అపసవ్యదిశ) ను వివరిస్తుంది.
![]()
ప్రశ్న 5.
పరమాణు ఆర్బిటాల్ను నిర్వచించండి. s, p,d ఆర్బిటాల్ల ఆకారాలను పటాల ద్వారా వివరించండి.
జవాబు:
పరమాణు ఆర్బిటాల్ను త్రిమితీయ ప్రదేశంలో నిర్వచిస్తారు. కేంద్రకం చుట్టూ ఎలక్ట్రాన్ ను కనుగొనే సంభావ్యత గరిష్టంగా (95%)గల త్రిమితీయ ప్రదేశాన్ని “పరమాణు ఆర్బిటాల్” గా నిర్వచిస్తారు.
ప్రోడింగర్ తరంగ సమీకరణంలో, ఆర్బిటాల్ యొక్క ఆకృతులు “కోణీయ సంభావ్యతా వక్రాలు”గా వుంటాయి.
I. S–ఆర్బిటాల్ ఆకృతి :
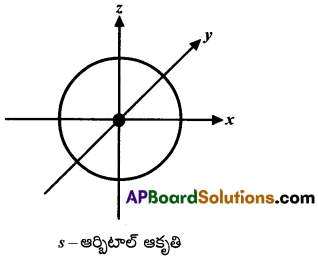
- S–ఆర్బిటాల్ ఆకృతి గోళాకారం
- n విలువలు పెరిగినకొద్దీ, ఆర్బిటాల్ యొక్క పరిమాణం పెరుగును. కావున 1s < 2s < 3s <…..
- S-ఆర్బిటాలు ఎటువంటి దిశాధర్మం ఉండదు.
- S-ఆర్బిటాల్కు నోడల్ తలాల సంఖ్య ‘సున్న’. కావున l = 0.
- S-ఆర్బిటాల్కు ఉండే క్వాంటం సంఖ్యలు n = 1,2,3 ….; 1 = 0, m = 0.
II. p – ఆర్బిటాల్ ఆకృతి :
- p- ఆర్బిటాల్ ఆకృతి డంబెల్. ఇది రెండు లోక్లను కలిగి వుంటుంది.
- p-ఉపకర్పరం 3 ఉప – ఆర్బిటాళ్లను కలిగి వుంటుంది. అవి px, py, pz అనే సమశక్తి ఆర్బిటాళ్లు.
- ఈ మూడు ఉప – ఆర్బిటాల్లు ఒకదానికొకటి లంబంగా వుంటాయి.
- ప్రతి p-ఆర్బిటాల్కు ఒక నోడల్ తలం ఉంటుంది. కావున l = 1.
- p-ఆర్బిటాల్క ఉండే క్వాంటం సంఖ్యలు n = 2, 3, 4….; l = 1; m = -1,0,1.
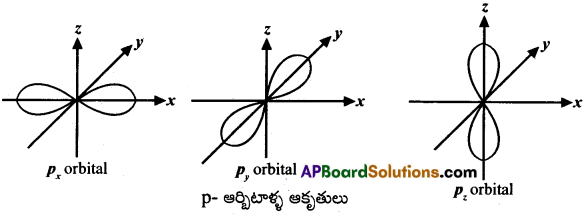
III. d- ఆర్బిటాల్ ఆకృతి :
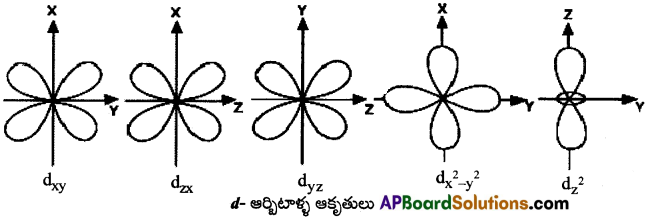
- d-ఆర్బిటాల్ డబుల్-డంబెల్ ఆకృతిని కలిగి వుంటుంది. ఇది 4 లోబ్లను కలిగిఉంటుంది.
- d-ఉపకర్పరం 5 ఉప-ఆర్బిటాల్లను కలిగి వుంటుంది. అవి dxy, dyz, dzx, dz², dx²-y².
- ఇందులో మొదటి మూడు ఆర్బిటాల్ల ఆకృతులు ఒకే విధంగా వుంటాయి.
వాటి లోబ్ లు వాటి అక్షాల మధ్యలో వుంటాయి. - ప్రతి d-ఆర్బిటాల్ 2 నోడల్ తలాలను కలిగి వుంటుంది. కావున l = 2.
- d-ఆర్బిటాల్కు ఉండే క్వాంటం సంఖ్యలు n = 3, 4, 5….; l = 2; m = −2, −1, 0, 1, 2.
ప్రశ్న 6.
రూథర్ ఫర్డ్ పరమాణువు కేంద్రక నమూనాను వివరించండి. దానిలోని లోపాలు ఏమిటి?
జవాబు:
రూధర్ఫర్డ్ “α – కిరణ ప్రక్షేపక ప్రయోగం” ద్వారా పరమాణు నమూనాని ప్రతిపాదించెను. ఈ ప్రయోగం ద్వారా రూధర్ ఫర్డ్ ఈ క్రింది అంశాలను పేర్కొన్నాడు.
పరిశీలన 1 : చాలా వరకు కణాలు అపవర్తనం చెందకుండానే బంగారురేకు నుంచి వెళ్ళిపోయాయి.
వివరణ : పరమాణువులో ఎక్కువ ప్రదేశం ఖాళీగానే వుంటుంది.
పరిశీలన 2 : తక్కువ భాగం α – కణాలు కొద్ది కోణంలో అపవర్తనం చెందాయి.
వివరణ : పరమాణువులోని ధనావేశం థామ్సన్ ఊహించిన విధంగా పరమాణువు అంతా వ్యాపించి వుండదు.
పరిశీలన 3 : అత్యల్ప భాగం α – కణాలు, 180° కోణంలో అపవర్తనం చెంది వెనుతిరిగినవి.
వివరణ : పరమాణువులో ధనావేశం చాలా కొద్ది ఘనపరిమాణంలో కేంద్రీకృతమై వుంటుంది.
రూధర్ ఫర్డ్ గ్రహమండల పరమాణు నమూనా :
- పరమాణువులో ధనావేశం అంతా కొద్ది ప్రాంతంలో కేంద్రీకృతమై వుంటుంది. దీనినే కేంద్రకం అంటారు.
- కేంద్రకం చుట్టూ ఎలక్ట్రానులు వృత్తాకార మార్గాలలో తిరుగుతుంటాయి. ఈ మార్గాలనే కక్ష్యలు అని అంటారు. (సూర్యుని చుట్టూ గ్రహాలు ఏ విధంగా తిరుగుతాయో, అదేవిధంగా కేంద్రకం చుట్టూ ఎలక్ట్రాన్లు వృత్తాకార మార్గాలలో తిరుగుతాయి. ఆ విధంగా రూధర్ ఫర్డ్ నమూనా సౌరకుటుంబాన్ని పోలి వుంటుంది.)
- కేంద్రకానికి, ఎలక్ట్రాన్లకు మధ్య స్థిర విద్యుదాకర్షణ బలం వలన ఎలక్ట్రాన్లు బంధింపబడి ఉండును. స్థిర విద్యుదాకర్షణ బలం అభికేంద్ర బలంగా పనిచేసి ఎలక్ట్రాన్లను కేంద్రకం వైపు లాగును. కేంద్రం చుట్టు తిరిగే ఎలక్ట్రాన్ పై అపకేంద్రబలం పనిచేయును. ఈ రెండు బలాలు సమానంగా వ్యతిరేకదిశలో పనిచేయుట వలన ఎలక్ట్రాన్ దాని కక్ష్యలో పరిభ్రమించును.
రూధర్ఫర్డ్ నమూనాలోని లోపాలు :
- త్వరణంలో ఉన్న ఎలక్ట్రానులు విద్యుదావేశాన్ని ఉద్గారం చేయును. అందువల్ల అవి శక్తిని కోల్పోతూ క్రమంగా కేంద్రకంలోనికి పడిపోవాలి. అప్పుడు పరమాణువు నాశనమగును. కాని అలా జరుగుట లేదు.
- అలా కాకుండా, ఎలక్ట్రాను త్వరణంలో లేకుండా ఉంటే అది స్థిరంగా ఉండాలి (థామ్సన్ నమూనా మాదిరిగా). ఇటువంటి సందర్భంలో ధనాత్మక కేంద్రము ఋణాత్మక ఎలక్ట్రానులను తనవైపుకు ఆకర్షించుకోవాలి కాని ఇది కూడ జరగడం లేదు.
- ఈ విధంగా రూధర్ఫర్డ్ నమూనా పరమాణు యొక్క స్థిరత్వాన్ని విశదీకరించలేకపోయింది.
- రూధర్ ఫర్డ్ పరమాణువులోని ఎలక్ట్రాన్ అమరికను వివరించలేదు. అనగా కేంద్రకం చుట్టూ ఎలక్ట్రానులు ఎలా అమరి ఉన్నాయో, వాటి శక్తి స్థాయిలు ఎలా ఉన్నాయో వివరించలేదు.
ప్రశ్న 7.
ప్లాంక్స్ క్వాంటమ్ సిద్ధాంతాన్ని సంక్షిప్తంగా వివరించండి.
జవాబు:
ప్లాంక్ క్వాంటం సిద్ధాంతం కృష్ణవస్తువు యొక్క వికిరణాన్ని వివరిస్తుంది. ఇది విద్యుదయస్కాంతపు కణస్వభావాన్ని సమర్థిస్తుంది.
కృష్ణవస్తువు :
తనపై పడిన కాంతిని పూర్తిగా శోషించుకునే ఆదర్శ వస్తువునే కృష్ణవస్తువు అంటారు.
క్వాంటం :
ఉద్గారించబడే లేదా శోషించబడే విద్యుదయస్కాంత వికిరణం యొక్క అతి స్వల్ప పరిమాణం గల శక్తిని క్వాంటం అని అంటారు. ఈ క్వాంటం కేవలం ఒక శక్తి ప్యాకెట్. దీనికి ఎటువంటి ద్రవ్యరాశి వుండదు.
ప్లాంక్ క్వాంటం సిద్ధాంతం ముఖ్యాంశాలు :
- ఆవేశపూరిత కణాల (ఎలక్ట్రానులు) డోలనం వలన శక్తి ఉద్గారం జరుగుతుంది.
- శక్తి ఉద్గారం అవిచ్చిన్నంగా వుండదు. వికిరణం ‘క్వాంటం’ అనే కొన్ని చిన్న శక్తి పాకెట్లుగా ఉద్గారం చెందుతుంది.
- క్వాంటమ్ యొక్క శక్తి E ని తెలియచేయు సమీకరణం E = hν, h = ప్లాంక్ స్థిరాంకం మరియు ν = డోలనం చెందే కణం పౌనఃపున్యం
- మరింత వివరణాత్మకంగా వ్రాయగా, E = n(hν), n = 1,2,3, …కావున శక్తి అనేది క్వాంటీకరణము చెందినది అనగా ఉద్గారము లేదా శోషించుకునే శక్తి, క్వాంటమ్లకు సరళపూర్ణాంకముగా ఉంటుంది.
- ఉద్గారితమైన శక్తి, క్వాంటం తరంగాలుగా వ్యాపిస్తుంది.
- విడుదలయ్యే వికిరణాల తరచుదనం, కృష్ణ పదార్ధం యొక్క ఉష్ణోగ్రతపై మాత్రమే ఆధారపడుతుంది.
![]()
ప్రశ్న 8.
పరమాణు క్వాంటమ్ యాంత్రిక నమూనా ముఖ్య లక్షణాలను వివరించండి.
జవాబు:
సంప్రదాయ యాంత్రిక శాస్త్రం స్థూల వస్తువుల (రాళ్ళు, గ్రహాల వంటి) చలనాన్ని వర్ణించగలిగితే క్వాంటం యాంత్రిక శాస్త్రం సూక్ష్మాతి సూక్ష్మ కణాల (ఎలక్ట్రాన్ల వంటి) చలనాన్ని వివరించగలిగినది.
సూక్ష్మ కణాలు ద్వంద్వ స్వభావాన్ని కలిగి ఉండును. అవి కణస్వభావం మరియు తరంగ స్వభావం రెండింటిని కలిగి ఉండును. ఎలక్ట్రాన్ల యొక్క తరంగ స్వభావమును ప్రోడింగర్ సమీకరణము ద్వారా తెలుసకొనవచ్చును.
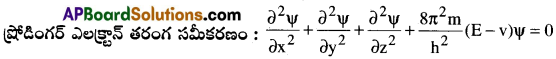
ఇక్కడ, Ψ = తరంగ ప్రమేయము మరియు ఇది తరంగం యొక్క డోలన పరిమితిని తెలియజేయును.
m = ఎలక్ట్రాన్ ద్రవ్యరాశి
h = ప్లాంక్ స్థిరాంకం
E = ఎలక్ట్రాన్ యొక్క మొత్తము శక్తి (KE + PE)
V = ఎలక్ట్రాన్ యొక్క స్థిర శక్తి
(E-v) = ఎలక్ట్రాన్ యొక్క గతిజ శక్తి
(x, y, z) లు త్రిమితీయ ప్రదేశంలో ఉన్న ఎలక్ట్రాన్ యొక్క నిరూపకాలు.
పరమాణు క్వాంట్ యాంత్రిక నమూనా ముఖ్య లక్షణాలు
- పరమాణువులోని ఎలక్ట్రాన్ల శక్తి క్వాంటీ కృతమై ఉంటుంది. (వీటికి కొన్ని నిర్దిష్టమైన విశిష్ట విలువలు ఉండును)
- పరమాణువు యొక్క శక్తి స్థాయిలు క్వాంటీకృతమై ఉండును. ఇవి ప్రోడింగర్ తరంగ సమీకరణమునకు ఆమోదయోగ్యమైన సాధనలుగా ఉండును.
- పరమాణు ఆర్బిటాల్ తరంగ ప్రమేయము “Ψ”, పరమాణువులోని ఎలక్ట్రాన్ల స్థితికి ప్రాతినిధ్యం వహిస్తుంది.
- ఎలక్ట్రాన్ తిరిగే యాదార్ధమైన మార్గాన్ని ఖచ్చితముగా కనుగొనలేము. కాని కేంద్రకం చుట్టూ పరమాణు అంతరాళములో వివిధ బిందువుల వద్ద ఎలక్ట్రాన్లు ఉండే సంభావ్యతను కనుగొనవచ్చును.
- పరమాణువులో ఏదైనా ఒక బిందువు వద్ద ఎలక్ట్రాను కనుగొనే సంభావ్యత, ఆ బిందువు వద్ద ఆర్బిటాల్ తరంగ ప్రమేయ వర్గము |Ψ|² నకు అనులోమానుపాతంలో ఉంటుంది.
|Ψ|² తరంగ ప్రమేయ వర్గమును సంభావ్యత సాంద్రత అంటారు. ఇది ఎప్పుడూ ధనాత్మకంగా ఉంటుంది. ఈ |Ψ|² విలువను ఉపయోగించి ఆర్బిటాల్ అనగా కేంద్రకం చుట్టూ ఎలక్ట్రాన్ ఉండే గరిష్ట సంభావ్యత గల ప్రదేశాన్ని గుర్తించవచ్చు.
ప్రశ్న 9.
పదార్థ ద్వంద్వ స్వభావాన్ని వివరించండి. ఎలక్ట్రాన్ లాంటి సూక్ష్మ కణాలకు దీని ప్రాముఖ్యాన్ని చర్చించండి.
జవాబు:
ఎలక్ట్రాన్ వంటి సూక్ష్మ కణాలకు కణ స్వభావము మరియు తరంగ స్వభావము రెండూ ఉండునని డీ బ్రోగ్లీ ప్రతిపాదించెను. కావున ఎలక్ట్రాను ద్రవ్యవేగము మరియు తరంగదైర్ఘ్యము రెండూ వుంటాయి.
(i) ప్లాంక్ క్వాంటం సిద్ధాంతం నుండి ఫోటాన్ శక్తి E = hν.
E = hν = h \(\frac{c}{\lambda}\) ———- (1) (∵ ν = \(\frac{c}{\lambda}\), c = ఫోటాన్ యొక్క వేగం)
(ii) ఐన్స్టీన్ ద్రవ్యరాశి శక్తి తుల్యతా నియమం నుండి E = mc² —(2); (1), (2)లను సమానం చేయగా
h \(\frac{c}{\lambda}\) = mc² ⇒ \(\frac{h}{\lambda}\) = mc ⇒ λ = \(\frac{h}{mc}=\frac{h}{p}\) —– (3) (∵ mc = p = ద్రవ్యవేగం)
ఫోటాన్లు వర్తించే పై సమీకరణం (3)ను అతివేగముతో పరిభ్రమించే ఎలక్ట్రాను వంటి సూక్ష్మకణాలకు కూడా వర్తింపచేయవచ్చునని డీ బ్రోగ్లీ సూత్రీకరించాడు.
కావున (3) వ సమీకరణంలో, ఫోటాన్ వేగం (c) ను, సూక్ష్మ కణాల వేగం (V) లో ప్రతిక్షేపిస్తే, (3)వ సమీకరణాన్ని క్రింది విధంగా వ్రాయవచ్చు
λ = \(\frac{h}{p}=\frac{h}{mv}\) —– (4) ఈ సమీకరణమునే డీబ్రోగ్లీ సమీకరణం అంటారు.
ఈ λ ను కణ తరంగదైర్ఘ్యం (లేదా) ఢీబ్రోగ్లీ తరంగదైర్ఘ్యం అంటారు.
కావున, ఎలక్ట్రాన్ వంటి సూక్ష్మకణానికి పైన సూచించిన విధంగా λ అనే తరంగదైర్ఘ్యం ఉంటుంది.
అందుచేత, ఎలక్ట్రాన్ తరంగ స్వభావాన్ని కూడా కలిగివుంటుంది అని చెప్పవచ్చు.
ప్రాముఖ్యత :
వేగంతో ప్రయాణం చేసే ప్రతి వస్తువుకూ సమీకరణం (4) వర్తిస్తుంది. గ్రహాల వంటి అతి పెద్ద వాటికి m విలువ చాలా ఎక్కువగా ఉంటుంది. కావున λ విలువ నిర్లక్ష్యం చేయదగినంత చిన్నదిగా ఉంటుంది. ఎందుకనగా m అనేది సమీకరణం (4)లో హారంలో కలదు.
కాని, ఎలక్ట్రాన్ వంటి అతి సూక్ష్మ కణాలకు ద్రవ్యరాశి తక్కువగా వుంటుంది. కావున, λ విలువను పరిగణనలోకి తీసుకోవాలి.
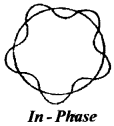
ఎలక్ట్రాన్ కేంద్రకం చుట్టూ వృత్తాకార మార్గాలలో తిరుగుతూ వుంటుంది.
ఆ ఎలక్ట్రాను రెండు రకాల తరంగదైర్ఘ్యాలను ఊహించవచ్చు.
ఒకటి నిర్మాణాత్మక వ్యతికరణం (nλ = 2πr) వలన ఏర్పడును.
రెండోది విధ్వంసక వ్యతికరణం (nλ ≠ 2πr) వలన ఏర్పడును.
ఎలక్ట్రాన్ కక్ష్య యొక్క వృత్తపరిధి, ఎలక్ట్రాన్ తరంగదైర్ఘ్యం λ నకు ‘పూర్ణాంక గుణిజం’గా ఉన్నపుడు ఏర్పడే ఎలక్ట్రాన్ తరంగాలు ‘ప్రావస్థలో ఉన్నాయి’ అని అంటారు. అలా కానిచో వాటిని ‘ప్రావస్థలో లేవు’ అని అంటారు.
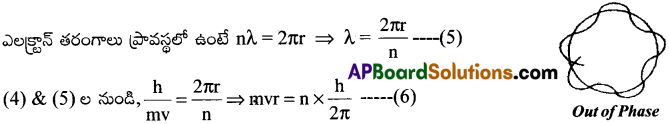
(6) అనే సమీకరణం, బోర్ తెలియజేసిన కోణీయ ద్రవ్యవేగం యొక్క క్వాంటీకరణంను సూచిస్తుంది.
కావున డీబ్రోగ్లీ సిద్ధాంతం మరియు బోర్ సిద్ధాంతములు రెండు ఒకదానితో ఒకటి ఈ విషయంలో ఏకీభవిస్తాయని తెలుస్తుంది.
ప్రశ్న 10.
పూర్తిగా నిండిన, సగం నిండిన ఉపకర్పరాల స్థిరత్వానికి కారణాలను విశదీకరించండి.
జవాబు:
పూర్తిగా నిండిన, సగం నిండిన ఉపకర్పరాలు పరమాణువుకు స్థిరత్వాన్ని అందించే కారణాలు.
1. ఉపకర్పరాలలో ఎలక్ట్రాన్ల సౌష్టవ పంపిణీ.
2. అధిక సంఖ్యలో ‘మార్చుకొనే శక్తి’ లను కలిగి ఉండుట.
వీటిని క్రోమియం మరియు కాపర్ యొక్క ఎలక్ట్రాన్ విన్యాసముల ద్వారా సోదొహరణముగా వివరించవచ్చు.
క్రోమియం, కాపర్ ఊహించిన(నిజానికి ఉండవలసిన) ఎలక్ట్రాన్ విన్యాసములు:
Cr(Z = 24) : [Ar] 4s²3d4
Cu(Z = 29) : [Ar] 4s²3d9
4s మరియు 3d ఉపకర్పరాల శక్తి విలువలు ఒక దానికొకటి చాలా దగ్గరగా ఉండును. ఒక ఎలక్ట్రాన్ తక్కువ స్థాయి శక్తి గల 4s నుండి 3d కి మారినపుడు క్రోమియం, కాపర్ల ఎలక్ట్రాన్ విన్యాసము ఈ క్రింది విధంగా మారును:
Cr(Z = 24) : [Ar]4s¹3d5
Cu(Z = 29) : [Ar]4s¹3d10
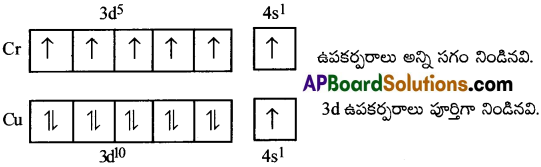
కావున Cr నకు సగం నిండిన 3d – ఉపకర్పరం మరియు Cu నకు పూర్తిగా నిండిన 3d – ఉపకర్పరం ఎలక్ట్రాన్ విన్యాసములు ఏర్పడినవి.
1. ఎలక్ట్రాన్ల సౌష్టవ పంపిణి :
సౌష్టవం స్థిరత్వానికి దారి తీస్తుందని మనకు తెలుసు. పూర్తిగా గాని, సగం గాని ఉపకర్పరాలలో ఎలక్ట్రాన్లు సౌష్టవంగా పంపిణీ జరగటం వల్ల వాటికి అధిక స్థిరత్వం ఏర్పడుతుంది. ఒకే ఉపకర్పరంలోని (3d) ఎలక్ట్రాన్లన్నీంటికి ఒకే శక్తి ఉండి ప్రాదేశిక పంపిణీ మాత్రం వేరు వేరుగా ఉంటుంది. కావున అవి ఒకదానికి మరొకటి కవచంగా ఏర్పడటం సాపేక్షంగా తక్కువ కనుక ఎలక్ట్రాన్లు కేంద్రకంతో అధికంగా ఆకర్షించబడతాయి. అందుమూలంగా పరమాణువులకు అధిక స్థిరత్వం లభించును.
2. మార్చుకొనే శక్తి :
ఒకే ఉపకర్పంలోని ఎలక్ట్రాన్లు ఒక ఆర్బిటాల్ నుండి మరొక ఆర్బిటాల్ లోనికి మారినప్పుడు శక్తి విడుదలగును. దీనినే ‘మార్చుకొనే శక్తి’ అంటారు.
డీజనరేట్ ఆర్బిటాళ్ళలో రెండు లేక అంతకంటే ఎక్కువ సమాంతర స్పిన్లు గల ఎలక్ట్రాన్లు ఒక దాని స్థానాన్ని మరొక దానితో మార్చుకొంటే శక్తి విడుదలగును. ఈ మార్పు వల్ల పరమాణు శక్తి తగ్గుతుంది. తద్వారా స్థిరత్వం పెరుగుతుంది.ఇలా శక్తి మార్పులు జరిగే సంఖ్య అధికమయ్యే కొద్దీ శక్తి తగ్గుతుంది. అందువల్ల పరమాణువుకు అధిక స్థిరత్వం లభిస్తుంది.
ఉదా: 3d5 ఎలక్ట్రాన్ విన్యాసంలో ఎలక్ట్రాన్ జతలు 10 రకాలుగా మారే అవకాశం ఉండును.
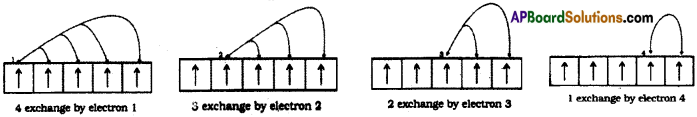
మరో విధంగా చెప్పాలంటే సగం నిండిన, పూర్తిగా నిండిన ఉపకర్పరాలకు అధిక స్థిరత్వానికి కారణాలు: (i) సాపేక్షంగా తక్కువ కవచం ఉండటం, (ii) కులంబిక్ వికర్షణ శక్తి స్వల్పంగా ఉండటం, (iii) మార్చుకొనే శక్తి అధికంగా ఉండటం.
Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
ఎలక్ట్రాన్ ఆవేశం, ద్రవ్యరాశి ఎంత ఉంటాయి? ఎలక్ట్రాన్ ఆవేశానికి, ద్రవ్యరాశికి గల నిష్పత్తి ఎంత?
జవాబు:
ఎలక్ట్రాన్ ఆవేశం = −1.602 × 10-19 C,
ఎలక్ట్రాన్ ద్రవ్యరాశి = 9.11 × 10-31 kg
ఆవేశం, ద్రవ్యరాశికి గల నిష్పత్తి = (\(\frac{e}{m}\)) =1.76 × 1011C kg -1.
![]()
ప్రశ్న 2.
ఒక మోల్ ఎలక్ట్రాన్ల ఆవేశాన్ని గణించండి.
జవాబు:
ఒక మోల్ ఎలక్ట్రాన్ల ఆవేశం = ఎలక్ట్రాన్ ఆవేశం × అవగాడ్రో సంఖ్య
= 1.6022 × 10-19 × 6.023 × 1023 = 9.6500 × 104 = 96500 C = 1 ఫారడే
ప్రశ్న 3.
ఒక మోల్ ఎలక్ట్రాన్ల ద్రవ్యరాశిని గణించండి.
జవాబు:
ఒక మోల్ ఎలక్ట్రాన్ల ద్రవ్యరాశి = ఎలక్ట్రాన్ ద్రవ్యరాశి × అవగాడ్రో సంఖ్య
= 9.1 × 10-31 × 6.023 × 1023 = 54.8 × 10-8 Kg = 5.48 × 10-7Kg
ప్రశ్న 4.
ఒక మోల్ ప్రోటాన్ల ద్రవ్యరాశిని గణించండి.
జవాబు:
ఒక మోల్ ప్రోటాన్ల ద్రవ్యరాశి = ప్రోటాన్ ద్రవ్యరాశి అవగాడ్రో సంఖ్య
= 1.6726 × 10-27 × 6.023 × 1023 = 10.07 × 10-4 Kg = 1.007 × 10-3 Kg
ప్రశ్న 5.
ఒక మోల్ న్యూట్రాన్ల ఒక మోల్ న్యూట్రాన్ల ద్రవ్యరాశిని గణించండి.
జవాబు:
ద్రవ్యరాశి = న్యూట్రాన్ ద్రవ్యరాశి × అవగాడ్రో సంఖ్య
1.6749 × 10-27 × 6.023 × 1023 = 10.07 × 104 Kg= 1.0087 × 10-3 Kg
ప్రశ్న 6.
600nm తరంగ దైర్ఘ్యం గల వికిరణాల పౌనఃపున్యం ఎంత?
సాధన:
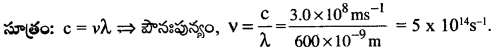
ప్రశ్న 7.
2.0 × 10-7 ms-1 వేగంతో ప్రయాణించే ఎలక్ట్రాన్ తరంగదైర్ఘ్యం ఎంత?
సాధన:
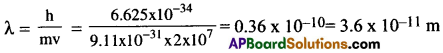
ప్రశ్న 8.
నూనె చుక్క మీద ఉన్న స్థిర విద్యుత్ ఆవేశం -3.2044 × 10-19C. దాని మీద ఎన్ని ఎలక్ట్రాన్లు ఉన్నాయి?
సాధన:
ఒక ఎలక్ట్రాన్ ఆవేశం = -1.602 × 10-19 C
నూనె చుక్క మీద ఆవేశం – 3.2044 × 10-19 C
∴ ఎలక్ట్రాన్ల సంఖ్య = \(\frac{-3.2044\times10^{-19}}{-1.602\times10^{-19}}\) = 2 ఎలక్ట్రాన్లు.
![]()
ప్రశ్న 9.
4000Å. తరంగదైర్ఘ్య వికిరణాలను లోహతలం పై పడేటట్లు చేస్తే శూన్యం వేగం గల ఎలక్ట్రాన్లు ఉద్గారమయ్యాయి. ఆరంభ పౌనఃపున్యం (ν0) ఎంత?
సాధన:
ఎలక్ట్రాన్ల వేగం శూన్యం కావున KE = 0, ∴ hν = hν0 (or) ν = ν

ప్రశ్న 10.
10 m/s వేగంతో ప్రయాణం చేసే 0.1 kg ద్రవ్యరాశి గల బంతి యొక్క డీబ్రోగిలీ తరంగ ధైర్ఘ్యం ఎంత? [May’ 11]
సాధన:
దత్తాంశం : m = 0.1 kg ; v = 10ms-1; h = 6.626 × 10-34 Js

ప్రశ్న 11.
5800A తరంగదైర్ఘ్యం గల పసుపు వికిరణాల తరంగ సంఖ్యను (v) ను పౌనఃపున్యాన్ని (v) గణించండి.
సాధన:
సూత్రం :c = vλ
ఇక్కడ, c = కాంతి వేగం = 3 × 108 m / sec ; ν = పౌనఃపున్యం =? ;
λ = తరంగదైర్ఘ్యం = 5800Å (or) 5800 × 10-10m
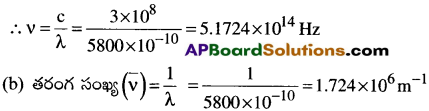
ప్రశ్న 12.
ఆకాశవాణి ఢిల్లీ, వివిధభారతి స్టేషన్ నుంచి (కిలోహె) పౌనఃపున్యం పై ప్రసారాలు చేస్తుంది. ప్రసారిణి ఉద్గారించే విద్యుదయస్కాంత వికిరణాల తరంగదైర్ఘ్యం గణించండి. ఇది విద్యుదయస్కాంత వర్ణపటంలో ఏ ప్రాంతానికి చెందుతుంది?
సాధన:
పౌనఃపున్యం, v = 1,368 KHz = 1,368 × 10³ s-1
కాంతి వేగం, c = 3 × 108 m.s-1
సూత్రం: తరంగదైర్ఘ్యం (λ) = \(\frac{c}{v}=\frac{3 \times 10^8}{1368 \times 10^3}\) = 219.3m
ఈ తరంగదైర్ఘ్యం రేడియో తరంగాల కోవలోకి వస్తుంది.
ప్రశ్న 13.
లోహం ఆరంభ పౌనఃపున్యం v0 is 7.0 × 1014 s1. v = 1.0 × 1015 s-1 పౌనఃపున్యం గల వికిరణాలు లోహం పై తగిలినప్పుడు బయటకు వెలువడే ఎలక్ట్రాన్ల గతిజశక్తి గణించండి.
సాధన:
ఆరంభ పౌనఃపున్యం, ν0 = 7.0 × 1014
పౌనఃపున్యం, ν = 1.0 × 1015 s-1 = 10 × 1014 s-1
ప్లాంక్ స్థిరాంకం, h = 6.626 × 10-34 j-sec
సూత్రం : hν = hν0 + KE
(or) గతిజశక్తి = h (ν – ν0) = 6.626 × 10-34 (10 – 7) 1014 = 1.987 × 10-19 J.
ప్రశ్న 14.
3.6 Å తరంగదైర్ఘ్యం గల ఫోటాన్ ద్రవ్యరాశిని గణించండి.
సాధన:
తరంగదైర్ఘ్యం, λ = 3.6 A° = 3.6 × 10-10 m, ఫోటాన్ వేగం = కాంతి వేగం = 3 × 108 m.sec-1
ప్లాంక్ స్థిరాంకం, h = 6.626 × 10-34 j-sec
![]()
![]()
ప్రశ్న 15.
హైడ్రోజన్ పరమాణువులో n = 5 స్థాయి నుంచి n = 2 స్థాయికి ఎలక్ట్రాన్ పరివర్తనం చెందినప్పుడు ఉద్గారమయ్యే ఫోటాన్ పౌనఃపున్యం, తరంగ దైర్ఘ్యం ఎంత?
సాధన:
n1 = 2, n2 = 5; R = 1.1 × 107m-1
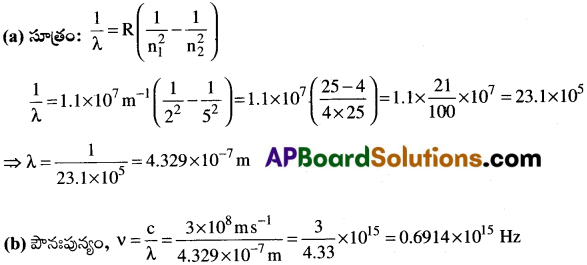
ప్రశ్న 16.
5 × 1014 Hz పౌనఃపున్యం గల ఒక మోల్ ఫోటాన్ల శక్తిని గణించండి.
సాధన:
ఒక ఫోటాన్ శక్తి E = hν;
h = 6.626 × 10-34 Js; ν = 5 × 1014s-1
E = (6.626 × 10-34 Js) × (5 × 1014s-1) = 3.313 × 10-19 J
ఒక మోల్ ఫోటాన్ శక్తి = (3.313 × 10-19 J) × (6.023 × 1023 mol-1) = 199.51 kJ mol-1.
ప్రశ్న 17.
He+ మొదటి కక్ష్య శక్తిని గణించండి. ఆ కక్ష్య వ్యాసార్థం ఎంత?
సాధన:

![]()
ప్రశ్న 18.
సరియైన ఫోటాన్లను ఉపయోగించి మైక్రోస్కోప్ ద్వారా పరమాణువులో ఉన్న ఎలక్ట్రాన్ ను 0.1Å. దూరం లోపల చూడగలిగారు. దాని వేగం కొలతలో ఉన్న అనిశ్చితత్వం ఎంత?
సాధన: