Students get through AP Inter 2nd Year Chemistry Important Questions 2nd Lesson ద్రావణాలు which are most likely to be asked in the exam.
AP Inter 2nd Year Chemistry Important Questions 2nd Lesson ద్రావణాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
ద్రావణాన్ని నిర్వచించండి.
జవాబు:
రెండు లేదా అంతకంటే ఎక్కువ పదార్థాల సజాతీయ మిశ్రమం అయి, దాని సంఘటనాన్ని కొన్ని పరిమితులకు లోబడి మార్చగలిగే మిశ్రమాన్ని ద్రావణం
అంటారు.
ప్రశ్న 2.
మోలారిటీని నిర్వచించండి. [TS 17]
జవాబు:
మోలారిటీ(M):
ఒక లీటరు ద్రావణంలో కరిగి ఉన్న ద్రావితం మోల్ల సంఖ్యను మోలారిటీ అని అంటారు.
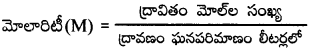
ప్రశ్న 3.
మోలాలిటీని నిర్వచించండి. [AP 15]
జవాబు:
మోలాలిటీ(m):
ఒక కిలోగ్రామ్ ద్రావణిలో కరిగి ఉండే ద్రావితం మోల్ల సంఖ్యను ఆ ద్రావణం మోలారిటీ అంటారు.
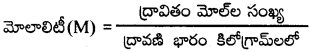
ప్రశ్న 4.
ఘనద్రావితం గల ఘన పదార్థ ద్రావణానికి ఉదాహరణ ఇవ్వండి.
జవాబు:
ద్రావణి మరియు ద్రావితం రెండూను ఘన పదార్థాలుగా గల ద్రావణంను ఘన ద్రావణం అంటారు. ఉదా: ఒక మిశ్రమ లోహం ఘనపదార్థం ద్రావితంగా గల ఘన ద్రావణంనకు ఉదాహరణ.
ఉదా: గోల్డ్ కాపర్, కాపర్లో జింక్
ప్రశ్న 5.
మోల్ భాగంను నిర్వచించండి. [TS -18] [IPE ’14]
జవాబు:
ద్రావణంలో ఒక అనుఘటకం మోల్ల సంఖ్యకు, ఆ ద్రావణంలోని అన్ని అనుఘటకాల మొత్తం మోల్ల సంఖ్యకి మొత్తానికి గల నిష్పత్తిని మోల్ భాగం అంటారు. nA మరియు ng లు వరుసగా ఆ ద్రావణంలోని ద్రావణి మరియు ద్రావితంలు మోల్ల సంఖ్య అయిన

ప్రశ్న 6.
ద్రావణం ద్రవ్యరాశి శాతాన్ని నిర్వచించండి.
జవాబు:
100గ్రా.ల ద్రావణంనకు ఒక అనుఘటకం యొక్క ద్రవ్యరాశి, ఆ ద్రావణం యొక్క ద్రవ్యరాశి శాతము అంటారు.
A అను ఘటకం యొక్క ద్రవ్యరాశి WA మరియు B అను ఘటకం యొక్క ద్రవ్యరాశి WB లు ద్రావణంలో కలవు. అయిన A ద్రవ్యరాశి శాతము
A = \(\frac{W_A}{W_A+W_B}\) × 100
![]()
ప్రశ్న 7.
ద్రావణం ppm అనగానేమి?
జవాబు:
ద్రావణంలో ఒక అనుఘటకం మిలియన్ భాగాల ద్రావణంలో ఎన్ని భాగాలు ఉండునో దానిని అనుఘటకం మిలియన్లోని భాగం అంటారు.
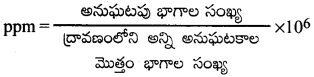
ప్రశ్న 8.
ఆల్కహాల్, నీటి ద్రావణంలో అణువుల అన్యోన్య చర్యలు ఏ పాత్ర పోషిస్తాయి.
జవాబు:
ఆల్కహాల్ మరియు నీటి అణువులు అంతరణుక హైడ్రోజన్ బంధాలను కలిగి ఉండును. వీటిని మిశ్రమం చేయగా ఆకర్షణ బలాల పరిమాణం తగ్గును. ఆకర్షణ బలాలు తగ్గుటచే ద్రావణం ఆదర్శ ప్రవర్తన నుండి ధన విచలనంను ప్రదర్శించును. దీని ఫలితంగా ద్రావణం శుద్ధనీరు మరియు శుద్ధ ఆల్కహాల్ల కంటే అధిక భాష్పపీడనంను మరియు అల్ప బాష్పీభవన ఉష్ణోగ్రతను కలిగి ఉండును.
ప్రశ్న 9.
రౌల్ట్ నియమంను తెల్పండి. [TS22][AP,TS–16,17,18,20]
జవాబు:
భాష్పశీల ద్రవాల ద్రావణంలోని ప్రతి అనుఘటకం యొక్క పాక్షిక పీడనం, ఆ అనుఘటకం యొక్క మోల్ భాగానికి అనులోమానుపాతంలో ఉంటుంది. ద్రావణి మాత్రమే బాష్పశీల పదార్థం అయినప్పుడు, ఆ ద్రావణం యొక్క సాపేక్ష బాష్పపీడన నిమ్నత ఆ ద్రావణంలోని ద్రావితం యొక్క మోల్ భాగానికి సమానం.
ప్రశ్న 10.
హెన్రీ నియమాన్ని వ్రాయండి. [AP,TS 16,18,20]
జవాబు:
స్థిర ఉష్ణోగ్రత వద్ద ద్రవంలో వాయువు యొక్క ద్రావణీయత ఆ వాయువు యొక్క పీడనానికి అనులోమానుపాతంలో ఉంటుంది. [TS 22]
సాధారణంగా హెన్రీ నియమంను ఈ విధంగా నిర్వచిస్తారు.
భాష్పస్థితిలోని వాయువు యొక్క పాక్షిక పీడనం ద్రావణంలోని వాయువు యొక్క మోల్ భాగానికి అనులోమానుపాతంలో ఉండును.
దీనిని ఈ విధంగా తెలియజేస్తాము.
p = KH.χ
KH = హేన్రీ నియమ స్థిరాంకం
χ = వాయువు యొక్క మోల్ భాగం
ప్రశ్న 11.
ఎబ్యులియోస్కోపిక్ స్థిరాంకం అనగానేమి? [AP 17]
జవాబు:
ఎబ్యులియోస్కోపిక్ స్థిరాంకం :
ఒక కిలోగ్రామ్ ద్రావణికి ఒక మోల్ అబాష్పశీలి ద్రావితంను కలిపినప్పుడు ఆ ద్రావణం ప్రదర్శించే బాష్పీభవన స్థాన ఉన్నతిని ఎబ్యుల్లియోస్కోపిక్ స్థిరాంకం అంటారు.
![]()
ప్రశ్న 12.
క్రయోస్కోపిక్ స్థిరాంకం అనగానేమి?
జవాబు:
ఒక మోల్ అభాష్పశీల ద్రావణి ఒక కిలోగ్రామ్ ద్రావణిలో కరిగి ఉన్నప్పుడు, ఆ ద్రావణం ప్రదర్శించే ఘనీభవనస్థాన నిమ్నతని క్రయోస్కోపిక్ స్థిరాంకం అంటారు.
ప్రశ్న 13.
ద్రవాభిసరణ పీడనాన్ని నిర్వచించండి. [AP 15,16,18]
జవాబు:
ద్రావణం మరియు ద్రావణిలను అర్థ ప్రవేశ పొర శ్రీ ద్వారా వేరుపరచినప్పుడు, ద్రవాభిసరణాన్ని నిరోధించుటకు ద్రావణంపై ప్రయోగించడానికి అవసరమయ్యే బాహ్య పీడనాన్ని ద్రవాభిసరణ పీడనం అంటారు. [TS 16,22]
ప్రశ్న 14.
ఐసోటోనిక్ ద్రావణాలు అనగానేమి? [AP 15,17,19,22]
జవాబు:
నియమిత ఉష్ణోగ్రత వద్ద, ఒకే ద్రవాభిసరణ పీడనాన్ని కలిగి ఉన్న ద్రావణాలను ఐసోటోనిక్ ద్రావణాలు అంటారు. [TS-16,19]
ఉదా: సెలైన్తో రక్తం ఐసోటోనిక్ (0.9% w/v NaCl ద్రావణం) గా ఉంటుంది.
ప్రశ్న 15.
క్రింది సమ్మేళనాలలో ఏవి నీటిలో కరుగవో, పాక్షికంగా కరుగుతాయో మరియు బాగా కరుగుతాయో గుర్తించండి.
(i) ఫీనాల్ (ii) టోలీన్ (iii) ఫార్మిక్ ఆమ్లం (iv) ఇథలీన్ గ్లైకాల్ (v) క్లోరోఫామ్ (vi) పెంటనోల్
జవాబు:
(i) ఫీనాల్ :
ఫీనాల్ నీటిలో పాక్షికంగా కరుగుతుంది. ఇది అధృవశీల C6H5 గ్రూపు మరియు ధృవశీల -OH గ్రూపులను కలిగి ఉండును. కావున ఇది నీటిలో హైడ్రోజన్ బంధాలను ఏర్పర్చును.
(ii) టోలీన్ :
టోలీన్ నీటిలో కరుగదు. టోలీన్ ఆధృవశీల మరియు నీరు ధృవశీల పదార్థాలు కనుకనే నీటిలో టోలీన్ కరుగదు.
(iii) ఫార్మిక్ ఆమ్లం :
నీటితో హైడ్రోజన్ బంధాలను ఏర్పర్చుట ద్వారా ఫార్మిక్ ఆమ్లం నీటిలో బాగా కరుగును.
(iv) ఇథలీన్ గ్లైకాల్ :
నీటితో హైడ్రోజన్ బంధాలను ఏర్పర్చుట వలన ఇథలీన్ గ్లైకాల్ నీటిలో బాగా కరుగును.
(v)క్లోరోఫామ్ :
క్లోరోఫామ్ ధృవశీలతను కలిగి ఉన్నప్పటికి నీటిలో హైడ్రోజన్ బంధాలను ఏర్పర్చకపోవుట వలన అది నీటిలో కరుగదు.
(vi) పెంటనోల్ :
OH గ్రూపు ధృవశీలత మరియు పెద్ద C5H11 అధృవశీలత కారణంగా పెంటనోల్ పాక్షికంగా నీటిలో కరుగుతుంది.
ప్రశ్న 16.
6.5 గ్రా.ల C9H8O4 ను 450 గ్రా.ల CH3CN లో కరిగించారు. ఎసిటోనైట్రైల్లో CH3CN ఆస్పిరిన్ C9H8O4 ద్రవ్యరాశి శాతాన్ని లెక్కించండి.
జవాబు:
ద్రావణం యొక్క ద్రవ్యరాశి = ద్రావతం ద్రవ్యరాశి + ద్రావణి ద్రవ్యరాశి= 6.5 + 450 = 456.5g

ప్రశ్న 17.
250 మి.లీ. 0.15 M మిథనాల్ ద్రావణంను తయారు చేయుటకు కావలసిన బెంజోయిక్ ఆమ్లం (C6H5COOH) ద్రవ్యరాశిని లెక్కించండి.
జవాబు:

బెంజోయిక్ ఆమ్లం యొక్క ద్రవ్యరాశి = మోలారిటీ × ద్రావణం ఘనపరిమాణం × మోలార్ ద్రవ్యరాశి
ద్రావణంఘనపరిమాణం = 250 మి.లీ = \(\frac{250}{1000}\) = 0.25 లీ
బెంజోయిక్ ఆమ్లం యొక్క మోలార్ భారం C6H5.COOH
= 7 × 12 + 6 × 1 + 2 × 16 = 122 గ్రా/మోల్-1
బెంజోయిక్ ఆమ్లం యొక్క ద్రవ్యరాశి
= 0.15 మోల్.లీ-1 × 0.25 లీ × 122 గ్రా/మోల్-1
= 4.575 గ్రా.
![]()
ప్రశ్న 18.
ఒకే పరిమాణం గల ఎసిటిక్ ఆమ్లం, డైక్లోరో ఎసిటిక్ ఆమ్లం, ట్రెక్లోరో ఎసిటిక్ ఆమ్లాల జల ద్రావణాలను పరిశీలించిన నీటి ఘనీభవన స్థాన నిమ్నతలు CH3COOH < CHCl2COOH < CCl3COOH క్రమంలో పెరుగుతాయి అని వివరించండి.
జవాబు:
ఘనీభవన స్థాన నిమ్నత క్రమం
CH3COOH < CHCl2COOH < CCl3COOH
నీటిలో ద్రావితం యొక్క ఘనీభవన స్థాన నిమ్నతి. జల ద్రావణంలో ఉన్న అయాన్లు లేదా కణాల సంఖ్యపై ఆధారపడి ఉండును.
CCl3COOH నందు మూడు క్లోరిన్ పరమాణువులు ఉండుటచే అయనీకరణం అధికంగా జరుగును. అయనీకరణ అవధి పెరిగే కొలది అధిక సంఖ్యలో అయాన్ ఉత్పత్తి అగును. అయాన్ల సంఖ్య పెరిగే కొలది ఘనీభవన స్థాన నిమ్నతి ఎక్కువగా ఉండును.
CHCl2COOH నందు రెండు క్లోరిన్ పరమాణువులు మాత్రమే ఉండుటచే అయనీకరణం సాపేక్షంగా తక్కువ ఉండును. కనుక CCl3COOH కన్నా దీనికి ఘనీభవనస్థాన నిమ్నత తక్కువగా ఉండును.
CH3COOH నందు క్లోరిన్ పరమాణువులు లేకపోవుట వలన ఇది అతి స్వల్పంగా అయనీకరణం చెందును. కనుక దీనికి ఘనీభవన స్థాన నిమ్నత అతి స్వల్పంగా ఉండును.
ప్రశ్న 19.
వాంట్ హోప్ గుణకం (i) అంటే ఏమిటి? దీనికి ద్విగుణాత్మక విద్యుద్విశ్లేష్య పదార్థం (1 : 1) ‘α’ కు ఏవిధమైన సంబంధం ఉన్నది.
జవాబు:
ప్రయోగం ద్వారా నిర్ణయించిన కణాధార ధర్మం విలువకు లెక్కించిన కణాధార ధర్మం విలువకు మధ్యగల నిష్పత్తిని వాంట్ హోప్స్ గుణకం (i) అంటారు.

ప్రశ్న 20.
సాపేక్ష బాష్పపీడన నిమ్నత అనగానేమి? [TS 16][AP 19,22]
జవాబు:
బాష్పపీడన నిమ్నత (P0 – Ps) కు శుద్ధ ద్రావణి బాష్పపీడనాని (P0) కి మధ్య గల నిష్పత్తికి సాపేక్ష బాష్పపీడన నిమ్నత అంటారు.
R.L.V.P = \(\frac{P^0-P^s}{P^0}\)
ప్రశ్న 21.
98% H2SO4 గల ద్రావణంలోని H2SO4 మోల్ భాగం గణించండి. [TS -18,22] [IPE ’14][AP 16,17,22]
జవాబు:
98% H2SO4 అనగా 98 గ్రా. H2SO4, 100 గ్రా. నీటిలో ఉన్నది.
H2SO4 ద్రావితం ద్రవ్యరాశి = 98 గ్రా.

Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
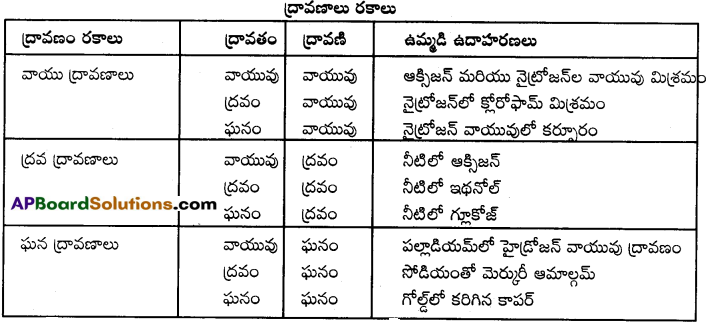
ద్రావణాలు ఎన్ని రకాలుగా ఏర్పడతాయి? ప్రతి ఒకదానికి ఒక ఉదాహరణనిమ్ము
జవాబు:
ప్రశ్న 2.
ద్రవ్యరాశి శాతము, ఘనపరిమాణ శాతము మరియు ద్రవ్యరాశికి ఘనపరిమాణ శాతం ద్రావణాలను నిర్వచించండి.
జవాబు:

ప్రశ్న 3.
ప్రయోగశాలలో ఉపయోగించే గాఢ నైట్రికామ్లం, 68% జల ద్రావణం. ఆ ద్రావణం సాంద్రత 1.504 గ్రా.లీ-1 ఉంటే అలాంటి నమూనా ఆమ్లం మోలారిటీ ఎంత?
జవాబు:
నైట్రిక్ ఆమ్లం యొక్క ద్రవ్యరాశి = 68
ద్రావణం యొక్క ద్రవ్యరాశి = 100 గ్రా.
HNO3 యొక్క మోలార్ ద్రవ్యరాశి = 63 గ్రా.మోల్-1.
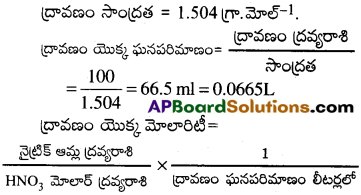
\(\frac{68}{63}\times\frac{1}{0.0665}\) = 16.23 M
ప్రశ్న 4.
గ్లూకోజ్ నీటి ద్రావణం 10% w/wగా సూచించబడింది. అయిన ఆ ద్రావణం మోలాలిటీ ఎంత ఉంటుంది.
జవాబు:
నీటిలో గ్లూకోజ్ ద్రావణం 10% w/w
అనగా 10 గ్రాముల గ్లూకోజ్ 100గ్రా. ద్రావణంలో కరిగి ఉన్నది.
గ్లూకోజ్ ద్రవ్యరాశి = 10 గ్రా.
ద్రావణం ద్రవ్యరాశి
ద్రావణం ద్రవ్యరాశి = 100 గ్రా.
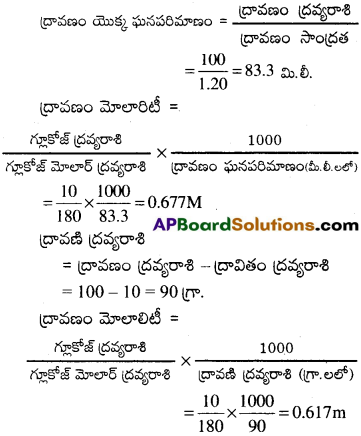
ప్రశ్న 5.
సుక్రోజ్ నీటి ద్రావణం 20% w/w గా సూచించబడింది. అయిన ఆ ద్రావణంలోని ప్రతి అనుఘటకానికి మోల్ భాగం ఎంత? [IPE ’14]
జవాబు:
20% W/W సుక్రోజ్ ద్రావణం అనగా 100 గ్రా. ల
ద్రావణంలో 20 గ్రా. ల సుక్రోజ్ కలిగి ఉన్నది.
సుక్రోజ్ ద్రవ్యరాశి = 20 గ్రా.
సుక్రోజ్ మోలార్ ద్రవ్యరాశి = 342 గ్రా.
ద్రావణం యొక్క ద్రవ్యరాశి = 100 గ్రా.
నీటి యొక్క మోలార్ ద్రవ్యరాశి = 18 గ్రా.
ద్రావణి ద్రవ్యరాశి = 100 – 20 = 80 గ్రా.
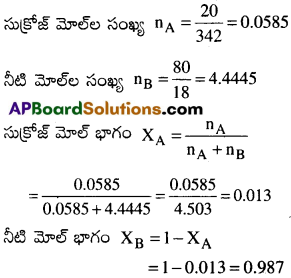
ప్రశ్న 6.
సమాన మోలార్ పరిమాణం గల Na2CO3, NaHCO3ల 1.0 గ్రా. మిశ్రమంతో పూర్తిగా చర్యనొందడానికి ఎన్ని మి.లీ.ల 0.1M HCl అవసరమవుతుంది?
జవాబు:
మిశ్రమంలో ఉన్న అనుఘటకాల మోల్ సంఖ్య లెక్కించుట.
మిశ్రమంలో ఉన్న Na2CO3 భారంను x గ్రా అనుకొనుము.
∴ మిశ్రమంలో ఉన్న NaHCO3 భారం= (1 – x)g
Na2CO3 మోలార్ ద్రవ్యరాశి = 106 గ్రా. మోల్-1
NaHCO3 మోలార్ ద్రవ్యరాశి 84 గ్రా. మోల్-1
∴ Na2CO3 మోల్ల సంఖ్య,
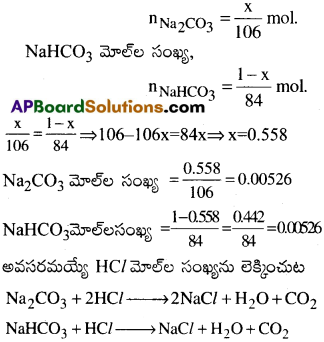
1 మోల్ Na2CO3 కి రెండు మోల్ల HCl అవసరం
∴ 0.00526 మోల్ల Na2CO3 కి కావలసిన HCl మోల్ల సంఖ్య
= 0.00526 × 2 మోల్ల = 0.01052 మోల్
1 మోల్ NaHCO3 కి ఒక మోల్ HCl అవసరం
∴ 0.00526 మోల్ల NaHCO3 కి కావలసిన HCl
మోల్ల సంఖ్య = 0.00526 మోల్
∴ అవసరమైన HCl మొత్తం మోల్ల సంఖ్య
= 0.01052 +0.00526
= 0.01578305
0.1M HCl ఘన పరిమాణంను లెక్కించుట:
0.1 మోల్ల 0.1M HCI, 1000 మి.లీ. HCl లో కలదు.
0.01578 మోల్ల 0.1 M HCl ఎన్ని మి.లీ ద్రావణంలో కలదు = \(\frac{1000}{0.1}\) × 0.01578 = 157.8 మి.లీ.
![]()
ప్రశ్న 7.
300 గ్రా.ల 25% ద్రావణం, 400 గ్రా.ల40% ద్రావణాలను కలిపి ద్రావణం తయారు చేశారు. ఫలితంగా వచ్చిన ద్రావణం ద్రవ్యరాశి శాతం లెక్కించండి.
జవాబు:
300 గ్రా.ల 25% ద్రావణం కలిగియున్న ద్రావితం
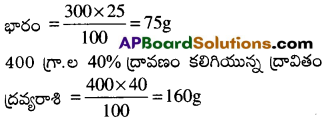
ద్రావితం మొత్తం ద్రవ్యరాశి = 160 + 75 = 235 గ్రా
ద్రావణం మొత్తం ద్రవ్యరాశి = 300 + 400 = 700 గ్రా.
ఫలిత ద్రావణంలోని ద్రావితం శాతం % = \(\frac{235}{700}\) ×100 = 33.5%
ఫలిత ద్రావణంలోని ద్రావణి శాతం% =100 – 33.5 – 66.5%
ప్రశ్న 8.
222.6 గ్రా.ల ఇథలీన్ గ్లైకాల్ను (C2H6O2), 200గ్రా.ల నీటి ద్రావణికి కలిపి ఘనీభవన వ్యతికరణి తయారు చేశారు. ద్రావణం మోలాలిటీని లెక్కించండి.
జవాబు:
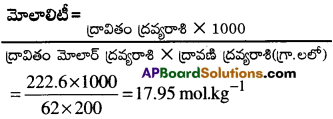
ప్రశ్న 9.
ఉష్ణోగ్రత పెరిగిన కొద్దీ ద్రవాలలో వాయువులకు ఎప్పుడూ తక్కువ కరిగే ప్రవృత్తి ఉంటుంది. ఎందుకు?
జవాబు:
![]()
ద్రవంలో వాయువులు,కరిగే ప్రక్రియ ఉష్ణమోచక చర్య. లీషాట్లియర్ సూత్రం ప్రకారం ఉష్ణోగ్రత పెంచితే సమతాస్థితి వెనుకకు (తిరోగామి దిశకు) జరుగుతుంది. దీని ఫలితంగా ద్రవాలలో వాయువుల ద్రావణీయత తగ్గుతుంది.
![]()
ప్రశ్న 10.
రౌల్ట్ నియమం నుంచి ధనాత్మక విచలనం అంటే ఏమిటి? రౌల్ట్ నియమం నుండి ధనాత్మక విచలనంలో ∆mix H గుర్తు సంబంధం ఎలా ఉంటుంది?
జవాబు:
రౌల్ట్ నియమం ప్రకారం ఏదైనా ద్రావణంలో ఉన్న ప్రతి బాష్పశీల అనుఘటకం యొక్క పాక్షిక బాష్పపీడనం వాటి మోల్ భాగానికి అనులోమానుపాతంలో ఉండును.
అన్ని గాఢతల అవధులలో రౌల్ట్ నియమాన్ని పాటించే ద్రావణాలను ఆదర్శ ద్రావణాలు అని అంటారు.
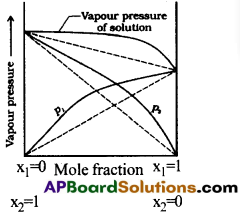
అట్లాంటి ద్రావణం యొక్క బాష్పపీడనం రౌల్ట్ నియమం ప్రకారం లెక్కించిన దాని కంటే ఎక్కువగాని, తక్కువ గాని ఉంటుంది. బాష్పపీడనం ఎక్కువ అయితే ద్రావణం ధనాత్మక విచలనాన్ని ప్రదర్శిస్తుంది.
ధనాత్మక విచలనం ప్రదర్శించే ద్రావణాలలో ఉష్ణం గ్రహించబడుతుంది. కనుక ఈ ద్రావణాలకు ∆Hద్రా > 0.
ప్రశ్న 11.
రౌల్ట్ నియమం నుండి ఋణాత్మక విచలనం అంటే ఏమిటి? రౌల్ట్ నియమం నుండి ఋణాత్మక విచలనంతో ∆mix H గుర్తు సంబంధం ఎలా ఉంటుంది.
జవాబు:
రౌల్ట్ నియమం ప్రకారం ఏదైనా ద్రావణంలో ఉన్న ప్రతి బాష్పశీల అనుఘటకం యొక్క పాక్షిక బాష్పపీడనం వాటి మోల్ భాగానికి అనులోమానుపాతంలో ఉండును.
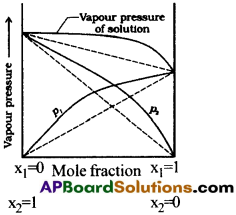
అన్ని గాఢతల అవధులలో రౌల్టనియమాన్ని పాటించే ద్రావణాలను ఆదర్శ ద్రావణాలు అని అంటారు.
అన్ని గాఢతల అవధులలో రౌల్ట్ నియమాన్ని పాటించని ద్రావణాలను ఆదర్శేతర ద్రావణాలు అంటారు. అలాంటి ద్రావణం యొక్క బాష్పపీడనం రౌల్ట్ నియమం ప్రకారం లెక్కించిన దాని కంటే ఎక్కువగాని, తక్కువ గాని ఉంటుంది.
ప్రశ్న 12.
300K ఉష్ణోగ్రత వద్ద నీటి బాష్పపీడనం 12.3 kPa అబాష్పశీల ద్రావణం ఉన్న ఒక మోలాల్ ద్రావణం బాష్పపీడనంను లెక్కించండి.
జవాబు:
ఒక మోలాల్ ద్రావణం అనగా ఒక మోల్ ద్రావితం 1000 గ్రా.ల (H2O) ద్రావణిలో ఉన్నది.
ద్రావితం మోల్ సంఖ్య = 1

ప్రశ్న 13.
బాష్పపీడనాన్ని 80%కు తగ్గించడానికి 114 గ్రా. ల ఆక్టేన్ కరిగించవలసిన అబాష్పశీల ద్రావితం (మోలార్ ద్రవ్యరాశి 40 గ్రా.మో-1) ద్రవ్యరాశిని లెక్కించండి. [IPE ’14]| TS-16] [AP 20]
జవాబు:
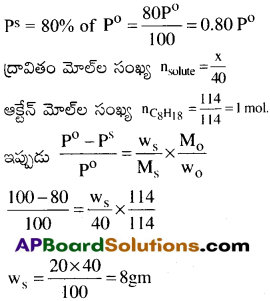
ప్రశ్న 14.
5% చక్కెర నీటి ద్రావణం ఘనీభవన స్థానం 271K. నీటి ఘనీభవన స్థానం 273.15K అయితే గ్లూకోజ్ నీటి ద్రావణం ఘనీభవన స్థానం లెక్కించండి.
జవాబు:
ఇచ్చట ∆Tf = 273.15 – 271 = 2.15 K
చక్కెర యొక్క మోలార్ ద్రవ్యరాశి (C12H22O11) = 342 గ్రా.మోల్-1
5% చక్కెర ద్రావణం అనగా 5 గ్రా.ల చక్కెర 95గ్రా. నీటిలో (100 – 5) ఉన్నది.
ఇప్పుడు చక్కెర మోల్ల సంఖ్య (n) = \(\frac{5}{342}\) = 342
∴ ద్రావణం మోలాలిటీ

సంబంధంను అనువర్తింప చేయగా, ∆Tf = Kf × m
∆Tf = 13.97 × 0.29242 = 4.085 K
కాబట్టి, 5% గ్లూకోజ్ ద్రావణం యొక్క ఘనీభవన స్థానం = 273.15 – 4.085 = 269.065 K.
![]()
ప్రశ్న 15.
300K ఉష్ణోగ్రత వద్ద గ్లూకోజ్ ద్రావణం యొక్క ద్రవాభిసరణ పీడనం 1.52 బార్ అయితే, దాని గాఢత ఎంత? [R = 0.083 L bar mol-1 K-1]
జవాబు:
ద్రవాభిసరణ పీడనం π = CRT
ఇక్కడ ‘C’ మోలారిటీ.
![]()
ప్రశ్న 16.
293K ఉష్ణోగ్రత వద్ద నీటి బాష్పపీడనం 17:535mm Hg. 25గ్రా.ల గ్లూకోజ్న 450 గ్రా.ల నీటిలో కరిగిస్తే వచ్చిన ద్రావణం బాష్పపీడనాన్ని 293K వద్ద గణించండి. [AP-19]
జవాబు:
నీటి, బాష్పపీడనం P0 =17.535 mm
గ్లూకోజ్ భారం a = 25 గ్రా.
గ్లూకోజ్ మోలార్ ద్రవ్యరాశి = M=180 గ్రా. మో-1
నీటి భారం b = 450 g
నీటి మోలార్ ద్రవ్యరాశి = W = 18 g.mol-1
రౌల్ట్ నియమంను అనువర్తించగా,

ప్రశ్న 17.
మోలార్ ద్రవ్యరాశికి, ద్రావణం బాష్పీభవన స్థాన ఉన్నతి ఉన్నతికి ఎలాంటి సంబంధం ఉన్నది.
జవాబు:
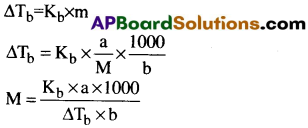
a = గ్రాములలో ద్రావితం భారం
b = గ్రాములలో ద్రావణి భారం
M = ద్రావితం యొక్క మోలార్ ద్రవ్యరాశి
Kb = మోలాల్ బాష్పీభవన స్థాన ఉన్నతి స్థిరాంకం
∆Tb = బాష్పీభవన స్థాన ఉన్నతి
ప్రశ్న 18.
ఆదర్శ ద్రావణం అంటే ఏమిటి? [TS-22]
జవాబు:
అన్ని గాఢతలు మరియు ఉష్ణోగ్రతల వద్ద రౌల్ట్ నియమాన్ని పాటించే ద్రావణాలను ఆదర్శ ద్రావణాలు అంటారు.
∆Hmix = 0, ∆Vmix = 0.
ద్రావితం-ద్రావితం మరియు ద్రావణి – ద్రావణిల మధ్య గల ఆకర్షణ బలాలు ఏవిధంగా ఉండునో అదే ఆకర్షణ బలాలు ఆదర్శ ద్రావణంలో ద్రావితం మరియు ద్రావణికి మధ్య ఉండును.
ప్రశ్న 19.
సాపేక్ష బాష్ప పీడన నిమ్నత అంటే ఏమిటి? ఇది ద్రావితం మోలార్ ద్రవ్యరాశిని నిర్ధారించడానికి ఏవిధంగా ఉపయోగపడుతుంది? [TS 15,16]
జవాబు:
ఆబాష్పశీల ద్రావితంను బాష్పశీల ద్రావణిలో కరిగినప్పుడు, ద్రావణి బాష్పపీడనం తగ్గుతుంది.
శుద్ధ ద్రావణి బాష్పపీడనానికి మరియు ద్రావణం యొక్క బాష్పపీడనానికి మద్య గల బేధాన్ని బాష్పపీడన నిమ్నత అంటారు (LVP)
గణితాత్మకంగా, (P0 – Ps) = ∆p
బాష్పపీడన నిమ్నతకు (∆P) శుద్ధ ద్రావణి బాష్పపీడనానికి (P0) మధ్య గల నిష్పత్తిని సాపేక్ష బాష్పపీడన నిమ్నత అంటారు.
రౌల్ట్ నియమం ప్రకారం, RLVP = XB (మోల్ భాగం)
⇒ \(\frac{P^0-P^s}{P^o}=\frac{a}{M} \times \frac{W}{b}\)
ఈ సమీకరణం నుండి ద్రావితం యొక్క మోలార్ ద్రవ్యరాశి (M) లెక్కిస్తారు.
![]()
ప్రశ్న 20.
మోలార్ ద్రవ్యరాశికి ద్రావణం ఘనీభవన స్థాన నిమ్నతకు ఎలాంటి సంబంధం ఉన్నది?
జవాబు:
మోలార్ ద్రవ్యరాశికి ద్రావణం ఘనీభవన స్థాన నిమ్నతకు మధ్య గల సంబంధం
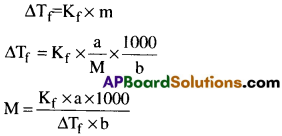
a= గ్రాములలో ద్రావిత భారం
b = గ్రాములలో ద్రావణి భారం
M = ద్రావితం యొక్క మోలార్ ద్రవ్యరాశి
Kf = మోలాల్ ఘనీభవన స్థాన నిమ్నత స్థిరాంకం
∆Tf = ఘనీభవన స్థాన నిమ్నతి
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
2% అబాష్పశీల ద్రావిత జలద్రావణం, ద్రావణి సాధారణ బాష్పీభవన స్థానం వద్ద 1.004 బార్ పీడనాన్ని కలుగచేస్తుంది. ద్రావితం మోలార్ ద్రవ్యరాశి ఎంత?
జవాబు:
ద్రావణం బాష్పపీడనం Ps = 1.004 బార్
సాధారణ బాష్పీభవన స్థానం వద్ద నీటి బాష్పపీడనం P0 = 1.013 బార్
ద్రావితం భారం(a) = 2గ్రా.
ద్రావణి భారం (b) = 100 – 2 = 98 గ్రా.
ద్రావణి మోలార్ ద్రవ్యరాశి W = 18 గ్రా. మోల్-1.
ద్రావితం మోలార్ ద్రవ్యరాశి(M) = ?
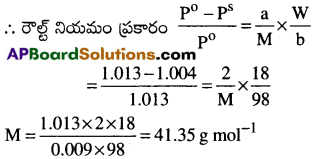
ప్రశ్న 2.
హెప్టేన్ మరియు ఆక్టేన్లు ఆదర్శ ద్రావణాన్ని ఏర్పరుస్తాయి. 373K ఉష్ణోగ్రత వద్ద రెండు ద్రవ ఘటకాల బాష్పపీడనాలు వరుసగా 105.2kPa మరియు 46.8kPa . 26.0 గ్రా.ల హెప్టేన్ మరియు 35.0 గ్రా.ల ఆక్టేన్ కలిసిన మిశ్రమం బాష్పపీడనం ఎంత?
జవాబు:
హెప్టేన్ మోలార్ ద్రవ్యరాశి C7H16 = 100 గ్రా. మో-1
ఆక్టేన్ C8H18 మోలార్ ద్రవ్యరాశి = 114 గ్రా.మో-1
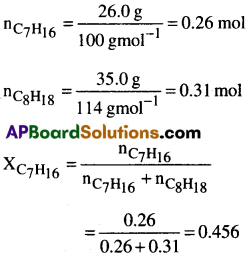

ప్రశ్న 3.
298K ఉష్ణోగ్రత వద్ద 90 గ్రా.ల నీటిలో 30 గ్రా.ల ఆబాష్పశీల ద్రావితం కరిగి ఉన్నది. ఆ ద్రావణం బాష్పపీడనం 2.8 kPa. అంతేకాకుండా 18 గ్రా.ల నీటిని ఆ ద్రావణానికి కలిపితే ఏర్పడిన ఫలిత ద్రావణం యొక్క బాష్పపీడనం 298K వద్ద 2.9kPa అయితే (i) ద్రావితం మోలార్ ద్రవ్యరాశిని (ii) 298K వద్ద నీటి బాష్పపీడనాన్ని లెక్కించండి.
జవాబు:
ద్రావితం యొక్క మోలార్ ద్రవ్యరాశి = MBగ్రా. మోల్-1 అనుకొందాం.
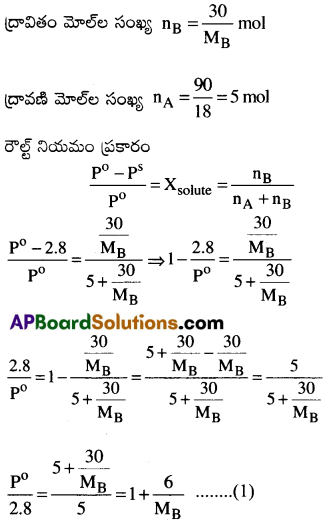
18 గ్రా. నీటిని కలిపిన తరువాత


ప్రశ్న 4.
A మరియు B అనే రెండు మూలకాలు AB2 మరియు AB4 అనే ఫార్ములాలు గల సమ్మేళనాలను ఏర్పరుస్తాయి. 20 గ్రా. ల బెంజీన్లో 1 గ్రా. AB2ను కరిగిస్తే ఘనీభవనస్థాన నిమ్నత 2.3K 10గ్రా.ల AB4ను కరిగిస్తే, ఘనీభవనస్థాన నిమ్నత 1.3K. బెంజీన్ మోలార్ నిమ్నత స్థిరాంకం 5.1 Kkgmol-1. A మరియు B ల పరమాణు ద్రవ్యరాశులను లెక్కించండి.
జవాబు:
AB2 యొక్క ద్రవ్యరాశి WA మరియు మోలార్ ద్రవ్యరాశిగా MA గా తీసుకొంటాము.
AB4 యొక్క ద్రవ్యరాశి WB మరియు మోలార్ ద్రవ్యరాశిగా MBగా తీసుకొంటాము.

A మరియు B ల పరమాణు ద్రవ్యరాశులు వరుసగా ‘a’ మరియు ‘b’ అయినప్పుడు
AB2 మోలార్ ద్రవ్యరాశి a + 2b
= 110.87 గ్రా.మోల్-1…….(1)
AB4 మోలార్ ద్రవ్యరాశి = a + 4b
= 196.15 గ్రా. మోల్-1 …..(2)
సమీకరణం (2) నుండి (1)ను తీసివేయగా,
2b = 85.28 ⇒ b = 42.64
b ని సమీకరణం (1) లో ప్రతిక్షేపించగా,
a + 2 × 42.64= 110.87 (లేదా) a = 25.59
A యొక్క పరమాణు ద్రవ్యరాశి = 25.59 amu
B యొక్క పరమాణు ద్రవ్యరాశి = 42.64 amu
ప్రశ్న 5.
10 గ్రా.ల CH3CH2CHClCOOH ని 250గ్రా.ల నీటికి కలిపినప్పుడు నీటి ఘనీభవన స్థాన నిమ్నతని లెక్కించండి.
[Ka = 1.4 × 10-3, Kf = 1.86 K kgmol-1]
జవాబు:
CH3CH2CHClCOOH యొక్క మోలార్ ద్రవ్యరాశి = 122.5 గ్రా.మోల్-1.
CH3CH2CH(Cl)COOH యొక్క మోల్ల సంఖ్య


![]()
ప్రశ్న 6.
19.5 గ్రా.ల CH2FCOOH ని 500 గ్రా. నీటిలో కరిగించారు. పరిశీలనలో నీటి ఘనీభవన స్థాన నిమ్నత 1.0°C ఉంది. వాంట్ హోప్ గుణకాన్ని మరియు ఫ్లోరో ఎసిటిక్ ఆమ్లం వియోజన స్థిరాంకాన్ని లెక్కించండి.
జవాబు:
వాంట్ హోఫ్ గుణకాన్ని లెక్కించుట:
ఫ్లోరో ఎసిటిక్ ఆమ్లం యొక్క మోలార్ ద్రవ్యరాశి F.CH2COOH = 78 గ్రా.మోల్-1
ఫ్లోరో ఎసిటిక్ ఆమ్లం మోల్లల సంఖ్య

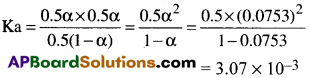
ప్రశ్న 7.
100 గ్రా.ల A ద్రవాన్ని (మోలార్ ద్రవ్యరాశి 140 గ్రా.మోల్-1) 1000 గ్రా.ల B ద్రవంలో (మోలార్ ద్రవ్యరాశి 180 గ్రా.మోల్-1) కరిగించారు. శుద్ధ ద్రవం B బాష్పపీడనం 500 టార్స్, ద్రావణం మొత్తం బాష్పపీడనం 475 టార్స్ అయితే శుద్ధ ద్రవం A బాష్పపీడనం, ద్రావణంలో దాని బాష్పపీడనాన్ని లెక్కించండి.
జవాబు:
శుద్ధ ద్రవం A, బాష్పపీడనాన్ని లెక్కించుట (P°A)

ద్రావణంలో ద్రవం A యొక్క బాష్పపీడనం (PA)
PA = P°AXA = 280.5 × 0.1139 = 32 టార్
ప్రశ్న 8.
27°C వద్ద ద్రవాభిసరణ పీడనం 0.75 అట్మా ఉండాలంటే 2.5 లీ. నీటిలో కరిగించవలసిన CaCl2 (i = 2.47) ఘనపరిమాణాన్ని నిర్ధారించండి.
జవాబు:

CaCl2 యొక్క మోలార్ ద్రవ్యరాశి = 111 గ్రా. మేల్-1
∴ కరిగియున్న CaCl2 పరిమాణం
= మోల్ల సంఖ్య × CaCl2 మోలార్ ద్రవ్యరాశి
= 0.0308 × 111 = 3.42.
ప్రశ్న 9.
25°C వద్ద 25 మి.గ్రాల K2SO4 ని రెండు లీటర్ల నీటిలో కరిగించగా వచ్చిన ద్రావణంలో K2SO4 పూర్తిగా వియోజనం చెందిందనుకొని ద్రవాభిసరణ పీడనాన్ని నిర్థారించండి.
జవాబు:
కరిగిన K2SO4 = 25 మి. గ్రా. = 0.25 గ్రా.
ద్రావణం ఘనపరిమాణం = 2L, T = 25°C = 298K
K2SO4 మోలార్ ద్రవ్యరాశి = 174 గ్రా. మోల్-1.
ఇప్పుడు K2SO4 పూర్తిగా వియోజనం చెందితే

![]()
ప్రశ్న 10.
సంఘటనం పూర్తి అవధిలో బెంజీన్, టోలిన్ ఆదర్శ ద్రావణాన్ని ఏర్పరుస్తాయి. 300K ఉష్ణోగ్రత వద్ద శుద్ధ బెంజీన్ మరియు టోలీన్ ల బాష్ప పీడనాలు వరుసగా 50.71 మి.మీ. Hg మరియు 32.06 మీ.మీ Hg. 80 గ్రా.ల బెంజీన్ని 100 గ్రా.ల టోలీన్ కలిపితే బాష్పప్రావస్థలో ఉన్న బెంజీన్ మోల్ భాగాన్ని లెక్కించండి.
జవాబు:
బెంజీన్ (C6H6) మోలార్ ద్రవ్యరాశి = 78 గ్రా. మోల్-1
టోలీన్ (C7H8) మోలార్ ద్రవ్యరాశి = 92 గ్రా.మోల్-1
∴ nC6H6 = \(\frac{80}{78}\) = 1.026 mol

ప్రశ్న 11.
500 ml ల 0.1 M ద్రావణంను తయారు చేయుటకు కావల్సిన గ్లూకోజ్ భారమును లెక్కించండి. [TS 16]
జవాబు:
దత్తాంశం నుండి V = 500ml, M = 0.1M,
గ్లూకోజ్ పరమాణువు భారం = 180, W = ?
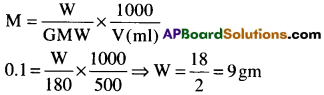
ప్రశ్న 12.
కణాధార ధర్మాలు అంటే ఏమిటి? ఒక దానిని తెలపండి. [AP 20]
జవాబు:
ద్రావణంలో కరిగి ఉండే ద్రావితం కణాల సంఖ్య (అయాన్లు లేదా అణువులు) మీద ఆధారపడి ఉండే విలీన ద్రావణాల ధర్మాలను కణాధార ధర్మాలు అంటారు.
- ద్రావణం సాపేక్ష భాష్పపీడన నిమ్నత(RLVP)
- ఆస్మాటిక్ పీడనం (ద్రవాభిసరణ పీడనం) (T)
- బాష్పీభవన స్థాన ఉన్నతి (∆Tb)
- ఘనీభవన స్థాన నిమ్నత(∆Tf)
Textual Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
ద్రవ్యరాశిపరంగా 20% (C2H6O2) గల ద్రావణంలో ఇథిలీన్ గ్లైకాల్ C2H6O2 మోల్భాగాన్ని లెక్కించండి.
సాధన:
100 g ద్రావణం ఉందనుకొందాం. ద్రావణంలో 20 g
ఇథిలీన్ గ్లైకాల్, 80 g నీరు ఉంటాయి. [TS-15,18 19]
C2H6O2 మోలార్ ద్రవ్యరాశి [AP19]
= 12 × 2 + 1 × 6 + 16 × 2 = 62 g mol-1.

నీటి మోల్భాగాన్ని గ్లైకాల్ మోల్భాగంతో ఈ విధంగా కూడా లెక్కించవచ్చు.: 1 – 0.068 = 0.932
ప్రశ్న 2.
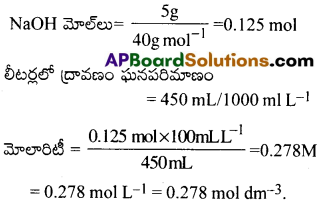
5 g NaOH 450 ml ద్రావణంలో ఉంటే ఆ ద్రావణం మోలారిటీని లెక్కించండి. [TS-15,19,20]
సాధన:
ప్రశ్న 3.
75g ల బెంజీన్ లో 2.5 g ఇథనోయిక్ ఆమ్లం (CH3COOH) మోలాలిటీని లెక్కించండి. [TS 15]
సాధన:
C2H4O2 మోలార్ ద్రవ్యరాశి [AP 17]
: 12 × 2 + 1 × 4 + 16 × 2 = 600gmol-1.

![]()
ప్రశ్న 4.
ఒక నిర్ధిష్ట ఉష్ణోగ్రత వద్ద శుద్ధ బెంజీన్ బాష్పపీడనం 0.850 bar. 0.5 g బరువు గల అబాష్పశీల అవిద్యుద్విశ్లేష్య పదార్థం39.0 g బెంజీన్ కి(78 g mol-1 మోలార్ ద్రవ్యరాశి). కలిపారు. అప్పుడు ద్రావణం బాష్పపీడనం 0.845 bar. ఘనపదార్థం మోలార్ ద్రవ్యరాశి ఎంత? [AP 16]
సాధన:
p°1 = 0.850bar, p = 0.845 bar
M1 = 78 g mol-1
w2 = 0.5g, w1 = 39g అని మనకు తెలుసు
పై విలువలను క్రింది సమీకరణంలో ప్రతిక్షేపిస్తే
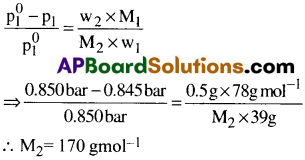
ప్రశ్న 5.
45g ల ఇథిలీన్ గ్లైకాల్(C2H6O2) 600g నీటితో కలిపారు.
(a) ఘనీభవనస్థాన నిమ్నత
(b) ద్రావణం ఘనీభవన స్థానం లెక్కించండి.
సాధన:
ఘనీభవనస్థాన నిమ్నతకు మోలాలిటీతో సంబంధం ఉంది. అందువల్ల ద్రావణం మోలాలిటీ ఇథిలీన్ గ్లైకాల్ పరంగా


ఘనీభవనస్థాన నిమ్నత
∆Tf = 186K kg mol-1 × 1.2 mol kg-1 = 2.2K
జలద్రావణం ఘనీభవనస్థానం = 273.15K – 2.2K
= 270.95K
ప్రశ్న 6.
1.00 g అబాష్పశీల ద్రావితాన్ని 50 g బెంజీన్లో కరిగిస్తే బెంజీన్ ఘనీభవనస్థానం 0.40 K. తగ్గింది. బెంజీన్ ఘనీభవనస్థాన నిమ్నత స్థిరాంకం 5.12K kg mol-1 ద్రావితం మోలార్ ద్రవ్యరాశి కనుక్కోండి.
సాధన:
విలువలను క్రింది సమీకరణంలో ప్రతిక్షేపించగా
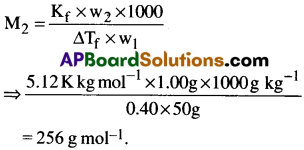
ఆ విధంగా ద్రావితం మోలార్ ద్రవ్యరాశి = 256 g mol-1
ప్రశ్న 7.
200 cm³ ప్రోటీన్ జలద్రావణంలో 1.26 g ల ప్రోటీన్ ఉంది 300 K వద్ద ఆ ద్రావణం ద్రవాభిసరణపీడనం 2.57 × 10-3 bar. ప్రోటీన్ మోలార్ ద్రవ్యరాశి
గణించండి
సాధన:
మనకు తెలిసిన రాశులు:
π = 2.57 × 10-3 bar
V = 200 cm³ = 0.200 litre T = 300 K
R = 0.083 L bar mol-1 K-1.
విలువలను క్రింది సమీకరణంలో ప్రతిక్షేపించగా
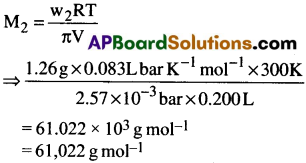
![]()
ప్రశ్న 8.
2 gల బెంజోయిక్ ఆమ్లాన్ని (C6H5COOH) 25 g ల బెంజీన్లో కరిగిస్తే 1.62 K. ఘనీభవనస్థాన నిమ్నతని చూపిస్తుంది. బెంజీన్ మోలాల్ నిమ్నత -స్థిరాంకం 4.9 K kg mol-1. అది ద్రావణంలో ద్విఅణుకం ఏర్పరిస్తే ఆమ్లం సాహచర్య శాతం ఎంత?
సాధన:
ఇచ్చిన రాశులు: w2 = 2 g;
Kf = 4.9 K kg mol-1; w1 = 25 g,
∆Tf = 1.62 K
విలువలను క్రింది సమీకరణంలో ప్రతిక్షేపించగా

ఆ విధంగా బెంజీన్లో బెంజోయిక్ ఆమ్ల ప్రయోగాత్మక మోలార్ ద్రవ్యరాశి = 241.98 g mol-1
ఆమ్లానికి ఈ కింది సమతాస్థితిని చూపండి:
![]()
ద్రావితం సాహచర్య అవధి X అయితే (1-x) మోల్ బెంజోయిక్ ఆమ్లం సాహచర్యం కాకుండా ఉంటుంది. సమతాస్థితి వద్ద దీనికి అనుగుణంగా X/2 మోల్ సాహచర్యం జరిగి ఉంటుంది.
అందువల్ల సమతాస్థితి వద్ద మొత్తం, కణాల మోత్ల సంఖ్య 1 – x + \(\frac{x}{2}\) = 1 – \(\frac{x}{2}\)
సమతాస్థితి వద్ద మొత్తం కణాల మోల్ల సంఖ్య వాంటాఫ్ గుణకానికి i సమానం. కానీ
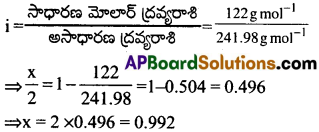
∴ బెంజీన్లో బెంజోయిక్ ఆమ్లం సాహచర్య అవధి 99.2%.