Students get through AP Inter 1st Year Chemistry Important Questions 13th Lesson కర్బన రసాయన శాస్త్రం – సామాన్య సూత్రాలు, విధానాలు which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 13th Lesson కర్బన రసాయన శాస్త్రం – సామాన్య సూత్రాలు, విధానాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
బెంజీన్ ను మీథైల్ బెంజీన్ గా మార్చడానికి అవసరమైన కారకాలు రాయండి. [Imp.Q]
జవాబు:
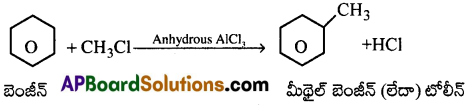
పైచర్యలో క్రియాజనకాలు బెంజీన్, మిథైల్ క్లోరైడ్.
ప్రశ్న 2.
నైట్రోబెంజీన్ ను ఎలా తయారుచేస్తారు? [Imp.Q]
జవాబు:
బెంజీను నైట్రేషన్ మిశ్రమం (గాఢ . HNO3 మరియు గాఢ H2SO4) తో 60°C కన్న తక్కువ ఉష్ణోగ్రత వద్ద చర్య జరుపగా నైట్రోబెంజీన్ ఏర్పడుతుంది.
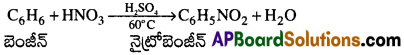
ప్రశ్న 3.
ఈథేన్ అనురూపకాలను రాయండి. [Imp.Q]
జవాబు:
ఈథేన్ అణువులో ఒక కర్బన పరమాణువు స్థానమును స్థిరీకరించి, రెండవ కర్బన పరమాణువును బంధ అక్షముపై చక్ర భ్రమనము చేయుటవలన అనేక ప్రాదేశిక అమరికలు గల రూపముల లభించును. వాటిలో రెండు ప్రధాన అనురూపాత్మకలు ఉండును 1. అస్తవ్యస్త ఆకృతి (Staggered conformation) 2. గ్రహణ ఆకృతి (Eclipsed conformation)
ప్రశ్న 4.
ఇథిలీన్ నుంచి ఈథైల్ క్లోరైడ్ను ఎలా తయారుచేస్తారు? [Imp.Q]
జవాబు:
ఇథిలీన్ ను హైడ్రోజన్ క్లోరైడ్తో సంకలనం చేయగా ఈథైల్రోక్లోరైడ్ ఏర్పడుతుంది.

ప్రశ్న 5.
కింది నిర్మాణాల IUPAC నామాలు రాయండి: [AP 18][AP,TS 16,18][Imp.Q]
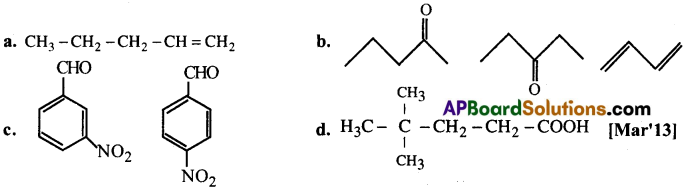
జవాబు:
a. 1-పెంటీన్
b. 2 – పెంటనోన్, 3- పెంటనోన్, 1,3 – బ్యూటడయిన్
c. 3-నైట్రో బెంజీన్ కార్భాల్డీహైడ్, 4-నైట్రో బెంజీన్ కార్భాల్డీ హైడ్
d. 3,3 డైమిథైల్ బ్యూటనాయిక్ ఆమ్లం
![]()
ప్రశ్న 6.
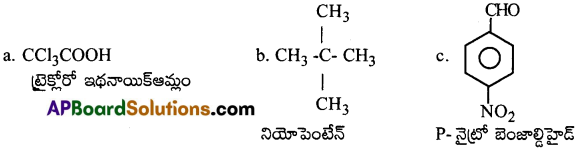
కింది వాటి నిర్మాణాలను రాయండి: a. ట్రైక్లోరో ఇథనాయిక్ ఆమ్ల b. నియోపెంటేన్ c. నైట్రోబెంజాల్డిహైడ్ [Mar’ 13][TS 22]
జవాబు:
ప్రశ్న 7.
లాసజీన్ చర్యను వివరించండి.
జవాబు:
లాసైన్ పరీక్ష (లేదా) సోడియం నిష్కర్షణ పరీక్ష :
లాసైన్ పరీక్షలో సమ్మేళనాన్ని ఒక జ్వలన నాళికలో సోడియం లోహంతో పాటు తీసుకుని నాళిక ఎర్రగా మారే వరకు వేడిచేస్తే సమ్మేళనం, సోడియం కరుగుతాయి. ఎర్రని వేడి జ్వలన నాళికను స్వేదన జలంలో ముంచి పైన వచ్చిన కరిగిన ద్రవ్యరాశిని నీటితో నిష్కర్షణ చేసి ద్రావణాన్ని పది నిమిషాల పాటు మరిగించి వడపోయాలి. గాలిత ద్రవాన్ని సోడియం నిష్కర్షణ అంటారు.
Na + C + N → NaCN
2Na + S → Na2S
Na + X → Na X(X = Cl, Br or 1)
ప్రశ్న 8.
క్రోమటోగ్రఫీ సిద్ధాంతాన్ని వివరించండి. [Imp.Q]
జవాబు:
క్రొమటోగ్రఫీని ఒక మిశ్రమంలోని అనుఘటకాలను స్థిర ప్రావస్థ, చలన శీల ప్రావస్థ అనే రెండు ప్రావస్థితి మధ్య వేరు పరిచే విధానంగా అభివృద్ధి చేశారు. క్రొమటోగ్రఫీలో క్రింద పేర్కొన్న మూడు దశలు ఇమిడి వుంటాయి.
a) స్థిర ప్రావస్థ మిశ్రమంలోని అనుఘటకాలను అదిశోషించుకుని స్థిరంగా పట్టి వుంచుతుంది. చలన శీల ప్రావస్థ అదిశోషించుకోబడిన అనుఘటకాలను వేరు పరిచి స్థిర ప్రావస్థపై విభిన్న దూరాలను తీసుకునిపోతుంది.
b) పైవిధంగా వేరుపర్చబడి అనుఘటకాలను చలనశీల ప్రావస్థను ఆపకుండా పంపి తిరిగి పొందడం. దీనినే నిక్షాలన పద్ధతి అంటారు.
c) గుణాత్మక, పరిమాణాత్మక విశ్లేషణల ద్వారా నిక్షాళన చేసి సాధించిన సమ్మేళనాలను తెలుసుకోవడం.
ప్రశ్న 9.
జలభాష్ప స్వేదనంలో కర్మన ద్రవం దాని భాష్పీభవన స్థానం కంటే తక్కువ ఉష్ణోగ్రత వద్ద ఎందుకు ఆవిరిగా మారుతుంది? [Imp.Q]
జవాబు:
జలభాష్ప స్వేదనం:
ఈ పద్ధతిలో నీటిలో కరగని, బాష్పీభవన స్థానం ఎక్కువగా ఉన్న, జల భాష్పంతో బాష్పశీలత పొందే ద్రవాల్ని శుద్ధి చేస్తారు. ఈ విధానంలో వేడి, మలిన ద్రవంలోకి నీటి ఆవిరిని పంపుతారు. నీటి, ఆవిర, ద్రవపు భాష్పం కలిసి బయటకొస్తాయి. దీనికి కారణం నీటి భాష్పం, ద్రవ భాష్పం రెండింటి మొత్తం పీడనం బాహ్యా వాతావరణ పీడనానికి సమానమవడమే. ఈ నీటి ఆవిరి ద్రవ భాష్పం రెండూ కండెన్సర్ ద్వారా ప్రయాణించి ద్రవ మిశ్రమమై సంగ్రహణ పాత్రలో చేరతాయి. అవి ఒకదానితో ఒకటి కలిసిపోవు కాబట్టి వేర్పాటు గరాటుతో వేరు చేయవచ్చు.
ప్రశ్న 10.
కింది వాటిని వివరించండి. (a) స్ఫటికీకరణం (b) స్వేదనం
జవాబు:
a) స్ఫటికీకరణం (Crystallisation):
ఇందులోఉన్న సూత్రం ఇచ్చిన ద్రావణిలో మలినాలు అసలు కరగకపోవడం లేదా ఏ ఉష్ణోగ్రతా దగ్గరైనా పూర్తిగా కరగడం గాలితం లోకి రావడం కర్బన రసాయన పదార్థం మాత్రం గది ఉష్ణోగ్రత వద్ద ఆ ద్రావణిలో దాదాపు కరగకుండా ఎక్కువ ఉష్ణోగ్రత వద్ద అంటే ద్రావణి బాష్పీభవన ఉష్ణోగ్రత దగ్గర కరిగిపోవడం.
b) స్వేదనం (Distillation):
కొన్ని ఘనపదార్థాలు వేడి చేసినప్పుడు కరిగి ద్రవస్థితికి రాకుండా నేరుగా భాష్పస్థితికి వెళ్ళడం మనకు తెలుసు. ఆ భాష్పాలు తిరిగి చల్లబరచినప్పుడు ద్రవంగా ద్రవీకరణం చెందకుండా నేరుగా ఘనపదార్థాన్నిస్తాయి. ఈ విధానాన్నే స్వేదనం అంటారు.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
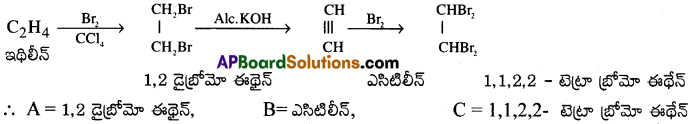
ప్రశ్న 1.
కింది చర్యలను పూరించి A,B,C ఉత్పన్నాల నామాలు రాయండి. [IPE ’14][TS 15][AP,TS 16]
![]()
జవాబు:

![]()
ప్రశ్న 2.
క్రింది సమీకరణంలో A,B,C ఉత్పన్నాల పేర్లు రాసి సమీకరణాలు పూరించండి ? [Mar’09][TS 15]
![]()
జవాబు:
ప్రశ్న 3.
ప్రతిక్షేపణ చర్యలు అనగానేమి? బెంజీన్ యొక్క రెండు ప్రతిక్షేపణ చర్యలను వివరించండి? [May 10]
జవాబు:
ప్రతిక్షేపణ చర్యలు :
ఒక సమ్మేళనంలోని పరమాణువులు లేదా గ్రూపు వేరొక పరమాణువు లేదా గ్రూపుతో స్థానభ్రంశం చెందించిన దానిని ప్రతిక్షేపణ చర్యలు అని అంటారు.
బెంజీన్ ప్రతిక్షేపణ చర్యలు :
a) బెంజీన్ క్లోరిన్ లేదా బ్రోమిన్ తో సమక్షంలో చర్యజరిపి హలోబెంజీన్ న్ను ఇస్తుంది.
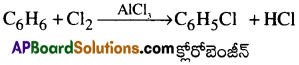
b) బెంజీన్ నైట్రేషన్ మిశ్రమంతో 60°C వద్ద వేడిచేసిన నైట్రోబెంజీన్ ను ఏర్పరుస్తుంది.

ప్రశ్న 4.
డిహైడ్రో హలోజనీకరణం అనగానేమి? ఆల్కైల్ హాలైడ్ నుండి ఆల్కీన్ ఏర్పడే చర్యలకు సమీకరణం రాయండి.
జవాబు:
ఒక కర్బన సమ్మేళనంలో హైడ్రోజన్ మరియు హలోజన్లను ఆసన్న కార్బన్ల నుండి తొలగించడాన్ని డీ హైడ్రో హలోజనీకరణం అంటారు.
ఆల్కైల్ హాలైడ్ నుండి ఆల్కీన్ ఏర్పడుట :
ఇథైల్ బ్రోమైడ్ను ఆల్కహాలిక్ తో వేడిచేసినపుడు డీ హైడ్రో హలోజనీకరణం జరిగి ఇథిలీన్ ను ఇస్తుంది.
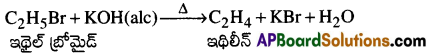
ప్రశ్న 5.
ఒజోనీకరణం అంటే ఏమిటి? ఎలాంటి కర్బన సమ్మేళనాలు ఓజోన్ తో చర్య జరుపుతాయి? ఉదాహరణతో వివరించండి?
జవాబు:
ఓజోన్ అసంతృప్త హైడ్రో కార్బన్లతో సంకలన చర్య జరిపి ఒజోనైడ్ల నిస్తాయి. ఈ ఓజోనైడ్ ను జలవిశ్లేషణం చెందించిన కార్బొనిల్ సమ్మేళనాలను ఇస్తాయి. ఈ విధానాన్ని ఒజొనీకరణం అంటారు.
అసంతృప్త హైడ్రోకార్బన్లు సాధారణంగా ఓజోన్తో చర్యజరుపుతాయి. ఒజొనీకరణ విధానాన్ని సాధారణంగా అసంతృప్త హైడ్రోకార్బన్లు అనగా ఆల్కీన్, ఆల్కైన్ మరియు బెంజీన్ లో ద్విబంధం గల మూలకాలను ఉపయోగిస్తారు.
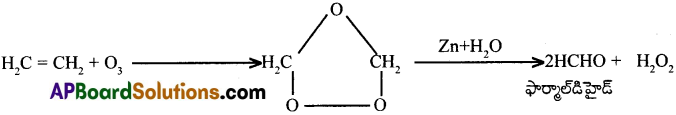
ఉదా1 :
ఇథిలీన్, ఓజోన్తో సంకలన చర్య జరిపి ఒజోనైన్నిస్తుంది. ఇది Zn పొడి సమక్షంలో జలవిశ్లేషణం చెంది ఫార్మాల్డిహైడ్ మరియు H2Oలను ఇస్తుంది.
ఉదా2:
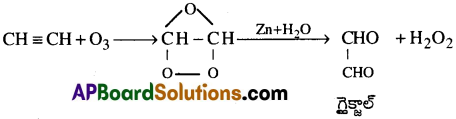
ఎసిటిలిన్ ఒజోన్ తో చర్య జరిపి ఎసిటిలిన్ ఒజోనైడ్ను ఏర్పరుచును. Zn సమక్షంలో దీనిని జలవిశ్లేషణ చేయగా గైక్జాల్ ఏర్పడును.
ప్రశ్న 6.
మీథేన్ హాలోజనీకరణం చర్యాగతిని రాయండి.
జవాబు:
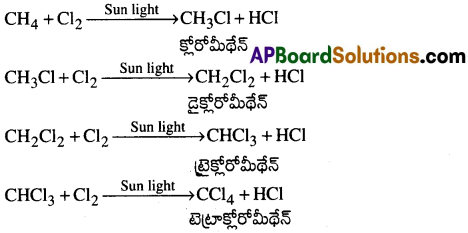
మీథేన్ హాలోజనీకరణం:
మీథేన్ సూర్యకాంతి సమక్షంలో క్లోరిన్తో చర్య జరుపగా అనేక ప్రతిక్షేపణ ఉత్పన్నాలు ఏర్పడతాయి. ఈ చర్యలలో ప్రతి దశలోనూ మీథేన్ లోని ఒక హైడ్రోజన్, క్లోరిన్ పరమాణువుచే ప్రతిక్షేపించబడి మోనోక్లోరో మీథేన్, డైక్లోరో మీథేన్, ట్రైక్లోరో మీథేన్ మరియు టెట్రాక్లోరో మీథేన్ ఏర్పడును.
చర్యావిధానం:
హాలోజనీకరణం స్వేచ్ఛా ప్రాతిపదికా శృంఖల విధానంలో జరుగుతుంది. ఈ చర్యా విధానం 3 అంచెలలో ప్రారంభం, వ్యాప్తి విస్తరణ, ముగింపుగా ఉంటుంది.
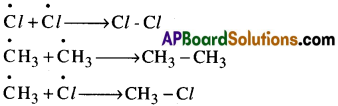
(i) చర్యాప్రారంభం(Initiation):
క్లోరిన్ అణువును కాంతికి కానీ, ఉష్ణానికి కానీ గురిచేస్తే స్వేచ్ఛా ప్రాతిపదికలుగా విడిపోతుంది
![]()
(ii) చర్యావ్యాప్తి (propagation):
క్లోరిన్ ప్రాతిపదికలు మీథేన్తో చర్య పొంది C-H బంధ విచ్ఛిత్తి చేసి మీథైల్ రాడికల్, HClను ఏర్పరుస్తాయి..
![]()
ఈ మీథైల్ రాడికల్ రెండో క్లోరిన్ అణువుతో చర్యపొంది CH3Cl ను ఏర్పరుస్తుంది. క్లోరిన్ అణువు సమవిచ్ఛిత్తి వల్ల ఇంకొక క్లోరిన్ ప్రాతిపదికను ఇస్తుంది.
![]()
ఇలా ఏర్పడిన క్లోరిన్, మీథైల్ స్వేచ్ఛాప్రాతిపదికలు (a) మరియు (b)చర్యలను మళ్ళీమళ్ళీ జరిపి శృంఖల చర్యగా మారుస్తాయి. చర్యావ్యాప్తి చర్యలతో పాటు అనేక ఇతర చర్యావ్యాప్తి చర్యలు జరిగే వీలుండటం వలన ఆ చర్యలు కూడా జరగవచ్చు.
(iii)చర్యముగింపు (termination):
క్రియాజనకం పూర్తిగా చర్యలో పాల్గొని ఇంక ఏమీ మిగలకపోవడం వల్ల గాని లేదా కింది పక్క చర్యల వల్ల గాని శృంఖల చర్యలు అంతమవుతాయి.
![]()
ప్రశ్న 7.
కింది వాటితో ఎసిటిలిన్ చర్యలను వివరించండి. (a) Na NH3 (b) క్రోమిక్ ఆమ్లం సమీకరణాలను, ఉత్పన్నాల పేర్లను రాయండి.
జవాబు:
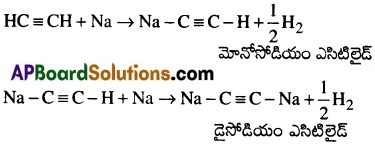
(a) అమ్మోనియాలో సోడియం లోహంతో చర్య:
ఎసిటిలీన్ పై కారకంతో చర్య నొంది మోనోసోడియం ఎసిటిలైడ్ మరియు డైసోడియం ఎసిటిలైడ్లనిస్తుంది.
(b) క్రోమిక్ ఆమ్లంతో చర్య:
క్రోమిక్ ఆమ్లంతో ఎసిటిలిన్ ఆక్సీకరణానికి లోనై ఎసిటిక్ ఆమ్లమునిచ్చును.

Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ఈథేన్, ఈథీన్, ఎసిటిలీన్ మరియు బెంజీన్ తయారు చేయు పద్ధతులు మరియు ధర్మాలు
I. ఈథేన్ (C2H6) :
ప్రశ్న 1.
a) ఈథేన్ తయారుచేయు పద్ధతులను వ్రాయండి. [AP 17] [TS 22]
b) ఈథేన్ రసాయన ధర్మాలను ఉదాహరణలతో వివరించండి.
జవాబు:
a) ఈథేన్ తయారుచేయు పద్ధతులు:
1. డీ – కార్బాక్సిలీకరణం :
సోడియం ప్రొపనోయేట్ను, సోడాలైమ్తో వేడిచేస్తే ఈథేన్ వస్తుంది. (సోడాలైమ్ అనగా NaOH మరియు CaO ల మిశ్రమం)
![]()
2. ఉర్జ్ చర్య :
మిథైల్ అయొడైడ్ను, సోడియం లోహంతో పొడి ఈథర్ సమక్షంలో వేడిచేసినప్పుడు ఈథేన్ ఏర్పడుతుంది.
![]()
3. కోల్బే విద్యుద్విశ్లేషణ :
సోడియం లేదా పొటాషియం ఎసిటేట్ ద్రావణాన్ని విద్యుద్విశ్లేషణ చేస్తే ఈథేన్ వస్తుంది.
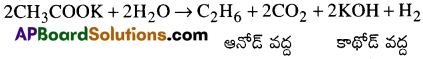
4. సబటీర్-సండరీన్ చర్య:
ఇథిలీన్ ను ఉత్ప్రేరకం సమక్షంలో హైడ్రోజనీకరణం చేసి, ఈథేన్ ను పారిశ్రామికంగా తయారుచేస్తారు.
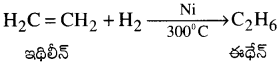
5. ఇథైల్ అయొడైడ్ను క్షయకరణం చేయడం :
ఇథైల్ అయొడైడ్ను Zn మరియు HCI సమక్షంలో క్షయకరణం చెందించి ఈథేన్ను తయారుచేయవచ్చు.
![]()
b) ఈథేన్ రసాయన ధర్మాలు :
(i) క్లోరినేషన్:
ఈథేను, క్లోరిన్తో సూర్యకాంతి లేదా UV కాంతి సమక్షంలో చర్య జరిపినప్పుడు ఇథైల్ క్లోరైడ్ వస్తుంది.
![]()
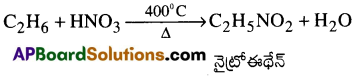
(ii) నైట్రేషన్ (లేదా) నైట్రోజనీకరణం :
ఈథేన్ ను, నైట్రిక్ ఆమ్లంతో 400°C వద్ద వేడిచేసినప్పుడు నైట్రో ఈథేన్ ఏర్పడుతుంది.
(iii) ఆక్సీకరణం :
ఈథేన్ను గాలిలో మండించిన CO2 మరియు H2O లు ఏర్పడును.
![]()
II. ఇథిలీన్ లేదా ఈథీన్ (C2H4)
ప్రశ్న 2.
a) ఇథిలీన్ లేదా ఈథీన్ తయారుచేయు పద్ధతులను వ్రాయండి.
b) ఈథీన్ రసాయన ధర్మాలను ఉదాహరణలతో వ్రాయండి. [IPE ‘10,11,13,14][AP 16,19][TS 18]
జవాబు:
ఇథిలీన్ తయారుచేయు పద్ధతులు :
i) డీ-హైడ్రేషన్ :
ఇథైల్ ఆల్కహాల్ను గాఢ సల్ఫ్యూరికామ్లంతో 170°C వద్దకు వేడిచేస్తే ఇథిలీన్ ఏర్పడుతుంది.
![]()
ii) డీహైడ్రో హలోజనీకరణం:
ఇథైల్ క్లోరైడ్ను ఆల్కహాలిక్ పొటాషియం హైడ్రాక్సైడ్తో వేడిచేసినపుడు ఇథిలీన్ ఏర్పడుతుంది.
![]()
iii) డీ-హలోజనీకరణం:
1, 2 – డై బ్రోమో ఈథేన్ను జింక్ పొడితో ఆల్కహాల్ ద్రావణంలో వేడిచేస్తే ఇథిలీన్ ఏర్పడుతుంది.
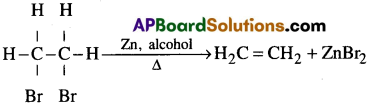
iv) ఎసిటిలీన్ అధీకృత హైడ్రోజనీకరణం చేయడం :
ఎసిటిలీన్ ను లిండ్లార్ ఉత్ప్రేరకం సమక్షంలో హైడ్రోజనీకరణం చేస్తే ఇథిలీన్ ఏర్పడుతుంది.
![]()
b) ఇథిలీన్ రసాయన ధర్మాలు :
(i) 120°C వద్ద ఇథిలీన్్కు Ni ఉత్ప్రేరకం సమక్షంలో హైడ్రోజన్ ను కలుపుట వల్ల ఈథేన్ ఏర్పడుతుంది.
![]()
ii) గది ఉష్ణోగ్రత వద్ద ఇథిలీన్ కు బ్రోమిన్ ను కలుపుట వల్ల ఇథిలీన్ బ్రోమైడ్ ఏర్పడును.

iii) ఇథిలీన్ హైపోక్లోరస్ ఆమ్లంతో చర్య జరిపి ఇథిలీన్ క్లోరో హైడ్రిన్ (2-క్లోరో ఇథనోల్) ను ఏర్పరుచును.
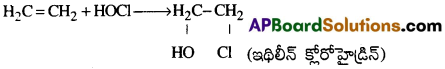
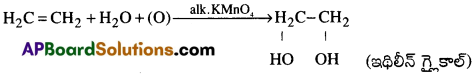
iv) ఇథిలీన్ ను చల్లని, విలీన క్షారయుత KMnO4 ద్రావణం (బేయర్స్ కారకం)తో చర్య జరిపించిన ఇథిలీన్ గ్లైకాల్ (1,2-ఈథేన్ డై ఓల్) ఏర్పడును. (KMnO4 ద్రావణం రంగుపోతుంది) [IPE ’14]
c) ఆక్సిజన్తో చర్య (పాలీమరీకరణం):
అధిక పీడనం వద్ద ఇథిలీన్ ను ఆక్సిజన్ వేడీచేయగా పాలిథీన్ ఏర్పడును.
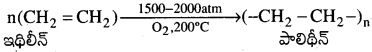
III. ఎసిటిలీన్ (లేదా) ఈథైన్ (C2H2):
ప్రశ్న 3.
ఎసిటిలీన్ తయారుచేయు పద్ధతులను తెలపండి? [TS 18]
జవాబు:
ఎసిటిలీన్ తయారుచేయు పద్ధతులు :
i) కాల్షియం కార్బైడు జలవిశ్లేషణం చెందించి ఎసిటిలీన్ ను తయారుచేయవచ్చు.
CaC2 + 2H2O → Ca(OH)2+ C2H2 ↑
ii) 1, 2 డై బ్రోమో ఈథేను ఆల్కహాలిక్ KOH తో డీ హైడ్రో హలోజనీకరణం జరిపి ఎసిటిలీన్ ను తయారుచేయవచ్చు.
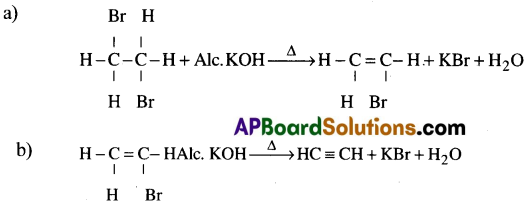
iii) 1,1,2,2–టెట్రా బ్రోమో ఈథేన్ను Zn పొడితో ఆల్కహాల్లో డీహలోజనీకరణం జరిపి ఎసిటిలీన్ ను తయారుచేయవచ్చు.
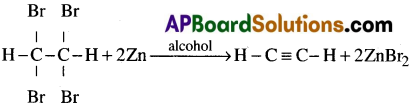
iv) అయొడోఫాంను సిల్వర్ పొడితో చర్య జరిపి ఎసిటిలీన్ ను తయారుచేయవచ్చు.
2CH – I3 + 6Ag → H – C ≡ C – H + 6AgI
![]()
ప్రశ్న 4.
ఎసిటిలీన్ యొక్క ఆమ్ల స్వభావాన్ని వివరించండి?
జవాబు:
ఎసిటిలీన్ ఆమ్ల స్వభావం :
Na లోహంతో చర్య :
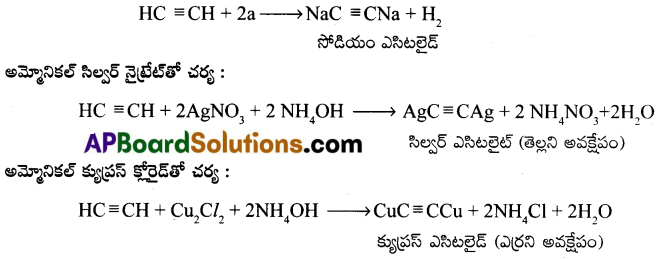
ప్రశ్న 5.
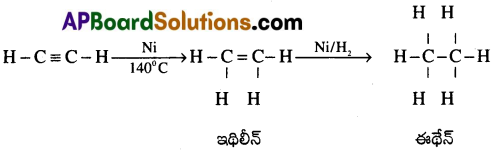
ఎసిటిలీన్ రసాయన ధర్మాలను వ్రాయండి. సమీకరణాలనివ్వండి? [TS 16]
జవాబు:
ఎసిటిలీన్ రసాయన ధర్మాలు :
(i) ఎసిటిలీన్ నికెల్ ఉత్ప్రేరకం సమక్షంలో హైడ్రోజన్తో సంకలనం చెంది ఇథిలీన్, తరువాత ఈథేన్ వస్తుంది.
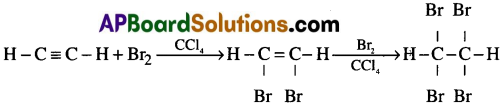
(ii) ఎసిటిలీన్ CCl4 సమక్షంలో బ్రోమిన్తో సంకలనం చెంది చివరగా 1,12,2-టెట్రా బ్రోమో ఈథేన్ ను ఏర్పరుస్తుంది.
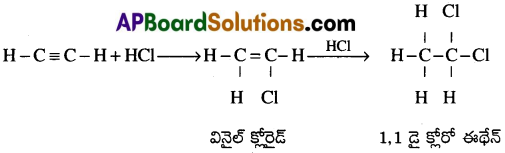
(iii) ఎసిటిలీన్ HClతో సంకలనం చెంది మొదటగా వినైల్ క్లోరైడ్ను మరియు చివరకి ఇథిలిడీన్ క్లోరైడ్ను ఏర్పరుస్తుంది.
(iv) ఎసిటిలీన్ HCN తో సంకలనం చెంది వినైల్ సైనైడ్ (Acrylonitrile) ను ఇస్తుంది.

(v) 60°C వద్ద ఎసిటిలీన్ ను విలీన H2SO4 మరియు HgSO4 ద్రావణంలోకి పంపినపుడు మొదటగా వినైల్ ఆల్కహాల్ ఏర్పడును. ఇది పునరమరిక చెంది ఎసిటాల్డిహైడ్గా మారును. [AP 17][TS 18]
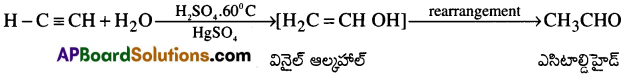
(vi) ఎసిటిలీన్ చల్లని మరియు విలీన క్షారయుత KMnO తో చర్యజరిపి ఆక్జాలిక్ ఆమ్లంను ఏర్పరుస్తుంది.
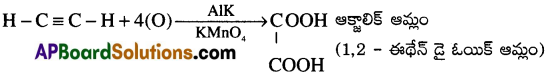
IV. బెంజీన్ (C6H6)
ప్రశ్న 6.
a) బెంజీన్ను (i) బెంజోయిక్ ఆమ్లం (ii) ఎసిటిలీన్ మరియు ఫినాల్ ద్వారా ఎలా తయారుచేస్తారు? b) బెంజీన్ రసాయన ధర్మాలను వివరించండి? [May’09][AP 15,18]
జవాబు:
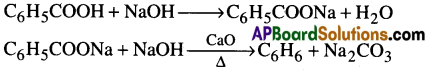
బెంజీన్ తయారుచేయు పద్ధతులు :
i) సోడియం బెంజోయేట్ను సోడాలైమ్ (NaOH + CaO) తో స్వేదనం చెందించితే బెంజీన్ వస్తుంది.
ii) ఎసిటిలీన్ వాయువును ఎర్రగా కాలిన ఇనుప లేదా రాగి గొట్టాల ద్వారా పంపితే బెంజీన్ వస్తుంది.
![]()
iii) ఫినాల్ను జింక్ పొడితో స్వేదనం చేస్తే బెంజీన్ వస్తుంది. [May’11]
![]()
b) బెంజీన్ రసాయన ధర్మాలు :
a) బెంజీను లూయీ ఆమ్లాలు (FeCl3, AlCl3) సమక్షంలో క్లోరిన్తో చర్య జరిపిన క్లోరో బెంజీన్ ఏర్పడుతుంది.
![]()
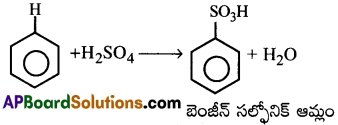
b) బెంజీన్ ను 55 – 60°C వద్ద H2SO4 సమక్షంలో గాఢ HNO3 తో చర్య జరిపిన నైట్రో బెంజీన్ ఏర్పడుతుంది.
![]()
c) బెంజీన్ సధూమ సల్ఫ్యూరిక్ ఆమ్లంతో చర్య జరిపి బెంజీన్ సల్ఫోనిక్ ఆమ్లాన్ని ఇస్తుంది.
![]()
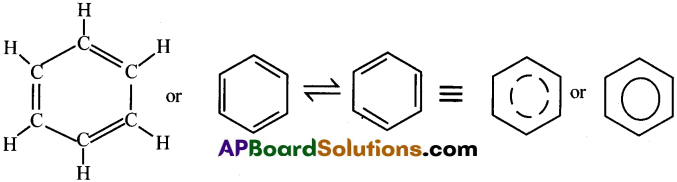
బెంజీన్ (C6H6)నిర్మాణము
బెంజీన్ యొక్క అణు సూత్రము C6H6 అని 1825 లో కనుగొన్నారు. కాని దాని యొక్క అసలు నిర్మాణమును కనుగొనటానికి అనేక సంవత్సరములు పట్టింది. 1865 లో కెకులే అను శాస్త్రవేత్త బెంజీన్ నకు చక్రీయ నిర్మాణం ఉంటుందని ప్రతిపాదించాడు. “ఒక పాము తన తోకను నోటిలో పెట్టుకున్నట్లుగా వచ్చిన ఒక కల” నుండి ఈ నిర్మాణమును కెకులే ప్రతిపాదించారు.
ప్రశ్న 7.
ఎసిటిలీన్ నుంచి బెంజీన్ ఎట్లా ఏర్పడుతుంది? సమీకరణం రాయండి. బెంజీన్ యొక్క హాలోజినేషన్, ఆల్కైలేషన్, ఎసైలేషన్, నైట్రేషన్, సల్ఫోనేషన్ చర్యలను వివరించండి. [AP 15,18,22][TS 17,19]
జవాబు:
ఎసిటిలీన్ నుంచి బెంజీన్ తయారుచేయుట:
ఎసిటిలీన్ వాయువును ఎర్రగా కాలుచున్న కాపర్ గొట్టాల గుండా పంపినపుడు మూడు అణువుల ఎసిటిలిన్ పొలిమరీకరణం చెంది ఏర్పడుతుంది.
![]()
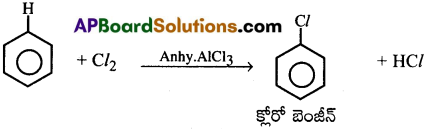
1. హాలోజనీకరణం:
బెంజీన్ ను AlCl3 సమక్షంలో క్లోరిన్తో చర్య జరుపగా క్లోరో బెంజీన్ ఏర్పడుతుంది. [IPE ’14]
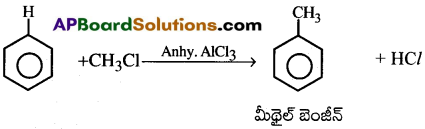
2. ఫ్రీడల్ -క్రాస్ఆల్కైలేషన్ :
బెంజీన్ AlCl3, సమక్షంలో ఆల్కైల్ హాలైడ్లతో చర్య జరిపితే మీథైల్ బెంజీన్ ఏర్పడుతుంది. [IPE ‘13,14]
3. ఫ్రీడల్ -క్రాఫ్ట్ ఎసైలీకరణం :
బెంజీన్ ను లూయీ ఆమ్లం AlCl3 సమక్షంలో ఎసిటైల్ క్లోరైడ్తో చర్య జరిపితే ఎసిటోఫీనోన్ ఏర్పరుస్తుంది.

4. నైట్రేషన్:
బెంజీన్ను గాఢ HNO3 మరియు గాఢ H2SO4 తో 60°C, వద్ద వేడిచేస్తే నైట్రోబెంజీన్ ఏర్పడుతుంది. [May’ 13][AP 17]

5. సల్ఫోనీకరణం:
బెంజీన్ ను సధూమా సల్ఫూరిక్ ఆమ్లం తో వేడిచేస్తే బెంజీన్ సల్ఫోనిక్ ఆమ్లం ఏర్పడుతుంది.
ప్రశ్న 6.
శృంఖల సాదృశ్యము అనగానేమి? ఉదాహరణలిమ్ము? [AP,TS 16]
జవాబు:
శృంఖల సాదృశ్యము :
ఒకే అణుఫార్ములాను కలిగి వుండి, శృంఖలంలోని కార్బన్ పరమాణువుల అమరికలో తేడా వల్ల ఏర్పడే సాదృశ్యాన్ని శృంఖల సాదృశ్యం అంటారు.

ప్రశ్న 7.
స్థాన సాదృశ్యము అనగానేమి? ఉదాహరణలిమ్ము? [Mar’13, Mar’11][AP,TS 16,17][TS 22]
జవాబు:
స్థాన సాదృశ్యము :
ఒకే అణుఫార్ములాను కలిగి వుండి, సమ్మేళనంలో ప్రతిక్షేపకం ప్రమేయ సమూహం లేదా బహు బంధం స్థానంలో తేడా వల్ల ఏర్పడే సాదృశ్యాన్ని స్థాన సాదృశ్యము అని అంటారు.

ప్రశ్న 8.
ప్రమేయ సమూహ సాదృశ్యము అనగానేమి? ఉదాహరణలిమ్ము? [Mar’10, May’10][AP 16][TS 22]
జవాబు:
ప్రమేయ సమూహ సాదృశ్యము:
సమ్మేళనాల అణుఫార్ములా ఒకటయినప్పటికి, వాటిలో వేరు వేరు ప్రమేయ సమూహాలున్నప్పుడు ఈ సాదృశ్యం ఏర్పడుతుంది.
ఉదా 1 : ఆల్కహాల్లు మరియు ఈథర్లు ప్రమేయ సమూహ సాదృశ్యాలు
C2H6O లోని రెండు ప్రమేయ సమూహ సాదృశ్యాలు
(i) C2H5OH (ఇథైల్ ఆల్కహాల్)
(ii) CH3OCH3 (డై మిథైల్ ఈథర్)
ఉదా 2 : ఆల్డిహైడ్లు మరియు కీటోన్లు ప్రమేయ సాదృశ్యాలు
C3H6O లోని రెండు ప్రమేయ సాదృశ్యాలు
(i) CH3 CH2 CHO (ఆల్డిహైడ్)
![]()
ప్రశ్న 9.
మెటామెరిజం అనగానేమి? ఉదాహరణలిమ్ము? [TS 17]
జవాబు:
మెటామెరిజం :
ఒకే అణుఫార్ములాను కలిగి వుండి, ప్రమేయ సమూహానికి బంధించి వున్న ఆల్కైల్ సమూహాల్లో తేడా వల్ల ఏర్పడే సాదృశ్యాన్ని మెటామెరిజం అంటారు.
ఉదా 1: CH3-CH2-O-CH2-CH3 (డై ఇథైల్ ఈథర్)
CH3-O-CH2-CH2-CH3 (మిథైల్ – ప్రొపైల్ ఈథర్)
ఉదా 2 : CH3-CH2-NH-CH2-CH3 (డై ఇథైల్ ఎమీన్)
CH3-NH-CH2-CH2-CH3 (మిథైల్ – ప్రొపైల్ ఎమీన్)
ప్రశ్న 10.
ఉర్ట్జ్ చర్య అనగానేమి? ఉదాహరణనివ్వండి? [AP 22][Mar’13, Mar’10]
జవాబు:
ఆల్కైల్ హాలైడ్లు సోడియం లోహంతో పొడి ఈథర్ సమక్షంలో చర్య జరిపి ఆల్కేనులను ఏర్పరుస్తాయి. దీనినే ర్ట్జ్ చర్య అని అంటారు.
ఉదా: మిథైల్ హాలైడ్, సోడియం లోహంతో పొడి ఈథర్ సమక్షంలో చర్య జరిపి ఈథేన్ ను ఏర్పరుస్తుంది. దీనినే ర్ట్జ్ చర్య అంటారు.
![]()
ప్రశ్న 11.
మార్కోనికాఫ్ నియమము అనగానేమి? [May’11]
జవాబు:
మార్కోనికాఫ్ నియమము :
ఈ నియమం ప్రకారం ఒక అసమ కారకం ద్విబంధం దగ్గర సంకలనం చెందేప్పుడు దాని ధనావేశ భాగం ఎక్కువ స్థిరత్వముండే కార్బొకాటయాన్, మధ్యస్థం ఏర్పడేందుకు వీలుగా వున్న ద్విబంధ కార్బన్పై సంకలనం చెందుతుంది.
ప్రశ్న 12.
పాలిమెరీకరణం అనగానేమి? ఉదాహరణలిమ్ము? [TS 17]
జవాబు:
ఒక సమ్మేళనపు మామూలు అణువులు కాని, ఎక్కువ సమ్మేళనాల మామూలు అణువులు కాని ఒకదానితో ఒకటి కలిసి పెద్ద అణువులను చిన్న చిన్న వేరే పదార్థాల అణువులను వేరుపరిచి గానీ లేదా వేరుపరచుకుండా ఇచ్చే చర్యను పొలిమెరీకరణమనీ, ఈ చర్యలో ఏర్పడే ఉత్పన్నాన్ని పాలిమర్ అని అంటారు.
ఉదా 1:
ఇథిలీన్ు 100°C వద్ద అధిక పీడనంలో వున్నప్పుడు ఆక్సిజన్ మండించినపుడు పొలిమెరీకరణం చెంది పాలిఇథిలీన్ ను ఏర్పరుస్తుంది.

ఉదా 2:
ఎసిటిలీన్ వాయువును ఎర్రగా కాలుచున్న కాపర్ గొట్టాల గుండా పంపినపుడు మూడు అణువుల ఎసిటిలీన్ పొలిమరీకరణం చెంది బెంజీన్ ఏర్పడుతుంది.
![]()
ప్రశ్న 13.
నిర్జలీకరణ చర్య అనగానేమి? ఇథైల్ ఆల్కహాల్ నుండి ఇథిలీన్ ఎలా ఏర్పడును?
జవాబు:
ఆసన్న కార్బన్ నుండి నీటి అణువును తొలగించడాన్ని నిర్జలీకరణ చర్య అంటారు.
ఉదా : ఇథైల్ ఆల్కహాల్ను గాఢ H4SO4 తో 170°C వద్ద వేడిచేసిన ఇథిలీన్ ఏర్పడును.
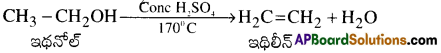
ప్రశ్న 14.
డీ-కార్బాక్సిలీకరణం అనగానేమి? డీ-కార్బాక్సీలీకరణ కారకం అనగానేమి?
జవాబు:
కార్బాక్సిలిక్ ఆమ్లం యొక్క లవణాల నుండి కార్బాక్సిల్ గ్రూపు అనగా CO2ను తొలగించడాన్నే డీ- కార్బాక్సిలీకరణం అంటారు. సోడాలైమ్ (NaOH + CaO) ను డీ -కార్బాక్సీలీకరణ కారకం అంటారు.
![]()
ప్రశ్న 15.
పైరాలసిస్ అనగానేమి?
జవాబు:
ఒక కర్బన సమ్మేళనం గాలి లేనప్పుడు ఉష్ణగతిక విఘటనం చెందడాన్నే పైరాలసిస్ అంటారు. ఆ కర్బన సమ్మేళనాలు . ఆల్కేనులు అయితే ఆ చర్యను భంజనం అంటారు.
![]()
![]()
ప్రశ్న 16.
హైపర్ కాంజుగేషన్ అనగానేమి?
జవాబు:
C-H బంధంలోని σ- ఎలక్ట్రాన్లతో π- బంధాలు కాంజుగేషన్ చెందడాన్ని హైపర్ కాంజుగేషన్ అంటారు. ఇది అసంబద్ధ ఆల్కేన్ల ఏర్పడుటను వివరించును.
ప్రశ్న 17.
కాన్సర్ కారక సమ్మేళనాలకు రెండు ఉదాహరణలిమ్ము?
జవాబు:
1,3–బెంజాన్ధ్రసీన్, 1,2 -బెంజ్ పైరీన్ మరియు 10మిథైల్ -1,2,- బెంజాన్ ధ్రసీన్లు.
ప్రశ్న 18.
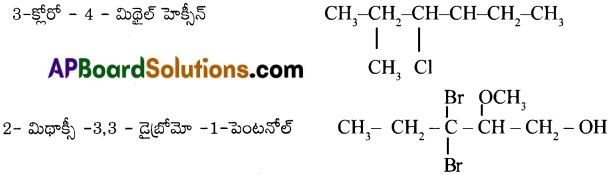
ఈ క్రింది సమ్మేళనాలకు నిర్మాణాలను వ్రాయండి? [Mar’10]
a) 3-క్లోరో – 4 – మిథైల్ హెక్సీన్
b) 2- మిథాక్సీ – 3,3 – డైబ్రోమో – 1 – పెంటనోల్
జవాబు:
ప్రశ్న 18.
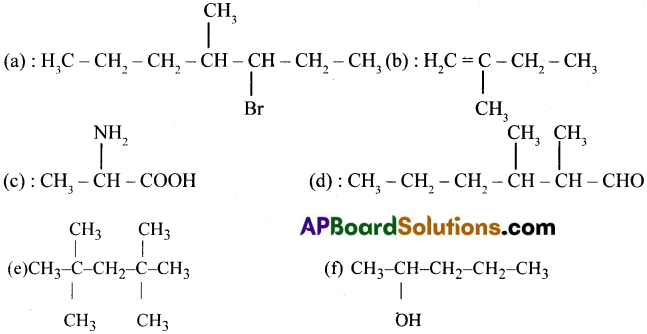
ఈ క్రింది సమ్మేళనాలకు నిర్మాణాత్మక ఫార్ములాలను వ్రాయండి? [TS 15]
(a) 3 – బ్రోమో – 4 – మిథైల్ హెప్టేన్
(b) 2 – మిథైల్ – 1 – బ్యూటీన్
(c) 2 – ఎమినో ప్రొపనోయిక్ ఆమ్లం
(d) 2,3 – డై మిథైల్ హెక్సనాల్
(e) 3,3,4,4 -టెట్రామిథైల్ పెంటేన్
(f) 2– పెంటనోల్ [TS 15]
జవాబు:
ప్రశ్న 19.
IUPAC నియమం ప్రకారం ఈ క్రింది సమ్మేళనాల పేర్లను వ్రాయండి.

జవాబు:
4,4 – డై మిథైల్ పెంటనోల్ -1
4 – అయొడో – 4 – నైట్రో పెంటనోయిక్ ఆమ్లం
ప్రశ్న 20.
IUPAC నియమం ప్రకారం ఈ క్రింది సమ్మేళనాల పేర్లను వ్రాయండి.
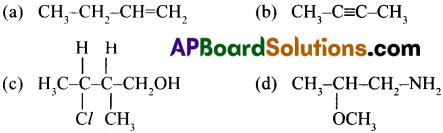
జవాబు:
బ్యూట్ – 1 – ఈన్ (లేదా) 1 – బ్యూటీన్
3 – క్లోరో – 2 – మిథైల్ బ్యూట్ – 1 – ఓల్
బ్యూట్ – 2 – ఇన్ (లేదా) 2 – బ్యూటైన్
3 – మిథాక్సీ – ప్రోపేన్ – 1 – ఎమీన్
ప్రశ్న 21.
IUPAC నియమం ప్రకారం ఈ క్రింది సమ్మేళనాల పేర్లను వ్రాయండి.

జవాబు:
(a) 1,2 – ఈథేన్ డై ఓల్
(b) ప్రొపనోన్
ప్రశ్న 22.
ఈ క్రింది వానికి IUPAC పేర్లు వ్రాయండి. [May’11]
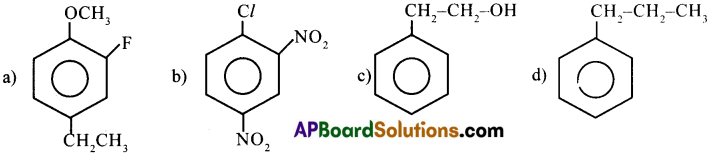
జవాబు:
a) 4 – ఇథైల్ – 2 – ఫ్లోరో ఎనిసోల్
b) 1-క్లోరో – 2,4 – డై నైట్రో బెంజీన్
c) 2 – ఫినైల్ ఇథనోల్
d) 1 – ఫినైల్ ప్రోపేన్
ప్రశ్న 23.
ఈ క్రింది వానికి పేర్లు వ్రాయండి.
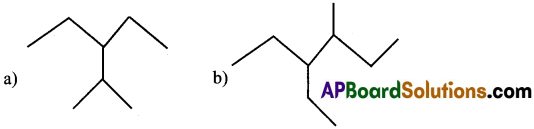
జవాబు:
a) 3 – ఇథైల్ – 2 – మిథైల్ పెంటేన్
b) 3 – ఇథైల్ – 4 – మిథైల్ హెక్సేన్
![]()
ప్రశ్న 24.
పారాఫీన్లు అనగానేమి? వాటిని ఎందుకని అలా పిలుస్తారు?
జవాబు:
ఆల్కేనులను పారాఫీన్లు అంటారు. ఎందుకంటే ఇవి రసాయన కారకాల్లో జడ స్వభావాన్ని కలిగివుంటాయి.
ప్రశ్న 25.
మీథేన్ మరియు ఈథేన్ల రెండు ఉపయోగాలను వ్రాయండి.
జవాబు:
మీథేన్ను (i) వాయు ఇంధనాలుగాను (ii) రబ్బరు టైర్ల తయారీలోను ఉపయోగిస్తారు.
ఈథేన్ను (i) ఇంధనంగాను (ii) ఇథిలీన్ ను తయారుచేయడంలోను ఉపయోగిస్తారు.
ప్రశ్న 26.
బెంజీన్ నుండి మిథైల్ బెంజీన్ ను ఏ విధంగా తయారుచేస్తారు? [Mar’11,09]
జవాబు:
బెంజీన్ మిథైల్ క్లోరైడ్తో లూయిస్ ఆమ్లాలు అనగా AlCl3 సమక్షంలో చర్య జరిపి మిథైల్ బెంజీన్ ను ఏర్పరుస్తుంది.
![]()
ప్రశ్న 27.
బెంజీన్ H2తో చర్యను వ్రాయండి. [AP 19]
జవాబు:
బెంజీన్ Ni సమక్షంలో H2 తో చర్య జరిపి సైక్లోహెక్సేన్ ను ఏర్పరుస్తుంది.
![]()
Textual Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
కింది సమ్మేళనాల IUPAC నామాలు రాయండి.
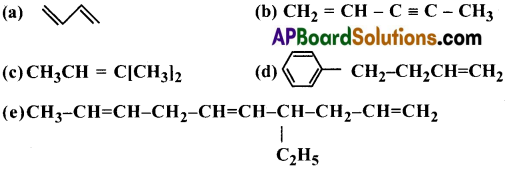
జవాబు:
(a) 1,3 –బ్యుటాడయీన్
(b) పెంట్-1-ఈన్–3–అయిన్
(c) 2–మిథైల్–2–బ్యుటీన్
(d) 4 ఫినైల్ -1- బ్యుటీన్
(e) 4–ఇథైలెక్–1,5,8–ట్రాయీన్
ప్రశ్న 2.
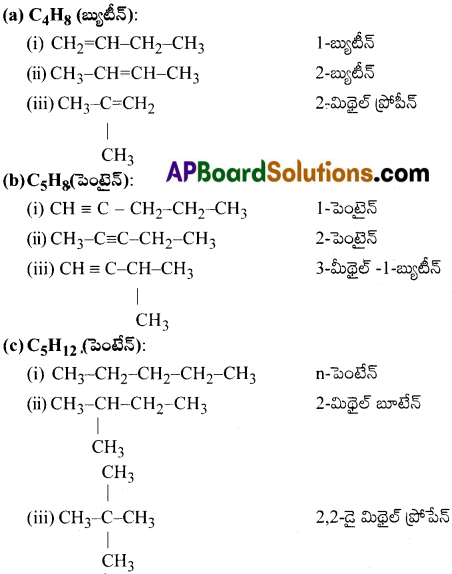
కింది ఇచ్చిన ఫార్ములాలు ఏర్పరచగలిగిన సాదృశ్యాలను రాసి వాటి నిర్మాణాలు, IUPAC పేర్లు రాయండి.
(a) C4H8 (ఒక ద్విబంధం)
(b) C5H8 (ఒక త్రిబంధం)
(c) C5H12 (బహుబంధాలు లేవు)
జవాబు:
![]()
ప్రశ్న 3.
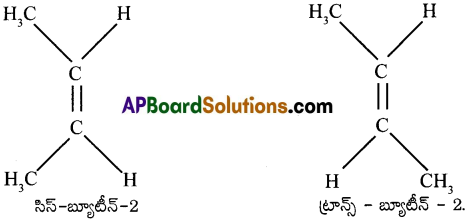
క్షేత్ర సాదృశ్యాన్ని తగు ఉదాహరణలతో వివరించండి? [AP 22]
జవాబు:
ఈ సాదృశ్యము ఒకే నిర్మాణాత్మక ఫార్ములాను కలిగి వుండి, C=C ద్వి బంధం గల పరమాణువుల (లేదా) గ్రూపుల ప్రాదేశిక అమరికల్లో తేడా వల్ల ఏర్పడుతుంది. ఈ రకమైన సాదృశ్యాన్నే “క్షేత్ర సాదృశ్యము” అంటారు.
ఈ సాదృశ్యము ఆల్కీనులు లేదా వాటి ఉత్పన్నాలు ప్రదర్శిస్తాయి. ద్వి బంధం గల కార్బను బంధితమైన పరమాణువులు లేదా గ్రూపులో తేడా వల్ల ఏర్పడుతుంది.
ఇది రెండు రకాల క్షేత్ర సాదృశ్యాలను ఏర్పరుస్తుంది.
(1) సిస్ – సాదృశ్యం (2) ట్రాన్స్ సాదృశ్యం.
ద్విబంధానికి గల రెండు పరమాణువులు (లేదా) గ్రూపులు ఒకే వైపు వుంటే దానిని సిస్-సాదృశ్యం అంటారు. ద్విబంధానికి గల రెండు పరమాణువులు లేదా గ్రూపులు వ్యతిరేక దిశలలో వుంటే ట్రాన్స్-సాదృశ్యము అంటారు.
ప్రశ్న 4.
జ్యామితీయ సాదృశ్యాల E – Z విన్యాసం అంటే ఏమిటి ? CHCl=CFBrను ఉదాహరణగా తీసుకుని వివరించండి?
జవాబు:
జ్యామితీయ సాదృశ్యాల E-Z విన్యాసం :
i) ద్విబంధం గల కార్బన్ చుట్టూ వున్న పరమాణువులు/గ్రూపులను పరమాణు సంఖ్యల క్రమంలో అమర్చాలి.
ii) ద్విబంధ కార్బన్ల మీద గ్రూపులు అధిక పరమాణు సంఖ్యలు గల పరమాణువుల ద్వారా ద్విబంధ కార్బన్లకు ఒకే వైపున బంధాలేర్పరిచి వుంటే దానిని ‘Z’ విన్యాసమని, అదే అధిక పరమాణు సంఖ్యల పరమాణువులు ద్విబంధానికి వ్యతిరేక ప్రక్కల బంధించబడి వుంటే దానిని ‘E’ విన్యాసమనీ అంటారు.
ఉదా : CHCl =CFBr
H మరియు Cl లలో 1H కన్నా 17Cl కు అధిక ప్రాధాన్యత వుంటుంది.
F మరియు Br లలో 9F కన్నా 35Br అధిక ప్రాధాన్యం ఇస్తుంది.
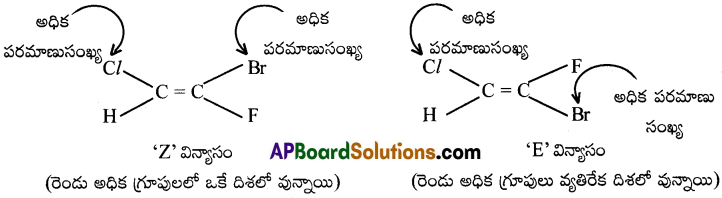
ప్రశ్న 5.
కింది వాటిని వివరించండి: a) స్వేదనం b) అంశిక స్వేదనం c) నిర్వాత స్వేదనం d) జల బాష్పస్వేదనం
జవాబు:
a) స్వేదనం :
ఈ పద్ధతి అభాష్పశీల పదార్ధాలు మలినాలుగా వున్న ద్రవాలను శుద్ధి చేయడానికి ఉపయోగపడుతుంది.
స్వేదన కుప్పెలో మలిన ద్రవాన్ని తీసుకుని మరిగించితే దాని భాష్పం వస్తుంది. ఆ భాష్పాన్ని కండెన్సర్ ద్వారా పంపి ద్రవీకరించి సంగ్రహణ పాత్రలో గ్రహించవచ్చు. ఈ పద్ధతిని ద్రవాల మిశ్రమాన్ని వేరు చేయడానికి కూడా వాడవచ్చు. అయితే ఆ ద్రవాల బాష్పీభవన స్థానాలలో భేదం 40°C కంటే ఎక్కువ వుండాలి. 40°C తక్కువ బాష్పీభవన స్థానాల భేదం వున్న ద్రవాలను పాక్షిక అంశిక స్వేదనం ద్వారా వేరు చేయవచ్చు.
ద్వారా
b) అంశిక స్వేదనం :
40°C కంటే తక్కువ బాష్పీభవన స్థానాలువున్న ద్రవాలు అంశిక స్వేదనం జరుపుతాయి. ద్రవ మిశ్రమాన్ని స్వేదన కుప్పెలో తీసుకుంటారు. నాళికపై భాగాన్ని నీటి కండెన్సర్కు కలిపే వీలుంటుంది. మిశ్రమంలో రెండు ద్రవాలు A,B లు వున్నాయనుకుందాం. అందులో Aకు B కంటే ఎక్కువ బాష్పీభవనం వుంటుందనుకుందాం. మిశ్రమాన్ని వేడిచేస్తే A,B లు రెండింటికీ చాలా దగ్గర బాష్పీభవన స్థానాలుండటం వల్ల అంశిక నాళిక రెండింటి బాష్పాలు పైకి ప్రయాణిస్తాయి. అయితే B బాష్పం అధికంగా వుంటుంది. అంశిక నాళిక ద్వారా ప్రయాణించేటప్పుడు బాష్పాలు అనేక అడుగు ఉపరితలాల నెదుర్కొంటాయి. ఆ సమయంలో క్రింది నుంచి పైకి పై నుంచి క్రిందకు వచ్చే బాష్పాల మధ్య ఉష్ణ వినిమయం జరిగి బాష్పాల ఉష్ణోగ్రత తగ్గుతుంది. ఆ ఉష్ణోగ్రత A బాష్పీభవన స్థానం కంటే తక్కువయితే ‘A’ ద్రవీకరణం చెంది తిరిగి స్వేదన కుప్పెలోకి చేరుకుంటుంది. ద్రవీకరణం ఉష్ణమోచక చర్య అందువల్ల ‘A’ ద్రవీకరణం చెందగా వచ్చిన ఉష్ణశక్తి బాష్పాన్ని వేడిచేసి బాష్పస్థితిలోనే అంశిక నాళిక నుంచి బయటకు శుద్ధమైన బాష్పంగా వచ్చేందుకు ఉపయోగపడుతుంది. ఈ ‘B’ బాష్పం కండెన్సర్ ద్వారా ప్రయాణించి ద్రవీకరణం చెందుతుంది. ఆ విధంగా వచ్చిన ద్రవం సంగ్రహణ పాత్రలోకి వస్తుంది.
c) నిర్వాత స్వేదనం :
ఈ విధానం అధిక బాష్పీభవన స్థానాలున్న ద్రవాల్ని లేదా బాష్పీభవన స్థానాలున్న ద్రవాల్ని లేదా బాష్పీభవన స్థానాలున్న ద్రవాల్ని లేదా బాష్పీభవన స్థానాలకంటే తక్కువ ఉష్ణోగ్రతల వద్ద వియోగం చెందే ద్రవాల్ని శుద్ధి చేయడానికి ఉపయోగపడుతుంది. బాహ్య పీడనం తగ్గిస్తే ద్రవం తక్కువ ఉష్ణోగ్రత వద్ద ఎలాంటి వియోగం చెందకుండా బాష్పీభవనం చెందుతుంది. వచ్చిన బాష్పాల్ని చల్లబరిచి పరిశుద్ధ ద్రవాన్ని పొందవచ్చు. మలినాలు స్వేదన కుప్పెలో మిగిలిపోతాయి.
d) జల బాష్ప స్వేదనం :
ఈ పద్ధతిలో నీటిలో కరగని, బాష్పీభవన స్థానం ఎక్కువగా వున్న జల బాష్నంతో బాష్పశీలత పొందే ద్రవాల్ని శుద్ధి చేస్తారు. ఈ విధానంలో వేడి మలిన ద్రవంలోకి నీటి ఆవిరిని పంపుతారు. నీటి ఆవిరి, ద్రవపు బాష్పం కలిసి బయలికొస్తాయి. దీనికి కారణం నీటి బాష్పం, ద్రవ బాష్పం రెండింటి మొత్తం పీడనం బాహ్య వాతావరణ పీడనానికి సమానం. ఈ నీటి ఆవిరి ద్రవ బాష్పం రెండూ కండెన్సర్ ద్వారా ప్రయాణించి ద్రవ మిశ్రమమై సంగ్రహణ పాత్రలో చేరతాయి. అవి ఒకదానితో ఒకటి కలిసిపోవు. కాబట్టి వేర్పాటు వేరుచేయవచ్చు.
ప్రశ్న 6.
క్రొమటోగ్రఫీని గురించి వివరించండి?
జవాబు:
క్రొమటోగ్రఫీని ఒక మిశ్రమంలోని అనుఘటకాలను స్థిర ప్రావస్థ, చలన శీల ప్రావస్థ అనే రెండు ప్రావస్థితి మధ్య వేరు పరిచే విధానంగా అభివృద్ధి చేశారు. క్రొమటోగ్రఫీలో క్రింద పేర్కొన్న మూడు దశలు ఇమిడి వుంటాయి.
a) స్థిర ప్రావస్థ మిశ్రమంలోని అనుఘటకాలను అధిశోషించుకుని స్థిరంగా పట్టి వుంచుతుంది. చలన శీల ప్రావస్థ అదిశోషించుకోబడిన అనుఘటకాలను వేరు పరిచి స్థిర ప్రావస్థపై విభిన్న దూరాలను తీసుకునిపోతుంది.
b) పై విధంగా వేరుపర్చబడి అనుఘటకాలను చలనశీల ప్రావస్థను ఆపకుండా పంపి తిరిగి పొందడం. దీనినే నిక్షాలన పద్ధతి అంటారు.
c) గుణాత్మక, పరిమాణాత్మక విశ్లేషణల ద్వారా నిక్షాళన చేసి సాధించిన సమ్మేళనాలను తెలుసుకోవడం.
వర్గీకరణ :
క్రొమటోగ్రఫీ పద్ధతులు 2 రకాలు.
(i) అధిశోషణ క్రొమటోగ్రఫీ
(ii) వితరణ క్రొమటోగ్రఫీ
అధిశోషణ క్రొమటోగ్రఫీలో అధిశోషణిపై వివిధ సమ్మేళనాలు వివిధ అవధుల్లో అధిశోషణం చెందుతాయి. సాధారణంగా వాడే అధిశోషణులు సిలికాజెల్ లేదా అల్యూమినా చలనశీల ప్రావస్థను స్థిర ప్రావస్థపై పంపినప్పుడు చలనశీల ప్రావస్థలోని వివిధ అనుఘటకాలు స్థిర ప్రావస్థపై వివిధ దూరాలలో అధిశోషితం చెందుతాయి.
భేదాత్మక అధిశోషణం సూత్రాన్ని
a) కాలమ్ క్రొమటోగ్రఫీ
b) పలుచని పొర క్రొమటోగ్రఫీలోనూ వాడతారు.
![]()
ప్రశ్న 7.
కింది వాటిని వివరించండి.
(a) కాలమ్ క్రొమటోగ్రఫీ
(b) పలచని పొర క్రొమటోగ్రఫీ
(c) వితరణ క్రొమటోగ్రఫీ
జవాబు:
కాలమ్ క్రొమటోగ్రఫీ :
కాలమ్ క్రొమటోగ్రఫీలో మిశ్రమంలోని అనుఘటకాలను ఒక గాజు గొట్టంలో నింపి వున్న అధిశోషకంపై భాగానా వుంచాలి. గాజు గొట్టానికి కింద ఒక స్టాప్ కాక్ వుంటుంది. ఒక సరియైన నిక్షాలకాన్ని అది ఒకే ద్రావణి కావచ్చు లేదా కొన్ని ద్రావణుల మిశ్రమం కావచ్చు లేదా కొన్ని ద్రావణుల మిశ్రమం కావచ్చు, తీసుకుని కాలమ్ పై నుంచి కిందకి నెమ్మదిగా ప్రవహింపచేయాలి. అప్పుడు మిశ్రమంలోని అనుఘటకాలు విభిన్న అవధుల్లో అధిశోషణం చెంది వేరవుతాయి.
పలచని పొర క్రొమటోగ్రఫీ :
ఇది కూడా అధిశోషణాల్లో బేధం వల్లనే ఇక్కడ అదిశోషకం సిలికాజెల్ లేదా అల్యూమినాను ఒక గాజు ప్లేటుపై పలుచని పొరగా పూత పూస్తారు. ఈ ప్లేటును TLC ప్లేటు లేదా క్రోమోప్లేట్లు అంటారు. అనుఘటకాలను కలిగి వున్న మిశ్రమ ద్రావణాన్ని ప్లేట్ కింది నుంచి రెండు cmల దూరంలో ఒక చిన్న చుక్క లేదా బొట్టుగా వుంచుతారు. ఇప్పుడు ప్లేట్ను నిక్షాలనం వున్న ఒక మూసిన పాత్రలో వుంచుతారు. నిక్షాలనం ప్లేటు పైకి ప్రవహిస్తూ తనతోపాటు మిశ్రమంలోని అనుఘటకాలను తీసుకుని పోతుంది. కాని అనుఘటకాల అధిశోషణ అవధులపై ఆధారపడి వివిధ దూరాలు ప్రయాణించి వేరు వేరు దూరాల్లో అధిశోషితమవుతాయి.
ఒక అనుఘటకం సాపేక్ష అధిశోషణం దాని మందనం గుణకం (Rf) విలువతో తెలుపుతారు.
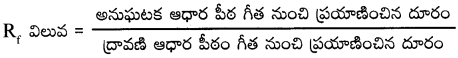
వితరణ క్రొమటోగ్రఫీ :
ఇది మిశ్రమంలోని అనుఘటకాలు ఆగకుండా స్థిర ప్రావస్థ, చలనశీల ప్రావస్థల మధ్య భేదాత్మకంగా వితరణం చెందుతాయి. పేపర్ క్రొమటోగ్రఫీలో ఒక ప్రత్యేకమయిన క్రొమటోగ్రఫీ పేపర్ను తీసుకుని నీటిని దానిలో వుంచుతారు. ఈ నీరు స్థిర ప్రావస్థగా పనిచేస్తుంది. ఈ క్రొమటోగ్రఫీ పేపర్ ఆధారపీఠ గీతపై అనుఘటకాల మిశ్రమాన్ని చుక్కగా పెట్టి పేపర్ను ఒక సరియైన ద్రావణి దీనిలో వేలాడదీస్తారు. ఇక్కడ ద్రావణి చలనశీల ప్రావస్థగా పనిచేస్తుంది. ద్రావణి పేపర్పై కాపిలరీ యాక్షన్ ద్వారా పైకి ప్రయాణించి మిశ్రమపు బొట్టు పైగా పోతుంది. అప్పుడు పేపర్ విభిన్న అనుఘటకాల్ని ప్రత్యేకంగా తనపై నిలుపుకుంటుంది. అనుఘటకాలు వాటి అభిలాక్షణిక ధర్మాలపై ఆధారపడి స్థిర ప్రావస్థ, చలనశీల ప్రావస్థల మధ్య వేర్వేరుగా వితరణ చెందుతాయి. డెవలప్ లేదా వృద్ధి చేసిన పేపర్ను క్రొమటోగ్రాం అంటారు. విడగొట్టబడిన రంగుల అనుఘటకాల చుక్కలను పేపర్పై గుర్తించవచ్చు. రంగులేని అనుఘటకాలను ఇతర కారకాలను చల్లడం వంటి ప్రయత్నాల ద్వారా గుర్తించవచ్చు.
ప్రశ్న 8.
ప్రేరేపక ప్రభావం గురించి వివరించండి?
జవాబు:
ప్రేరేపక ప్రభావం :
ధృవణం చెందిన ఒక σ బంధం ప్రక్కనే వేరొక బంధంపై ప్రభావం చూపి దానిని కూడా ధృవణం చెందించడాన్ని ప్రేరేపక ప్రభావం అంటారు.
వివరణ :
CH3 – CH2 – CH2 – Cl అణువును తీసుకుంటే అందులో కార్బన్ – క్లోరిన్ పరమాణువుల మధ్య σ సంయోజనీయ బంధం వుంది. ఎలక్ట్రాన్ జంట సమానంగా పంచుకోదు. ఎక్కువ ఋణ విద్యుదాత్మకత గల క్లోరిన్ పరమాణువు ఎలక్ట్రాన్ జంటను తనవైపుకు ఎక్కువగా ఆకర్షిస్తుంది. దీనివల్ల కార్బన్ పరమాణువు మీద కంటే క్లోరిన్ పరమాణువు మీద ఋణ విద్యుదావేశ సాంద్రత ఎక్కువగా వుంటుంది. దీనిని C-C లేదా గా చూపుతాము. అయితే క్లోరిన్తో బంధమేర్పరిచిన కార్బన్ పరమాణువు తిరిగి వేరే కార్బన్ పరమాణువుతో బంధమేర్పరిచి వుండటం వల్ల ఈ ప్రభావం ఇతర కార్బన్ పరమాణువులకు కూడా ప్రసారమవుతుంది

ప్రేరేపక ప్రభావాలు:
-I ప్రభావం: ఎలక్ట్రాన్ కొరత గల సమ్మేళనాలన్ని – ప్రభావాన్ని ప్రదర్శించును.
– ప్రభావ క్రమం
NO2 > CHO > CO > COOH> F > Cl > Br > I > OH > OR > NH2 > C6H5 > H.
+I ప్రభావం : ఎలక్ట్రాన్ దానం చేసే సముహాలు అన్ని + I ప్రభావాన్ని ప్రదర్శించును.
+I ప్రభావ క్రమం: – C(CH3)3 > – CH(CH3)2 > – CH2CH3 > – CH3
ప్రశ్న 9.
మీసోమెరిక్ ప్రభావం గురించి వ్రాయండి?
జవాబు:
మీసోమెరిక్ ప్రభావం :
“ఒక శృంఖలంలో సంయుగ్మ విధానంలో ఒక పరమాణువు లేదా గ్రూపు ఎలక్ట్రాన్ జంటలను స్థానభ్రంశం చేసే విధానాన్ని మీసోమెరిక్ ప్రభావం అంటారు”.
మీసోమెరిక్ ప్రభావం లక్షణాలు :
- ఇది స్థిరమైన ప్రభావం. అణువు భూస్థితిలో వున్నప్పుడు జరుగుతుంది.
- ఒంటరి జంటలు, πఎలక్ట్రాన్లతో సంయుగ్మ విధానంతో ఎలక్ట్రాన్ స్థానభ్రంశం జరుగుతుంది.
- భౌతిక ధర్మాల్ని, చర్యావేగాల్ని ప్రభావితం చేస్తుంది.
ఏ గ్రూపులయితే ఎలక్ట్రాన్లను తమవైపుకు ఆకర్షించి మిగిలిన అణుభాగంపై ఎలక్ట్రాన్ సాంద్రతను పెంచుతాయో వాటిని +M ప్రభావం అంటారు. ఒంటరి జంటలు వున్న ఎలక్ట్రానులు +M ప్రభావాన్ని చూపుతాయి.
ఉదా : H2N-C = C – ఇక్కడ – NH2 గ్రూపు + M ప్రభావాన్ని చూపుతుంది.
ఏ గ్రూపులయితే ఎలక్ట్రాన్లను తనవైపుకు ఆకర్షించి మిగిలిన అణుభాగంపై ఎలక్ట్రాన్ సాంద్రతను తగ్గిస్తాయో వాటిని -M ప్రభావం అంటారు. ఉదా: CÉC-C= 0.
ఇక్కడ C = O గ్రూపు మిగిలిన అణుభాగంపై ఎలక్ట్రాన్ సాంద్రతను తగ్గిస్తుంది. ఇది -M ప్రభావాన్ని చూపుతుంది.
ప్రశ్న 10.
రెజొనెన్స్ ప్రభావం గురించి వివరించండి?
జవాబు:
రెజొనెన్స్ ప్రభావం :
“ప్రక్క ప్రక్క పరమాణువుల మధ్య రెండు π బంధాలు లేదా ఒక π బంధం ఒక ఒంటరి జంటల మధ్య జరిగే అంతర్ చర్యల వల్ల ఉత్పన్నమయిన ధ్రువణాన్ని రెజొనెన్స్ ఫలితం అంటారు”. ఈ ఫలితం శృంఖలం ద్వారా ప్రసారమవుతుంది.
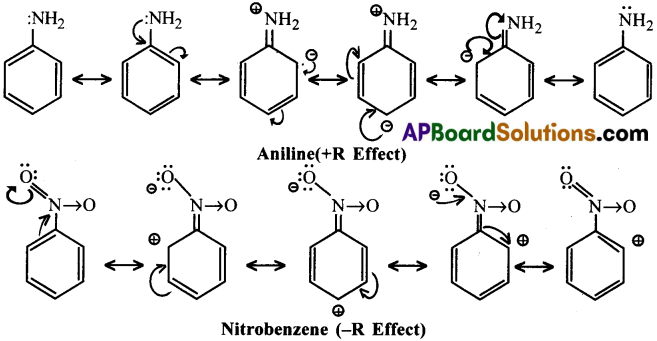
ఎలక్ట్రాన్ల బదలాయింపు ప్రతిక్షేపక పరమాణువు లేదా గ్రూపు నుంచి అణువుపైకి సంయుగ్మ వ్యవస్థ ద్వారా జరిగితే దానిని (+R) అని చూపుతారు. దీనివల్ల అణువులోని కొన్ని స్థానాల్లో ఎక్కువ ఎలక్ట్రాన్ సాంద్రత వస్తుంది. ఎనిలిన్ అణువు ఉదాహరణగా చూడవచ్చు. అదే ఎలక్ట్రాన్ బదలాయింపు ప్రతిక్షేపక పరమాణువు లేదా గ్రూపు వైపుకయితే దానిని (−R)తో చూపుతారు. నైట్రో బెంజీన్ దీనికి ఉదాహరణ.
ప్రశ్న 11.
కర్బన రసాయన చర్యల వర్గీకరణను వివరించండి?
జవాబు:
కర్బన రసాయన చర్యలను నాలుగు రకాలుగా విభజించవచ్చు.
i) సంకలన చర్యలు
ii) ప్రతిక్షేపణ చర్యలు
iii) విలోపన చర్యలు
iv) అణుపునరమరికలు
i) సంకలన చర్యలు :
ఈ చర్యలలో కారకము మరియు క్రియాధారం కలిసి ఉత్పన్నాన్ని ఏర్పరుస్తుంది.
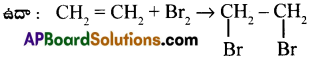
కారకము నెమ్మదిగా జరిగే చర్య రేటు మీద ఆధారపడి వుంటుంది. సంకలన చర్యలను మరలా 3 రకాలుగా విభజించవచ్చు.
a) ఎలక్ట్రోఫిలిక్ సంకలన చర్యలు
b) న్యూక్లియోఫిలిక్ సంకలన చర్యలు
c)స్వేచ్ఛా ప్రాతిపదికలు.
ii) ప్రతిక్షేపణ చర్యలు :
ఈ చర్యలో పరమాణువు లేదా గ్రూపులోని ప్రతిక్షేపకం వేరొక పరమాణువు లేదా గ్రూపుతో ప్రతిక్షేపించబడుతుంది.
a) ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపణ చర్యలు
b) న్యూక్లియోఫిలిక్ ప్రతిక్షేపణ మరియు
c) స్వేచ్ఛా ప్రాతిపదికల చర్యలు చర్యారేటుపై ఆధారపడి వుంటాయి.
![]()
iii) విలోపన చర్యలు :
ఈ చర్యలలో రెండు లేదా అంతకన్నా ఎక్కువ మూలకాలు క్రియాధారం నుండి విలోపనం చెంది ద్విబంధం (లేదా) త్రిబంధం ఉత్పన్నాలను ఏర్పరుస్తాయి.
CH3CH2Br + KOH(alc) → CH2 = CH2 + KBr + H2O
iv) అణు పునరమరికలు :
ఒక కర్బన మూలకం వేరొక కర్బన మూలకంతో పునరమరిక చెందుతుంది.
ఉదా : Fries పునరమరిక.
![]()
ప్రశ్న 12.
ఈథేన్ అనురూపాత్మక సాదృశ్యం గురించి వివరించండి? [Mar ’09]
జవాబు:
1) C-C ఏక బంధం ద్వారా భ్రమణం జరిపితే ఆల్కేన్లలో అనురూపకాలు వస్తాయి. వీటిని న్యూమన్ ప్రక్షేపకాల ద్వారా, లైన్ – వెడ్జి (లేదా) సాహార్స్ ప్రక్షేపకాల ద్వారా చూపవచ్చు.
2) ఈథేన్ అనురూపకాలు :
స్వేచ్ఛగా లేని ఈథేన్ లోని C-C ఏక బంధం ద్వారా భ్రమణం చెందుతుంది. కావున అనంతమైన అనురూపకాలు ఏర్పడవచ్చు. ఇవి రెండు రకాల సాదృశ్యాలను ఏర్పరుచును.
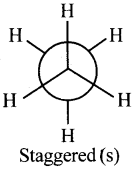
అవి i) స్టాగర్డ్ రూపం (C)
ii) ఎక్లిప్స్ రూపం(E)
3) స్టాగర్డ్ అనురూపకం :
ఒక కార్బన్ మీదనున్న CH బంధం రెండో కార్బన్ పై ప్రక్క ప్రక్కగా వున్న రెండు C-H బంధాల మధ్య కోణాన్ని రెండు అర్ధ భాగాలుగా విభజిస్తుంది.
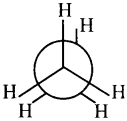
4) ఎక్లిప్స్ రూపం :
ఒక కార్బన్పై C-H బంధం రెండో కార్బన్ పై C−H బంధం ఏకరేఖ పైకి వస్తాయి.
ప్రశ్న 13.
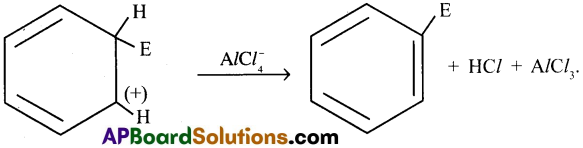
బెంజీన్ లో ఎలక్ట్రోఫిలిక్ ప్రతిక్షేపన మెకానిజంను వివరించండి.
జవాబు:
ఎలక్ట్రోపైల్కు అసౌష్టవ ద్విబంధ అల్కీనక్కు చేర్చినపుడు మధ్యస్థ కార్బోకాటాయాన్ ఏర్పడును. బెంజీన్ లో ఎలక్ట్రోఫైల్ ప్రతిక్షేపక చర్య విధానం :
ఎలక్ట్రోఫైల్ ప్రతిక్షేపకచర్య రెండు దశలలో జరుగును.
- ఎలక్ట్రోఫైల్ ఏర్పడుట
- a) మధ్యస్థ కార్భోకాటయాన్ ఏర్పడుట
b) మధ్యస్థ కార్భోకాటాయాన్ నుండి ప్రోటాను తొలగించుట
ప్రశ్న 14.
మార్కొనికాఫ్ నియమం, ఖరాష్ ప్రభావాల్ని వివరించండి.
జవాబు:
మార్కోనిక్ నియమం : ఈ నియమం ప్రకారం
i) HX హలోజన్ పరమాణువు అధిక ప్రతిక్షేపిత కార్బన్కు మరియు హైడ్రోజన్ అల్ప ప్రతిక్షేపిత కార్బను సంకలనం చెందును.
ii)ఈ చర్య విధానం క్రింది కార్బోకాటయాన్ క్రమంను పాటించును.
[టెర్షియరి C+ > సెకండరీ C+ > ప్రైమరీ C+ ] స్థిరత్వక్రమం.
iii) C – C ద్విబంధంలోని ఎలక్ట్రాన్లు, ఎలక్ట్రోఫైల్ H+కు అందజేసి మధ్యస్థ కార్బో కాటాయాన్ను ఇచ్చును.
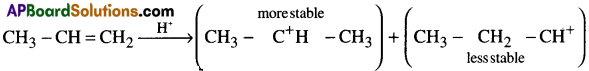
iv) హలైడ్ అయాన్ ధనావేశత కార్బన్ తో కలిసి ఆల్కేల్ హలైడ్ను ఇచ్చును.
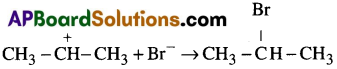
గమనిక : కార్బొకాటయాన్లోని ధనావేశ కార్బన్ మధ్యస్థ కేంద్ర సమ్మేళనాన్ని ఏర్పరచి రెసిమిక్ మిశ్రమంను ఏర్పరచును.’
ఖరాష్ ప్రభావం (లేదా) పెరాక్సైడ్ ప్రభావం:
ఈ నియమంను పెరాక్సైడు ప్రభావం (లేదా) కారా ప్రభావం అంటారు.
ఈ నియమం ప్రకారం పెరాక్సైడు సమక్షంలో అసౌష్టవ ఆల్కీన్ (ఫ్రోఫిన్) కు HBr ను కలిపినపుడు మార్కోనిక్ నియమంనకు వ్యతిరేకంగా చర్య జరుగును. ఈ నియమం ప్రకారం హలోజన్ పరమాణువు ద్విబంధగత కార్బన్ లో సమ్మేళనం ఎక్కువ సంఖ్యలో హైడ్రోజన్లు గల కార్బన్ తో సంకలనం చెందును.
![]()
ప్రశ్న 15.
కర్బన కారకాల్లోని రకాలను గురించి వివరించండి?
జవాబు:
a. ఎలక్ట్రోఫైల్లు:
(ఎలక్ట్రానన్ను ఆకర్షించేది): అధిక ఎలక్ట్రాన్ సాంద్రత లేదా ఋణ విద్యుదావేశ స్థానంతో చర్య జరిపే కారకాలు ఎలక్ట్రోఫైల్లు. ఎలక్ట్రోఫైల్లకు ఎలక్ట్రాన్ న్యూనత వుంటుంది. ఇవి లూయీ ఆమ్లాలు. ఈ జాతుల్లో కనీసం ఒక పరమాణువులో ఎలక్ట్రాన్ జతను స్వీకరించడానికి వీలుగా ఖాళీ ఆర్బిటాళ్ళున్న ధన విద్యుదావేశ అయానులు లేదా తటస్థ అణువులు లేదా పరమాణువులు వుంటాయి. ఎలక్ట్రోఫైల్లు పాల్గొనే చర్యను ఎలక్ట్రోఫిలిక్ చర్యలు అంటారు. ఉదా : X+, Rt, RCO+ మొ||
b. న్యూక్లియోఫైల్లు (కేంద్రకం (ధనావేశం)ను ఆకర్షించేది):
న్యూక్లియోఫైల్లు తక్కువ ఎలక్ట్రాన్ సాంద్రత వున్న లేదా ధన అయాన్లపై చర్య జరిపే కారకాలు. పేరును బట్టి ఇవి న్యూక్లియస్ ను కోరే కారకాలని అర్ధం వచ్చినా దాని అసలు అర్ధం అవి ఎలక్ట్రాన్ ద్వేషించే కారకాలు. అవి ఎక్కువ ఎలక్ట్రాన్ సాంద్రత కలిగినవో లేక ఋణ విద్యుదావేశ అయాన్లో అవుతాయి. ఇవి లూయీ క్షారాలు.
ఉదా: Cl–, Br–, OH–, CN–, H2, NH2–
c. స్వేచ్ఛా ప్రాతిపదికలు : ఈ కారకాల్లో ఒంటరి ఎలక్ట్రానులుంటాయి
ఉదా: Cl–, R-O, Na
ఎలక్ట్రాన్ న్యూనత గల పరమాణువులు ధృవణ చర్యల్లో ఒక న్యూక్లియోఫైల్ క్రియాధారంపై ఎలక్ట్రోఫిలిక్ కేంద్రంపై చర్య జరుపుతుంది.
ప్రశ్న 16.
మూలకాలను గుర్తించుటపై వ్యాసం వ్రాయండి?
జవాబు:
I. కార్బన్ మరియు హైడ్రోజన్లను గుర్తించుట :
ఇవ్వబడిన కర్బన సమ్మేళనానికి క్యుప్రిక్ ఆక్సైడ్ (CuO) ను కలిపి అధిక ఉష్ణోగ్రతలకు వేడిచేసినపుడు, కార్బన్ వుంటే అది కార్బన్ డై ఆక్సైడ్ వాయువును ఏర్పరుస్తుంది. CO2 సున్నపు నీటిని పాలవలె మారుస్తుంది.
లాసైన్ పరీక్ష (లేదా) సోడియం నిష్కర్షణ పరీక్ష :
లాసైన్ పరీక్షలో సమ్మేళనాన్ని ఒక జ్వలన నాళికలో సోడియం లోహంతో పాటు తీసుకుని నాళిక ఎర్రగా మారే వరకు వేడిచేస్తే సమ్మేళనం, సోడియం కరుగుతాయి. ఎర్రని వేడి జ్వలన నాళికను స్వేదన జలంలో ముంచి పైన వచ్చిన కరిగిన ద్రవ్యరాశిని నీటితో నిష్కర్షణ చేసి ద్రావణాన్ని పది నిమిషాల పాటు మరిగించి వడపోయాలి. గాలి ద్రవాన్ని సోడియం నిష్కర్షణ అంటారు.
Na + C + N → NaCN
2Na + S → Na,S
Na + X → Na X(X = Cl, Br or 1)
నైట్రోజన్ పరీక్ష :
ఒక భాగం సోడియం నిష్కర్షణకు, ఫెర్రస్ సల్ఫేట్ ద్రావణాన్ని మరియు గాఢ సల్ఫ్యూరిక్ ఆమ్లంతో ఆమ్లీకృతం చేసి వేడి చేయాలి. ప్రస్యన్ బ్లూ లేదా ఆకుపచ్చని అవక్షేపం వస్తే నైట్రోజన్ వున్నట్లు నిర్ధారణ అవుతుంది.
6NaCN + FeSO4 → Na4[Fe(CN)6] + Na2SO4
3Na4[Fe(CN)6] + 4FeCl3 → Fe4 [Fe(CN)6]3 + 12NaCl
సల్ఫర్ పరీక్ష :
ఒక భాగం సోడియం నిష్కర్షణ తీసుకుని దానికి తాజాగా తయారుచేసిన సోడియం నైట్రోఫ్రుసైడ్ ద్రావణం కలపాలి. ముదురు ఊదారంగు వస్తుంది.
Na2S + Na2 [Fe(CN)5NO] → Na4 [Fe (CN)5NOS]
హలోజన్ల పరీక్ష :
సోడియం నిష్కర్షణను నైట్రికామ్లంతో ఆమ్లీకృతం చేసి AgNO, ద్రావణాన్ని కలపాలి.
NaX + AgNO3 → AgX + NaNO3
(a) తెల్లని అవక్షేపం ఏర్పడి అది NH OH ద్రావణంలో కరిగితే క్లోరిన్ వుంటుంది.
AgCl + 2NH4OH → [Ag (NH3)2]Cl + 2H2O
(b) లేత పసుపు పచ్చ అవక్షేపం ఏర్పడి అది NH4OH ద్రావణంలో అతి తక్కువగా కరిగితే బ్రోమిన్ వుంది.
(c) పసుపు పచ్చని అవక్షేపం ఏర్పడి అది NH4OH ద్రావణంతో దాదాపు కరిగితే అయొడిన్ వున్నట్లు నిర్ధారణ అయ్యింది.
ప్రశ్న 17.
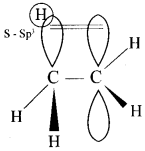
అతి సంయుగ్మంను వివరింపుము.
జవాబు:
1) C– H బంధంలోని ‘σ’ ఎలక్ట్రాన్ లు π బంధం ఎలక్ట్రాన్లతో అస్థానీకృతం చెందుటను అతి సంయుగ్మం అంటారు.
2) ఆల్కైల్ సమూహంలు అసౌష్టవ ద్విబంధ అణువులతో లేక బెంజీన్ తో కలిసి ఉన్నప్పుడు ఆల్కైల్ సమూహము పైన చెప్పిన విధంగా ఎలక్ట్రాన్లను విడుదల చేయును.
3) ఇథైల్ కాటాయాన్ లో ధనావేశిత కార్బన్ యొక్క ఖాళీ p- ఆర్బిటాల్ CH3 సముహంలోని C – H బంధంతో అతిపాతం జరుపును.
4) ఈ విధమైన అతిపాతం ఇథైల్ కాటయాన్ కు స్థిరత్వంను చేకూర్చును.
ధనావేశత కార్బన్ కు కలుపబడిన ఆల్కైల్ సమూహంల సంఖ్య
పెరిగే కొలది కార్బో కాటాయాన్ స్థిరత్వం పెరుగును.
![]()
![]()
ప్రశ్న 18.
ఫ్రీడల్ క్రాప్ట్ ఆల్కలీకరణంను వివరింపుము. [Mar ’13]
i) ఎలక్ట్రోఫైల్ ఏర్పడుట (E+)
కారకంలో లూయీ ఆమ్లం చర్య జరిపి ఎలక్ట్రోఫైల్ (X+) ను ఉత్పత్తి చేయును.
![]()
ii) a) కార్బోకాటాయాన్ ఏర్పడుట
బెంజీన్లోని ఒక కార్బన్ న్ను ఎలక్ట్రోఫైల్ను చేర్చనపుడు బెంజీన్ యొక్క సంకరీకరణం SP³ కి మారును. కార్బోకాటాయాన్ రిజొనెన్స్ ద్వారా స్థిరత్వంను పొందును.

b) ప్రోటాన్ ను కోల్పోవుట :
(AlCl4)– ను కలిగిన SP3 కార్బన్కు SP3 కార్బన్ మీద (AlCl4)– చేరి ఉన్నప్పుడు C+ ఒక ప్రొటాన్ ను కోల్పోవుట వల్ల ఇది తన ఆరోమాటక్ లక్షణాన్ని తిరిగి పొందుతుంది.