Students get through AP Inter 2nd Year Chemistry Important Questions 4th Lesson ఉపరితల రసాయనశాస్త్రం which are most likely to be asked in the exam.
AP Inter 2nd Year Chemistry Important Questions 4th Lesson ఉపరితల రసాయనశాస్త్రం
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
అంతర్అలం అంటే ఏమిటి? ఒక ఉదాహరణ తెల్పండి.
జవాబు:
రెండు ప్రావస్థలను వేరుపరిచే ఉమ్మడి తలాన్ని ‘అంతర్ తలం’ అంటారు.
ఆయతమ ప్రావస్థలను ఒక అడ్డుగీత (-) లేదా ఒక నిలువు గీత (/) ద్వారా వేరు పరుస్తూ అంతర్తలాన్ని వ్యక్తం చేస్తారు.
ఉదాహరణకు ఘనపదార్థం, వాయుపదార్థాల మధ్య అంతర్అలాన్ని ఘనస్థితి -వాయువు, లేదా ఘనస్థితి/ వాయువు అని వ్యక్తం చేస్తారు.
ప్రశ్న 2.
అధిశోషణం అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
ఒక పదార్థము యొక్క ఉపరితలము పై వేరొక పదార్ధము వాయుస్థితిలో లేక ద్రవస్థితిలో పోగయ్యి అతుక్కునే ప్రక్రియను అధిశోషణము అంటారు. ఉదా: చార్ కోల్ పై ఎసిటిక్ ఆమ్లం, CO2, SO2, Cl2 మొదలైనవి.
ప్రశ్న 3.
అభిశోషణం అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
వాయు అణువులు లేక ద్రవము లేక ద్రావితము అణువులు ఉపరితలముపై మాత్రమే కాక పదార్థం యొక్క అంతరభాగములో కూడా వీల్చుకోబడే ప్రక్రియను అభిశోషణము అంటారు.
ఉదా: నీటిలో ముంచిన స్పాంజ్
ప్రశ్న 4.
అధిశోషణం, అభిశోషణం వీటిని భేదపర్చండి. ప్రతిదానికి ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
అధిశోషణం ఉపరితల ధర్మము. ఇది కేవలం అధిశోషకం ఉపరితలంపై మాత్రమే జరుగును. అభిశోషణం పదార్థాల ఆయతన ధర్మము. ఇది పదార్థం యొక్క అంతరభాగంలో కూడా పీల్చుకోబడును.
ఉదా: అనార్థ కాల్షియం క్లోరైడ్ నీటి అణువులను అభిశోషించుకుంటుంది. అయితే సిలికాజెల్ మాత్రం నీటిని అధిశోషించుకుంటుంది.
ప్రశ్న 5.
సిలికాజెల్ సమక్షంలో తేమతో కూడిన గాలి, తడి లేకుండా మారుతుంది. దీనికి కారణం ఏమిటి?
జవాబు:
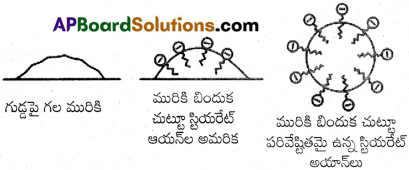
గాలిలో చోటు చేసుకున్న నీటి అణువులు సిలికాజెల్ ఉపరితలంపై అధిశోషణం చెందడం వల్ల సిలికాజెల్ సమక్షంలో తేమతో కూడిన గాలి, తడి లేకుండా మారుతుంది.
![]()
ప్రశ్న 6.
మెథిలీన్ బ్లూ ద్రావణానికి జాంతవ బొగ్గును కలిపి గిలకరించి ద్రావణాన్ని వడపోస్తే ఏర్పడిన గాలితం రంగును కోల్పోతుంది. కారణం తెల్పండి.
జవాబు:
మిథిలీన్ బ్లూ లాంటి కర్బన రంజన పదార్థ ద్రావణానికి జాంతవ బొగ్గును చేర్చి ద్రావణాన్ని బాగా కుదిపి గాలించినట్లైతే రంగును కోల్పోయిన గాలితం ఏర్పడును. దీని ప్రకారం ద్రావణం కారణం అయిన రంజన పదార్థపు అణువుల బొగ్గు ఉపరితలం పై ‘ అధిశోషణం చెందినట్లు తెలుస్తుంది.
ప్రశ్న 7.
నీటి ఆవిరి గల పాత్రలో రెండు భాగాలలో కొద్ది పరిమాణంలో సిలికాజెల్, అనార్ధ్ర కాల్షియమ్ క్లోరైడ్ను వేరుగా ఉంచాం. ఏ ఘటన లేదా దృగ్విషయం జరుగుతుంది.
జవాబు:
అనార్ద్ర కాల్షియం క్లోరైడ్ నీటి అణువులను అభిశోషించుకొంటుంది. అయితే సిలికాజెల్ మాత్రం నీటిని అధిశోషించుకుంటుంది.
ప్రశ్న 8.
విశోషణం అనగానేమి?
జవాబు:
ఒక ఉపరితలం నుంచి దానిపై అధిశోషణం చెందిన పదార్థాన్ని తొలగించే పదార్థాన్ని తొలగించే ప్రక్రియను ‘విశోషణం’ (desorption) అంటారు.
ప్రశ్న 9.
శోషణం అనగానేమి?
జవాబు:
అధిశోషణం, అభిశోషణం రెండూ కూడా ఒకే సారి జరుగుతాయి.ఈ ప్రక్రియను ‘శోషణం’ అంటారు.
ప్రశ్న 10.
అధిశోషణం, అభిశోషణం వీటిలో ఉపరితల ఘటన ఏది? ఎందువల్ల?
జవాబు:
అధిశోషణం, అభిశోషణంలలో అధిశోషణం ఉపరితల ఘటన. అణువులు కేవలం పదార్థం ఉపరితలంపై మాత్రమే స్థిరపడతాయి.
ప్రశ్న 11.
అధిశోషణం, అభిశోషణం రెండూ ఏకకాలంలో జరిగితే ఆ ఘటనను ఏమంటారు?
జవాబు:
శోషణం
![]()
ప్రశ్న 12.
సిరాలో ముంచి ఉంచిన సుద్దముక్క క్రింది వాటిని ప్రదర్శిస్తుంది.
a) ముక్క ఉపరితలంపై సిరా రంగు నిలిచి ఉంటుంది.
b) సుద్దముక్కను ముక్కలు చేస్తే లోపలి భాగం తెలుపుగానే ఉంటుంది. పై పరిశీలనలను వివరించండి.
జవాబు:
ఒక సుద్ద ముక్కను రాసే సిరాలో కొంతసేపు ముంచి ఉంచినట్లైతే, ముక్క ఉపరితలం సిరా రంగును గ్రహిస్తుంది. దీనికి కారణం సిరాలోని రంగు అణువులు ముక్క ఉపరితలంపై అధిశోషణం చెందడం. అయితే సిరాద్రావణంలోనిద్రావణి సుద్ద ముక్క అంతర్భాగాలలోకి అభిశోషణం ప్రక్రియ ద్వారా చొచ్చుకొనిపోతుంది. కాబట్టి సుద్ద ముక్కను, ముక్కలుగా చేసినట్లైతే దాని లోపలి భాగాలు రంగు లేకుండానే ఉంటాయి.
ప్రశ్న 13.
ఘనపదార్థంపై వాయువు అధిశోషణాన్ని ప్రభావితం చేసే అంశాలను తెలపండి.
జవాబు:
ఘనపదార్థంపై వాయువు అధిశోషణాన్ని ప్రభావితం చేసే అంశాలు:
- వాయువు స్వభావం
- అధిశోషితం ఉపరితల వైశాల్యం
- పీడనం
- ఉష్ణోగ్రత
- అధిశోషితం యొక్క ఉత్తేజిత శక్తి.
ప్రశ్న 14.
అధిశోషణం ఎప్పుడూ ఉష్ణమోచకంగానే ఉంటుంది. కారణం ఏమిటి?
జవాబు:
అధిశోషణం ప్రక్రియలో అధిశోషణం ఉపరితలంపై ఉండే అవశేష బలాల సంఖ్య తగ్గుతుంది. అంటే ఉపరితల శక్తి తగ్గుతుంది. ఇలా తగ్గిన శక్తి ఉష్ణరూపంలో వెలువడుతుంది. కాబట్టి అధిశోషణ ప్రక్రియ ప్రధానంగా ఉష్ణమోచక చర్య.
ప్రశ్న 15.
బొగ్గుపై అమోనియా వాయువు అధిశోషణం చెందినప్పుడు ∆H, ∆S విలువల సంజ్ఞలు ఎలా ఉంటాయి?
జవాబు:
∆H = —ve; ∆S = – ve
ప్రశ్న 16.
అధిశోషణం ఎన్ని రకాలు? అవి ఏవి?
జవాబు:
అధిశోషణ ప్రక్రియలో అణువుల మధ్యగల బలాల ఆధారముగా
a) భౌతిక అధిశోషణము
b) రసాయన అధిశోషణము
![]()
ప్రశ్న 17.
ఘనపదార్థంపై వాయువు జరిపే ఫిజిసార్లోన్లో ఏరకం బలాలు ఇమిడి ఉన్నాయి?
జవాబు:
బలహీన వాండర్ వాల్ బలాలు.
ప్రశ్న 18.
ఘనపదార్థంపై వాయువు జరిపే కెమిసారను వాయు అణువులకు ఘనపదార్థం ఉపరితలానికి మధ్య జరితే ఏ రకం అన్యోన్య చర్య కారణం?
జవాబు:
ఘనపదార్థాల ఉపరితలంపై వాయు అణువులు లేదా పరమాణువులు రసాయన బంధాల ద్వారా పోగు చేయబడితే,ఆ అధిశోషణాన్ని రసాయన అధిశోషణం లేదా కెమిసార్షన్ అంటారు.
ప్రశ్న 19.
కెమిసారన్ను ఎందుకు ఉత్తేజిత అధిశోషణం అంటారు?
జవాబు:
కెమిసాల్షన్ ప్రక్రియ అధిక ఉత్తేజిత శక్తితో కూడుకొన్న ప్రక్రియ. ఈ కారణంగా దీనిని ‘ఉత్తేజిత అధిశోషణం’ అంటారు.
ప్రశ్న 20.
ఫిజిసాల్షన్, కెమిసార్షన్ల మధ్య గల భేదం ఏమిటి?
జవాబు:
భౌతిక అధిశోషణంలో అధిశోషకం, అధిశోషితం లు బలహీన వాండర్ వాల్ బలాలచే బంధింపబడి ఉంటాయి.కానీ రసాయన అధిశోషణంలో బలమైన రసాయన బంధాలచే బంధింపబడి ఉంటాయి.
ప్రశ్న 21.
ఫిజిసార్న్, కెమిసారన్ల మధ్య ఏది ఉత్రమణీయంగా ఉంటుంది.
జవాబు:
భౌతిక అధిశోషణం
ప్రశ్న 22.
వాయువు సందిగ్ధ ఉష్ణోగ్రతతో వాయు అధిశోషణానికి ఎలా సంబంధం ఉంది?
జవాబు:
అధిక సందిగ్ధ ఉష్ణోగ్రత ప్రదర్శించే వాయువులు సులభంగా అధిశోషణం చెందుతాయి.
హైడ్రోజన్ వాయువు కంటే (సందిగ్ధ ఉష్ణోగ్రత33K) అధిక పరిమాణంలో నైట్రోజన్ వాయువును (సందిగ్ధ ఉష్ణోగ్రత126K) అధిశోషించుకుంటుంది.
![]()
ప్రశ్న 23.
SO2 సందిగ్ధ ఉష్ణోగ్రత 630K, CH4 సందిగ్ధ ఉష్ణోగ్రత 190K. వీటిలో ఏది బొగ్గుపై సులభంగా అధిశోషణం చెందుతుంది? ఎందుకు?
జవాబు:
సామాన్యంగా సులభంగా ద్రవాలుగా మారే వాయువులు (అంటే అధిక సందిగ్ధ ఉష్ణోగ్రత ప్రదర్శించే వాయువులు) సులభంగా అధిశోషణం చెందుతాయి. ఎందుకంటే సందిగ్ధ ఉష్ణోగ్రతల వద్ద వాండర్ వాల్స్ బలాల పరిమాణం అధికంగా ఉంటుంది. ఒక గ్రాము బొగ్గు, తన ఉపరితలంపై మీథేన్ వాయువు కంటే (సందిగ్ధ ఉష్ణోగ్రత 190K) అధిక పరిమాణంలో సల్ఫరై ఆక్సైడ్ వాయువును (సందిగ్ధ ఉష్ణోగ్రత 630K) అధిశోషించుకుంటుంది.
ప్రశ్న 24.
సులభంగా ద్రవీకరణం చెందే వాయువులు ఘనపదార్థాలపై సులభంగా అధిశోషించబడతాయి. ఎందుకు?
జవాబు:
సామాన్యంగా సులభంగా ద్రవాలుగా మారే వాయువులు (అంటే అధిక సందిగ్ధ ఉష్ణోగ్రత ప్రదర్శించే వాయువులు) సులభంగా అధిశోషణం చెందుతాయి. ఎందుకంటే సందిగ్ధ ఉష్ణోగ్రతల వద్ద వాండర్వాల్స్ బలాల పరిమాణం అధికంగా ఉంటుంది.
ప్రశ్న 25.
SO2, H2 లలో ఏది బొగ్గుపై సులభంగా అధిశోషణం చెందుతుంది? కారణం ఏమిటి?
జవాబు:
హైడ్రోజన్ కంటే సల్ఫర్ డైఆక్సైడ్కు సందిగ్ధ ఉష్ణోగ్రత ఎక్కువ. అధిక సందిగ్ధ ఉష్ణోగ్రత ప్రదర్శించే వాయువులు సులభంగా అధిశోషణం చెందుతాయి. కాబట్టి బొగ్గు ఉపరితలంపై హైడ్రోజన్ కంటే SO2 వాయువును అధిక పరిమాణంలో అధిశోషించుకుంటుంది.
ప్రశ్న 26.
ఫిజిసాల్షన్, కెమిసార్షన్ల ఎంథాల్పీ విలువలను తులనం చేయండి.
జవాబు:
భౌతిక అధిశోషణం ఉష్ణమోచక ప్రక్రియ అయినప్పటికీ దీని అధిశోషణం ఎంథాల్పీ విలువ చాలా అల్పం (20-40 KJ mol-1). దీనికి కారణం వాయు అణువులకు, ఘనపదార్థ ఉపరితలానికి మధ్య ఉండే ఆకర్షణ బలాలు బలహీన వాండర్ వాల్ బలాలు. కెమిసారేషన్ ఎంథాల్పీ విలువ అధికం (80-240 KJ mol-1) ఎందుకంటే దీనిలో రసాయన బంధం ఏర్పడుతుంది.
ప్రశ్న 27.
భౌతిక అధిశోషణం ఎంథాల్పీ విలువ పరిమాణం ఎలా ఉంది? దీనికి కారణం తెలపండి.
జవాబు:
దీని అధిశోషణం ఎంథాల్పీ విలువ చాలా అల్పం (20-40 KJmol-1) దీనికి కారణం వాయు అణువులకు, ఘనపదార్థ ఉపరితలానికి మధ్య ఉండే ఆకర్షణ బలాలు బలహీన వాండర్వాల్ బలాలు.
![]()
ప్రశ్న 28.
కెమిసాల్షన్ ఎంథాల్పీ విలువ పరిమాణం ఏమిటి? ఈ పరిమాణానికి కారణం ఏమిటి?
జవాబు:
కెమిసారేషన్ ఎంథాల్పీ విలువ అధికం (80-240 KJ mol-1). ఎందుకంటే దీనిలో రసాయన బంధం ఏర్పడుతుంది.
ప్రశ్న 29.
అధిశోషణం అనువర్తనాలు రెండింటిని తెలపండి.
జవాబు:
అధిశోషణం రెండు అనువర్తనాలు:
i) అధికశూన్య స్థితిని ఏర్పరచడం :
ఒక పాత్రలో అధిక శూన్యస్థితిని పొందడానికి ఆ పాత్రలోని గాలిని నిర్వాత పంపు ద్వారా తొలగిస్తారు. ఈ ప్రక్రియలో పాత్రలో ఇంకా మిగిలి ఉన్న కొద్దిపాటి గాలిని, బొగ్గును ఉపయోగించి అధిశోషణ ప్రక్రియ ద్వారా తొలగిస్తారు.
ii) వాయు ముసుగు (gas mask) :
బొగ్గు గనులలో పనిచేసే కార్మికులు గాలిని పీల్చుకొనేటప్పుడు గాలి లోని విషవాయువులను అధిశోషించుకోవడానికి వాడే సాధనాన్ని వాయు ముసుగు అంటారు. ఇది ఉత్తేజపరిచిన బొగ్గు లేదా ఇతర అధిశోషకాల మిశ్రమంతో నిండి ఉంటుంది.
ప్రశ్న 30.
ఫిజిసారన్కు ఎందుకు విశిష్టత లేదా వరణాత్మకత లేదు?
జవాబు:
వాండర్వాల్స్ బలాల సార్వత్రికం కాబట్టి అధిశోషకం ఉపరితలం ఏ వాయువుపైనా ప్రత్యేకమైన ఇష్టతను ప్రదర్శించదు.
ప్రశ్న 31.
అధిశోషణ సమోష్ణరేఖ అంటే ఏమిటి? ఫ్రాయిండ్లిష్ సమోష్ణరేఖ సమీకరణం వ్రాయండి.
జవాబు:
ఫ్రాయిండ్లిష్ శాస్త్రవేత్త నిర్దేశిత ఉష్ణోగ్రత వద్ద ఏకాంక ద్రవ్యరాశి గల ఘనస్థితిలోని అధిశోషకం పై అధిశోషణం చెందే వాయువు(x/m) సంబంధాన్ని ప్రతిపాదించాడు. ఈ సంబంధాన్ని ఈ క్రింది సమీకరణం సూచిస్తుంది.
\(\frac{x}{m}\) = Kp1/n
x → అధిశోషితం ద్రవ్యరాశి
m → అధిశోషకం ద్రవ్యరాశి
n, k → స్థిరాంకాలు
p → పీడనం లేదా అధిశోషణ సమతాస్థితి స్థిరాంక పీడనం.
![]()
ప్రశ్న 32.
ఏ పరిస్థితులలో ఫ్రాయిండ్లిష్ సమోష్ణరేఖ సమీకరణం క్రింది రేఖాపటాన్ని ప్రదర్శిస్తుంది?
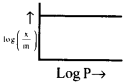
జవాబు:
అధిక పీడనాల వద్ద అధిశోషణం ప్రక్రియ సంతృప్తం కావడం కారణంగా వక్రాలు స్థిరత్వం చేరే స్వభావాన్ని కనబరుస్తాయి. 1/n = 0 అయితే x/m స్థిరము. అంటే అధిశోషణం వీడనం పై ఆధారపడదు. ఈ పరిస్థితులలో ఇచ్చిన రేఖా పటం నిజమైనది.
ప్రశ్న 33.
విజాతి ఉత్ప్రేరణంలో అధిశోషణం పాత్ర ఏమిటి?
జవాబు:
క్రియాజనకాలు, ఉత్ప్రేరకం, భిన్న ప్రావస్థలలో ఉండే ఉత్ప్రేరక చర్యను విజాతి ఉత్ప్రేరకం అంటారు. ఘనస్థితిలో ఉండే ఉత్ప్రేరకాల ఉపరితలాలపై చర్యలోని క్రియాజనకాలు అధిశోషణం చెందడం ద్వారా చర్యావేగం పెరుగుతుంది. ఒక ఉత్ప్రేరకం, ఉత్ప్రేరణ క్రియాశీలత దాని ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది.
- ఉత్ప్రేరకం ఉపరితలం వద్దకు క్రియాజనకాల వ్యాపనం.
- ఉత్ప్రేరకం ఉపరితలంపై క్రియాజనకాలు అధిశోషణం చెందడం.
- మధ్యస్థ పదార్థం ఏర్పడడం ద్వారా ఉత్ప్రేరకం ఉపరితలంపై రసాయన చర్య జరగడం.
- ఉత్ప్రేరకం ఉపరితలం నుండి క్రియాజన్యాలు విశోషణం చెందడం ఫలితంగా తిరిగి మరికొంత మేర రసాయన చర్య జరగడానికి శుద్ధ ఉపరితలాన్ని సమకూర్చడం ఈ సిద్ధాంతాన్ని విజాతి ఉత్ప్రేరణ అధిశోషణ సిద్ధాంతం అంటారు.
ప్రశ్న 34.
KClO3 నుండి O2 తయారీలో MnO2 పాత్ర ఏమిటి?
జవాబు:
MnO2 ఉత్ప్రేరకంగా పని చేస్తుంది.
ప్రశ్న 35.
ఉత్ప్రేరణం ఘటనలో ప్రమోటర్లు (ప్రవర్థకాలు), ‘విష పదార్థాలు’ వీటిని నిర్వచించండి.
జవాబు:
ఉత్ప్రేరకం యొక్క ఉత్ప్రేరణ క్రియాశీలతను పెంచే ఇతర పదార్థాలను ప్రవర్థకాలు (promoters) అంటారు.
ఉత్ప్రేరకం క్రియాశీలతను తగ్గించే లేదా పూర్తిగా హరించే ఇతర పదార్థాలను విషపదార్థాలు (poisons) అంటారు.
ప్రశ్న 36.
సజాతి ఉత్ప్రేరణ అంటే ఏమిటి? ఇది విజాతి ఉత్ప్రేరణం నుండి ఏవిధంగా భేదిస్తుంది?
జవాబు:
ఒక చర్యలో క్రియాజనకాలు, ఉత్ప్రేరకం అన్నీ ఒకే ప్రావస్థలో (ద్రవం లేదా వాయువు) ఉన్నట్లైతే ఈ చర్యను సజాతి ఉత్ప్రేరణ చర్య అంటారు.
సజాతి ఉత్ప్రేరణను మధ్యస్థ పదార్థం ఏర్పాటు సిద్ధాంతం ద్వారా వివరిస్తారు కానీ విజాతి ఉత్ప్రేరణను భౌతిక అధిశోషణ సిద్ధాంతం ద్వారా వివరిస్తారు.
ప్రశ్న 37.
సజాతి ఉత్ప్రేరణ చర్యలకు రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
సజాతి ఉత్ప్రేరణ చర్యకు కొన్ని ఉదాహరణలు:
- లెడ్ చాంబర్ ప్రక్రియలో సల్ఫరై ఆక్సైడు, ఆక్సిజన్ తో చర్య ద్వారా సల్ఫర్ ఆక్సైడ్గా ఆక్సీకరణం చేసే ప్రక్రియలో నైట్రోజన్ ఆక్సైడ్లను ఉత్ప్రేరకంగా వాడతారు. క్రియాజనకాలు సల్ఫర్ డై ఆక్సైడ్, ఆక్సిజన్ ఉత్ప్రేరకం నైట్రిక్ ఆక్సైడ్ అన్నీ కూడా ఒకే ప్రావస్థలో (వాయువు ) ఉన్నాయి.
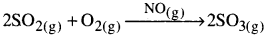
- హైడ్రోక్లోరిక్ ఆమ్లం పొందుపరచిన H+ అయాన్లు మిథైల్ఎసిటేట్ జలవిశ్లేషణ చర్యను ఉత్ప్రేరణం చేస్తాయి.
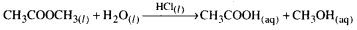
పై రెండు ఉదాహరణలలో క్రియాజనకాలు, ఉత్ప్రేరకం అన్నీ ఒకే ప్రావస్థలో (ద్రవం) లో ఉన్నాయి.
![]()
ప్రశ్న 38.
విజాతి ఉత్ప్రేరణ చర్యలకు రెండు ఉదాహరణలు వ్రాయుము.
జవాబు:
విజాతి ఉత్ప్రేరణ చర్యలకు రెండు ఉదాహరణలు :
- ప్లాటినం సమక్షంలో సల్ఫర్ డైఆక్సైడ్, సల్ఫర్ ట్రై ఆక్సైడ్గా ఆక్సీకరణం జరిగే చర్య.
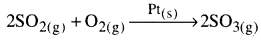
- ఆస్వాల్డ్ పద్ధతిలో ప్లాటినమ్ గాజ్ సమక్షంలో NH3, నైట్రిక్ ఆక్సైడ్గా ఆక్సీకరణం చెందే చర్య.
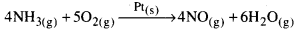
పై రెండు ఉదాహరణలలో క్రియాజనకాలు వాయు స్థితిలోనూ, ఉత్ప్రేరకం pt ఘనస్థితిలోను ఉన్నాయి.
![]()
ప్రశ్న 39.
విజాతి ఉత్ప్రేరణం ప్రదర్శించే వరణాత్మకతకు రెండు ఉదాహరణలు తెలపండి.
జవాబు:
ఒక రసాయన చర్యలో పాల్గొనే క్రియాజనకాలు ఆశించిన భిన్న క్రియాజన్యాలను ఏర్పర్చే విధంగా చర్యను దిశాత్మకం చేయడాన్ని వరణాత్మకత అంటాం ఉదాహరణకు H2, CO క్రియాజనకాలు భిన్న ఉత్ప్రేరకాల సమక్షంలో భిన్న క్రియజన్యాలను ఏర్పరుస్తాయి.
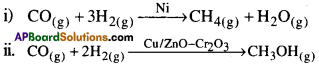
దీనిని అనుసరించి ఒక ఉత్ప్రేరకం చర్య బలమైన వరణాత్మక స్వభావాన్ని ప్రదర్శిస్తుంది అని తెలుస్తుంది.
ప్రశ్న 40.
జియోలైట్లను ఆకార వరణాత్మక ఉత్ప్రేరకాలు అని ఎందుకు అంటారు?
జవాబు:
ఉత్ప్రేరకంపై చోటు చేసుకొని ఉండే రంధ్రాల పరిమాణం ఆధారంగాను, క్రియాజనకాల క్రియాజన్యాల అణువుల సాపేక్ష పరిమాణాల ఆధారంగాను జరిగే ఉత్ప్రేరక చర్యను ఆకార ఆధారిత వరణాత్మక ఉత్ప్రేరణం అంటారు. జియోలైట్లకు తేనేపట్టు ఆకారంలో గల నిర్మాణం ఉండటం కారణంగా అవి ఆకార ఆధారిత వరణాత్మక ఉత్ప్రేరకాలుగా పని చేస్తాయి. సూక్ష్మరంధ్రాలు గల సచ్ఛిద్ర అల్యూమినో సిలికేట్లు జియోలైట్లు. ఇవి కొన్ని సిలికాన్ పరమాణువులు, అల్యూమినియం పరమాణువులతో ప్రతిక్షేపితమై Al- O-Si త్రిమితీయ యూనిట్లు గల నిర్మాణంలో గల సిలికేట్లు.
ప్రశ్న 41.
ఆల్కహాల్లను గాసొలీన్ గా ప్రత్యక్షంగా మార్చే ఏ జియోలైట్ ఉత్ప్రేరకాన్ని ఉపయోగిస్తారు?
జవాబు:
ZSM – 5
ప్రశ్న 42.
ఎంజైమ్లు అంటే ఏమిటి? మానవ శరీరంలో వీటి పాత్ర ఏమిటి?
జవాబు:
ప్రాణం గల మొక్కలు, జంతువులు ఉత్పత్తి చేసే సంక్లిష్ట నైట్రోజన్ కర్బన సమ్మేళనాలు ఎంజైమ్లు. ఇవి వాస్తవానికి అధిక మోలార్ ద్రవ్యరాశి గల ప్రోటీన్ 49. అణువులు ఇవి నీటిలో కొల్లాయిడ్ ద్రావణాలను ఏర్పరుస్తాయి. ఇవి అధిక క్రియాశీలతను ప్రదర్శించే ఉత్ప్రేరకాలు. ఉదరంలో పెప్సిన్ ఎంజైమ్ ప్రోటీన్లను పెప్టైడ్లుగా మారుస్తుంది. ప్రేవులలో, ట్రిప్సిన్ ఎంజైమ్ ప్రోటీన్ ను జలవిశ్లేషణంలో ఎమైనో ఆమ్లాలుగా మారుస్తుంది. ఈ ఎమైనో ఆమ్లాలు రక్తంచే అధిశోషింపబడి, కణజాలాల నిర్మాణంలో తోడ్పడతాయి.
ప్రశ్న 43.
ఒక రసాయన దిగుబడిని ఉత్ప్రేరకం పెంచగలదా?
జవాబు:
చర్యారేటును పెంచడం ద్వారా, ఉత్ప్రేరకం రసాయన దిగుబడిని పెంచుతుంది.
ప్రశ్న 44.
రెండు ఎంజైమ్ ఉత్ప్రేరణ చర్యలను తెలపండి. చర్యలు వ్రాయండి.
జవాబు:
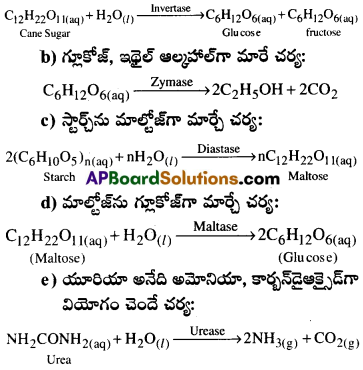
i) చక్కెర విలోమ చర్య :
ఇన్వర్టేజ్ ఎంజైమ్ చక్కెరను గ్లూకోజ్, ఫ్రక్టోజ్లుగా మార్పు.
![]()
ii) గ్లూకోజ్ ఇథైల్ ఆల్కహాల్గా మారే చర్య:
జైమేజ్ ఎంజైమ్ గ్లూకోజు ఇథైల్ ఆల్కహాల్, కార్బనై ఆక్సైడ్గా మారుస్తుంది.
![]()
ప్రశ్న 45.
సోయాబీన్ల నుంచి లభించే ఎంజైమ్లు ఏవి?
జవాబు:
యూరియేజ్.(యూరియాను, అమ్మోనియా మరియు కార్బన్ డైఆక్సైడ్గా విఘటనం చెందించడంలో ఉపయోగపడుతుంది.)
ప్రశ్న 46.
క్రింది వాటిలో ఉపయోగించే ఎంజైమ్లను తెలపండి.
a) యూరియా, అమోనియాగా విఘటనం చెందడం.
b) ప్రోటీన్లు, పెప్లైడ్లుగా ఉదరంలో మారడం.
జవాబు:
a) యూరియేజ్
b) పెస్పిన్
![]()
ప్రశ్న 47.
ఈస్ట్ నుంచి లభించే ఎంజైమ్లు ఏమి?
జవాబు:
ఇన్వర్టేజ్, జైమేజ్ మరియు మాల్టేజ్
ప్రశ్న 48.
ఎంజైమ్లు అధిక క్రియాశీలతను ప్రదర్శించే ఉష్ణోగ్రత, pH ల పరిధులను తెలపండి.
జవాబు:
ఎంజైమ్ క్రియాశీలతకు అనువైన ఉష్ణోగ్రత వ్యాప్తి 298-310 K.
ఎంజైమ్ క్రియాశీలతకు యుక్తతమ pH 5-7 ల మధ్య ఉంటుంది.
ప్రశ్న 49.
ఎంజైమ్ ఉత్ప్రేరణను పటం ద్వారా వివరించండి.
జవాబు:
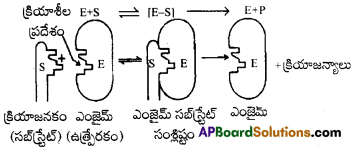
ఎంజైమ్ ఉత్ప్రేరణను వివరించే చర్యా విధానం :
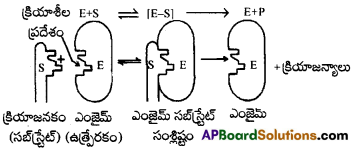
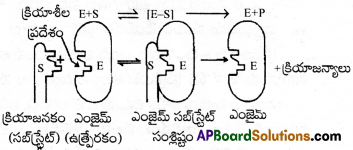
ఎంజైమ్లు కొల్లాయిడ్ కణాలలో చాలా డొల్లలు ఉంటాయి. వీటికి అభిలాక్షణిక ఆకారాలు ఉంటాయి. వీటిలో -NH2, -COOH, -SH, -OH లాంటి క్రియాశీలత గల గ్రూపులు కూడా ఉంటాయి. ఇవి ఎంజైమ్ కణాల ఉపరితలాలపై ఉత్తేజిత కేంద్రాలుగా పనిచేస్తాయి. క్రియాజనకం అణువులకు ఎంజైమ్ డొల్లలలో ఖచ్చితంగా అమరేటట్లు ఉండే సంపూరక ఆకారాలు ఉంటాయి. ఇది ఒక తాళంలోకి అమర్చే తాళం చెవి పరిస్థితిని పోలి ఉంటుంది. ఉత్తేజిత గ్రూపులు ఉండటం కారణంగా, ఒక ఉత్తేజిత సంక్లిష్టం ఎంజైమ్-సబ్స్ట్రేట్ల మధ్య ఏర్పడుతుంది. ఇది తదుపరి చర్యలో క్రియాజన్యాలుగా వియోగం చెందుతుంది.
ఈ విధంగా ఎంజైమ్ ఉత్ప్రేరిత చర్యలు రెండు అంచెలలో జరుగుతాయి. ఇవి
అంచె 1 :
ఎంజైమ్తో క్రియాజనకం బంధితమై ఉత్తేజిత సంక్లిష్టం (ES*).ఏర్పడుతుంది.
E + S → ES*
అంచె 2:
ఈ ఉత్తేజిత సంక్లిష్టం క్రియాజన్యాలుగా వియోగం చెందడం.
ES* → E + P
ప్రశ్న 50.
పారిశ్రామిక ప్రాముఖ్యం గల రెండు విజాతి ఉత్ప్రేరణ చర్యలను పేర్కొని వాటిలోని ఉత్ప్రేరకాలను తెలపండి.
జవాబు:
a) హేబర్ పద్ధతిలో సూక్ష్మ విభాజిత ఐరన్ సమక్షంలో నైట్రోజన్, హైడ్రోజన్ సంయోగం చెంది NH3ను ఏర్పరుస్తుంది.
![]()
b) సూక్ష్మ విభాజిత నికెల్ లోహం ఉత్ప్రేరకంగా ఉండే వృక్ష సంబంధిత తైలాల హైడ్రజనీకరణ చర్యల (వనస్పతి)

ప్రశ్న 51.
కొల్లాయిడ్ ద్రావణం అంటే ఏమిటి? ఇది నిజద్రావణం నుంచి విక్షిప్త కణం పరిమాణంలోను, సజాతి స్వభావంలోను ఏవిధంగా విభేదిస్తుంది?
జవాబు:
ఒక పదార్థం (విక్షేపణ యానకం) లో పెద్దసైజు కణాలుగా వేరొక పదార్థం (విక్షిప్త ప్రావస్థ) విక్షేపణం చెంది ఏర్పరచిన విజాతి వ్యవస్థను కొల్లాయిడ్ ద్రావణం అంటారు. నిజ ద్రావణానికి, కొల్లాయిడ్ ద్రావణానికి గల ముఖ్యమైన భేదం, విక్షిప్త ప్రావస్థగా ఉండే పదార్థకణ పరిమాణం. నిజ ద్రావణంలో విక్షిప్త ప్రావస్థకణాలు అయాన్లు లేదా చిన్న అణువులుగా ఉంటాయి.
కొల్లాయిడ్లలో బృహత్ అణువులు (ప్రోటీన్లు లేదా సంశ్లేషిత పాలిమర్లు వంటివి) లేదా అధిక సంఖ్యలో పరమాణువులు లేదా అయాన్లు, లేదా అణువులు కలిసి ఏర్పరచిన సముచ్ఛయాలు విక్షిప్త ప్రావస్థ పదార్థకణాలుగా ఉంటాయి. కొల్లాయిడ్ కణాలు, సాధారణ అణువుల కంటే పెద్దవిగా ఉంటాయి. అయితే అవి అవలంబన స్థితిలో ఉండటానికి వీలైన పరిమాణంలో ఉంటాయి.
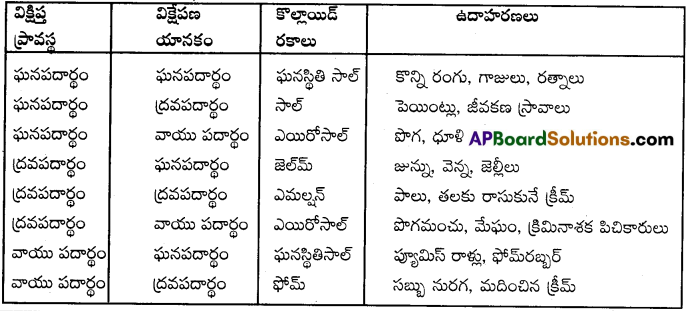
ప్రశ్న 52.
క్రింది కొల్లాయిడ్ వ్యవస్థలలో విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం వీటిని తెలపండి. (i) పొగమంచు (ii) పొగ (iii) పాలు కొల్లాయిడ్ వ్యవస్థ
జవాబు:
| కొల్లాయిడ్ వ్యవస్థ | విక్షిప్త ప్రావస్థ | విక్షేపక యానకం |
| i) పొగమంచు | నీటి బిందువులు | గాలి |
| ii) పొగ | కార్బన్ కణాలు | గాలి |
| iii) పాలు | ద్రవ కొవ్వు బిందువులు | నీరు |
ప్రశ్న 53.
లియోఫిలిక్, లియోఫోబిక్ సాల్లు అంటే ఏమిటి? ఒక్కొక్కదానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
లియోఫిలిక్ సాల్ (ద్రవ ప్రియసాల్) :
వీటిని ద్రవ ప్రియ కొల్లాయిడ్లు అంటారు. ఇవి అత్యంత స్థిరమైనవి. వీటి యందు విక్షేపక యానకమునకు మరియు విక్షేపక ప్రావస్థకు మధ్య ఆపేక్ష ఎక్కువ.
ఉదా: స్టార్చ్ ద్రావణము, జిలాన్, జిగురు మొదలగునవి అధిక అణుభారంకల కర్బన సమ్మేళనాలు కల ద్రావణాలు.
లియోఫోబిక్ సాల్ :
వీటిని ద్రవ విరోధి కొల్లాయిడ్లు అంటారు. ఇవి అస్థిరమైనవి. వీటి యందు విక్షేపక యానకమునకు విక్షేపక ప్రావస్థకు మధ్య ఆపేక్ష తక్కువ.
ఉదా: గోల్డ్సెల్, అల్పఅణుభారం గల ఇనార్గానిక్ లవణములు గల ద్రావణాలు, పొగ, లోహహైడ్రాక్సైడ్లు మొ॥
ప్రశ్న 54.
క్రింది పదాలను సరైన ఉదాహరణలతో వివరించండి. (i) ఏరోసాల్ (ii) హైడ్రోసాల్
జవాబు:
i) ఏరోసాల్ :
విక్షేపణ యానకం గాలి అయినట్లయితే సాల్ను ఎయిరోసాల్ అని అంటారు. ఉదా: పొగ, పొగమంచు.
ii) హైడ్రోసాల్ :
విక్షేపక యానకం నీరు అయినట్లయితే సాల్న ఆక్వాసాల్ లేదా హైడ్రోసాల్ అని అంటారు. ఉదా: పాలు, స్టార్చ్ ద్రావణం.
ప్రశ్న 55.
లియోఫిలిక్ కొల్లాయిడ్లు, లయోఫిలిక్ కొల్లాయిడ్ కంటే స్థిరంగా ఉంటాయి. కారణం తెలపండి.
జవాబు:
లియోఫిలిక్ సాల్లు, లియోఫోబిక్ సాల్ కంటే స్థిరమైనవి. దీనికి కారణం లియోఫిలిక్ సాల్ కణాలు అత్యధిక పరిమాణంలో ద్రావణీకరణం లేదా ఆర్ద్రీకరణం చెంది ఉంటాయి. అంటే కొల్లాయిడ్ కణాలు అవి విక్షేపం చెంది ఉన్న ద్రవం పొరతో కప్పి ఉంటాయి.
![]()
ప్రశ్న 56.
ద్రవ, ఘనపదార్థంలో విక్షిప్తం అయి ఏర్పరచిన రెండు కొల్లాయిడ్ వ్యవస్థలకు ఉదాహరణలు ఇవ్వండి. ఈ కొల్లాయిడ్ ద్రావణం పేరు ఏమిటి?
జవాబు:
జున్ను మరియు వెన్న.
జెల్ వంటి కొల్లాయిడల్ ద్రావణం.
ప్రశ్న 57.
బహుఅణుత, స్థూలఅణుత కొల్లాయిడ్ల మధ్య భేదం తెలపండి. ఒక్కొక్క దానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
బహుఅణుత కొల్లాయిడ్లు: వీటిలో అధిక సంఖ్యలో విక్షిప్త ప్రావస్థలోని పరమాణువులు లేదా లఘు అణువులు సముచ్ఛయం చెంది కొల్లాయిడ్ సైజు 62. జాతులను ఏర్పరుస్తాయి. ఇలా ఏర్పడిన జాతులను బహు అణుత కొల్లాయిడ్లు అంటారు. ఉదాహరణకు గోల్డ్సెల్లో బహుపరమాణువులు గల గోల్డ్కణాలు భిన్న పరిమాణాలలో ఉంటాయి. సల్ఫర్సెల్ కొల్లాయిడ్ కణంలో సుమారు ఒక వెయ్యి లేదా అంతకంటే ఎక్కువ Sg సల్ఫర్ అణువులు ఉంటాయి.
బృహత్ అణు కొల్లాయిడ్లు :
అనువైన ద్రావణిలో బృహత్ అణువులను కరిగిస్తే కొల్లాయిడ్ కణాల పరిధిలో ఉండే కణాలు ఉన్న ద్రావణాలు ఏర్పడతాయి. ఈ రకం వ్యవస్థలను బృహత్ అణు కొల్లాయిడ్లు అంటారు. ఈ కొల్లాయిడ్లు చాలా స్థిరంగా ఉంటాయి. ఇవి చాలా విషయాలలో నిజద్రావణాలను పోలి ఉంటాయి.
ఉదా: స్టార్చ్, సెల్యులోజ్
ప్రశ్న 58.
మిసెల్లు అంటే ఏమిటి? ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
ఒక చివర జలప్రియ మరొక చివర జల విరోధి స్వభావం గల కణాల సహచరితం వలన ఏర్పడే కణమును మిసెల్ అంటారు.
ఉదా: నీటిలో సోడియంస్టియరేట్ ఒక మిసెల్ను ఏర్పరుచును.
ప్రశ్న 59.
సాధారణ కొల్లాయిడ్ ద్రావణానికి, మిసెల్లకు గల |66. లయోఫోబిక్ కొల్లాయిడ్లను ఎందుకు ఉత్రమణీయం భేదం ఏమిటి?
జవాబు:
ఇవి అల్పగాఢతల వద్ద సాధారణ బలమైన విద్యుద్విశ్లేషకాలుగా ప్రవర్తించే పదార్థాలు అయితే అధిక గాఢతల వద్ద కొల్లాయిడ్ ప్రవర్తనను ప్రదర్శిస్తాయి. దీనికి కారణం ఇవి సముచ్ఛయాలను ఏర్పరచడం. ఈ విధంగా సముచ్ఛయం చెంది ఏర్పడిన కణాలను మిసెల్లు అంటారు. వీటిని సహచరిత కొల్లాయిడ్లు అని కూడా అంటారు.
ప్రశ్న 60.
సహచరిత కొల్లాయిడ్లకు రెండు ఉదాహరణలు తెలపండి.
జవాబు:
సబ్బులు, డిటర్జెంట్లు
ప్రశ్న 61.
ఒకే పదార్థం కొల్లాయిడ్గాను, క్రిస్టలాయిడ్గాను ప్రవర్తించగలదా?
జవాబు:
అవును. ఒకే పదార్థం కొల్లాయిడ్గాను, క్రిస్టలాయిడ్గాను ప్రవర్తించగలదు.
ఉదా: సోడియం క్లోరైడ్ ను నీటిలో కరిగిస్తే క్రిస్టలాయిడ్గాను, బెంజీన్లో కరిగిస్తే కొల్లాయిడ్గాను ప్రవర్తిస్తుంది.
ప్రశ్న 62.
లయోఫోబిక్ కొల్లాయిడ్లకు రెండు ఉదాహరణలు ఇవ్వండి.
జవాబు:
Fe(OH)3 వంటి లోహహైడ్రాక్సైడ్ మరియు As2S3 వంటి లోహసల్ఫైడ్
ప్రశ్న 63.
క్రింది కొల్లాయిడ్ వ్యవస్థలకు ఉదాహరణలు తెలపండి. (i) ఘనపదార్థంలో ద్రవం (ii) ఘనపదార్థంలో వాయువు
జవాబు:
(i) జెల్లీలు (ii) ప్యూమిస్ రాళ్ళు
ప్రశ్న 64.
లయోఫోబిక్ కొల్లాయిడ్లను ఏ పదార్థాలు ఏర్పరుస్తాయి?
జవాబు:
లోహాలు, లోహసల్ఫైడ్ లాంటి పదార్థాలను విక్షేపణ యానకంతో కలిపినంత మాత్రాన ఈ కొల్లాయిడ్ సాల్లు ఏర్పడవు. ఈ సాల్లను కొన్ని ప్రత్యేక పద్ధతులలో తయారు చేస్తారు.
ప్రశ్న 65.
సందిగ్ధ మిసెల్ గాఢత (CMC), క్రాఫ్ట్ ఉష్ణోగ్రత (Tk) అంటే ఏమిటి?
జవాబు:
ప్రత్యేకమైన గాఢత కంటే అధిక గాఢతల వద్ద మాత్రమే మిసెల్ ఏర్పడుతుంది. ఆ గాఢతను సందిగ్ధ మిసెల్ గాఢత అంటారు. మిసెల్ ఏర్పడే అధిక ఉష్ణోగ్రత కన్న తక్కువ ఉష్ణోగ్రతను క్రాఫ్ట్ ఉష్ణోగ్రత అంటారు.
ప్రశ్న 66.
లియోఫోబిక్ కొల్లాయిడ్ లను ఎందుకు ఉత్క్రమణీయం కానికి అంటారు?
జవాబు:
కొద్ది పరిమాణంలో విద్యుద్విశ్లేష్యకాలను కలిపినా లేదా వీటిని వేడిచేసినా లేదా వీటిని గిలకరించినా లియోఫోబిక్ సాల్లు సులభంగా అవక్షేపం చెందుతాయి. ఇవి స్థిరమైనవి కావు. అంతేకాకుండా ఏర్పడిన అవక్షేపానికి విక్షేపన యానకాన్ని కలిపి గిలకరిస్తే తిరిగి ఈ కొల్లాయిడ్ సాల్లు ఏర్పడవు. కాబట్టి ఈ సాల్లను అనుత్రమణీయ సాల్లు అంటారు.
ప్రశ్న 67.
ఆర్సీనియస్ సల్ఫైడ్ సాల్ను ఎలా తయారుచేస్తారు?
జవాబు:
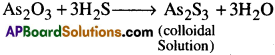
ఆర్సీనియస్ ఆక్సైడ్ విలీన ద్రావణం గుండా H2S పంపడం ద్వారా ఆర్సీనియస్ సల్ఫైడ్ సాల్ను తయారు చేస్తారు.
ప్రశ్న 68.
పెష్టీకరణం అంటే ఏమిటి?
జవాబు:
విక్షేపణ యానకంలో ఉన్న ఒక అవక్షేపానికి కొద్ది ప్రమాణంలో ఒక విద్యుద్విశ్లేషాన్ని కలిపి బాగా కుదపడం ద్వారా అవక్షేపాన్ని కొల్లాయిడల్ స్థితికి మార్చడాన్ని పెష్టీకరణం అంటారు. విక్షేపణ యానకానికి చేర్చిన విద్యుద్విశ్లేష్యకాన్ని పెష్టీకరణ కారకం అంటారు.
![]()
ప్రశ్న 69.
డయాలిసిస్ అంటే ఏమిటి? డయాలసిస్ ను ఎలా వేగపరుస్తారు?
జవాబు:
డయాలసిస్ అనునది అనువైన పటలం లేదా పొరను ఉపయోగించి కరిగే స్థితిలో ఉండే పదార్థాలను కొల్లాయిడ్ ద్రావణం నుండి తొలగించే ప్రక్రియను డయాలసిస్ అంటారు. ఈ ప్రక్రియను emf (విద్యుత్ పొటెన్షియల్) అనువర్తన ద్వారా వేగపరచవచ్చు.
ప్రశ్న 70.
కొల్లోడియన్ ద్రావణం అంటే ఏమిటి?
జవాబు:
ఆల్కహాల్-ఈథర్ 40% మిశ్రమంలో కరిగించిన నైట్రో సెల్యులోజ్ ద్రావణంను కొల్లోడియన్ ద్రావణం అంటారు.
ప్రశ్న 71.
సాధారణ వడపోత కాగితం నుంచి సూక్ష్మ వడపోత కాగితాన్ని ఎలా తయారుచేస్తారు?
జవాబు:
కొల్లోడియన్ ద్రావణంలో వడపోతలో ఉపయోగించే కాగితాన్ని నానబెట్టి, ఫార్మాల్డిహైడ్ సహాయంతో గట్టిపరచి, చివరగా ఆరపెట్టి సూక్ష్మ నిర్గలన పటలాలను తయారు చేస్తారు. దీని వలన సాధారణ వడపోత కాగితాల రంధ్రాల పరిమాణం తగ్గుతుంది. కావున వీటిని సూక్ష్మ నిర్గలన పటలాలుగా ఉపయోగిస్తారు.
ప్రశ్న 72.
టిండాల్ ఫలితం అంటే ఏమిటి?
జవాబు:
కొల్లాయిడ్ ద్రావణంలోని ద్రావిత కణాలు కాంతి కిరణాలను పరిక్షేపణం చెందించి కాంతి మార్గమును కనిపించేటట్లు చేయు ప్రక్రియను టిండాల్ ప్రభావం అంటారు.
ప్రశ్న 73.
ఏ పరిస్థితులలో టిండాల్ ఫలితం కనిపిస్తుంది?
జవాబు:
- కొల్లాయిడ్ కణాల వ్యాసం ఉపయోగించిన కాంతి కిరణం తరంగ దైర్ఘ్యం కంటే చాలా తక్కువగా ఉండకూడదు.
- విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం వీటి వక్రీభవన గుణకం విలువల మధ్య భేదం అధికంగా ఉండాలి.
ప్రశ్న 74.
కొల్లాయిడ్ ద్రావణాన్ని, నిజద్రావణాన్ని భేదపరచడానికి టిండాల్ ఫలితం ఉపయోగపడుతుందా? వివరించండి.
జవాబు:
టిండాల్ ఫలితాన్ని కొల్లాయిడల్ ద్రావణాలతో గమనిస్తాం కానీ నిజ ద్రావణాలతో కాదు. కాబట్టి టిండాల్ ఫలితాన్ని నిజద్రావణాన్ని, కొల్లాయిడ్ ద్రావణాన్ని గుర్తించడానికి ఉపయోగిస్తారు.
ప్రశ్న 75.
ఆకాశం నీలిరంగులో కనిపిస్తుంది. ఎందుకు? [AP 22]
జవాబు:
ధూళి కణాల ద్వారా కాంతి కిరణం పరిక్షిప్తం చెందడం ద్వారా ఆకాశం నీలిరంగులో కనిపిస్తుంది. దీనికి కారణం టిండాల్ ఫలితం.
ప్రశ్న 76.
బ్రౌనియన్ చలనం అంటే ఏమిటి?
జవాబు:
కొల్లాయిడల్ ద్రావణములోని విక్షేపక ప్రావస్థ కణముల అస్థవ్యస్త చలనమును బ్రౌనియన్ చలనం అంటారు.
ప్రశ్న 77.
కొల్లాయిడ్ ద్రావణంపై ఆవేశం ఉండటానికి గల కారణం ఏమిటి?
జవాబు:
ద్రావణంలో ఉండే ఇతర అయాన్లను కొల్లాయిడ్ కణం అధిశోషించుకోవడం వలన కొల్లాయిడ్ కణాలు ఆవేశాన్ని సంతరించుకొంటాయి.
లోహాలు ఎలక్ట్రోడ్ పై నిక్షిప్తమైనప్పుడు ఆ లోహాలు ఎలక్ట్రాన్లను బంధించి ఉంచడం మరో కారణం.
ప్రశ్న 78.
ఎలక్ట్రోకైనెటిక్ పొటెన్షియల్ లేదా జీటా పొటెన్షియల్ అంటే ఏమిటి?
జవాబు:
కొల్లాయిడ్ కణం చుట్టూ విరుద్ధ ఆవేశాలు గల రెండు పటలాలు (పొరలు) ఉంటాయి. మొదటి పటలం కణానికి సన్నిహితంగా అతుక్కుని ఉంటుంది. దీనిని స్థిరపటలం అంటారు. రెండవ పటలానికి చలన శీల స్వభావం ఉంటుంది. దీనిని విసరిత పటలం అంటారు.
విరుద్ధ ఆవేశాలు గల స్థిరపటలం, విసరిత పటలం మధ్య గల పొటెన్షియల్ భేదాన్ని విద్యుత్ గతిక పొటెన్షియల్ లేదా జీటా పొటెన్షియల్ అంటారు.
ప్రశ్న 79.
ధనావేశం, ఋణావేశం గల ఆర్థ ఫెర్రిక్ ఆక్సైడ్ కొల్లాయిడ్ ద్రావణాల ఫార్ములాలను వ్రాయండి.
జవాబు:
ధనావేశిత Fe2O3 . xH2O / Fe+3
ఋణావేశిత Fe2O3 . xH2O / OH–
![]()
ప్రశ్న 80.
ధనావేశ కొల్లాయిడ్ల స్కందనంలో Cl–, SO2-7, PO3-4 అయాన్ల స్కందన సామర్థ్య క్రమాన్ని తెలపండి.
జవాబు:
PO3-4 > SO2-7 > Cl–
ప్రశ్న 81.
Na+, Ba2+, Al3+ లలోఏది ఋణావేశ కొల్లాయిడ్ను సులభంగా స్కందనం చేస్తుంది? కారణం ఏమిటి?
జవాబు:
Al3+ స్కందన అయాన్ వేలన్సీ పెరిగిన కొలదీ దాని స్కందన సామర్థ్యం పెరుగుతుంది.
ప్రశ్న 82.
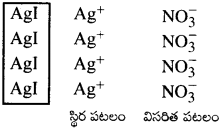
AgI కొల్లాయిడ్ ద్రావణాన్ని Ag+ అయాన్ల అధికంగా గల ద్రావణం నుంచి తయారు చేసినప్పుడు ధనావేశంగాను, I–అయాన్లు అధికంగా గల ద్రావణం నుంచి తయారు చేసినప్పుడు ఋణావేశంగాను ఉంటుంది. వివరించండి.
జవాబు:
అధిక పరిమాణంలో తీసుకొని విలీన KI ద్రావణానికి, విలీన AgNO3 ద్రావణాన్ని కలిపితే, ఏర్పడిన AgI అవక్షేపం అధిక పరిమాణంలో గల ఉభయసామాన్య అయాన్ I– ను అధిశోషించుకొంటుంది. ఫలితంగా ఋణావేశ AgI కొల్లాయిడ్ ద్రావణం ఏర్పడుతుంది. అధిక పరిమాణంలో తీసుకొన్న AgNO3 విలీన ద్రావణానికి, విలీన KI ద్రావణం కలిపినట్టైతే, ఏర్పడిన AgI అవక్షేపం, అధిక పరిమాణంలో గల ఉభయ సామాన్య అయాన్ Ag+ ను అధిశోషించుకుంటుంది. ఫలితంగా ధనావేశ AgI కొల్లాయిడ్ ద్రావణం ఏర్పడుతుంది.
ప్రశ్న 83.
విద్యుదావేశిత కణచలనం (ఎలక్ట్రోఫెరెసిస్) అంటే ఏమిటి?
జవాబు:
అనువర్తిత emf ప్రభావంతో కొల్లాయిడ్ కణం చలనం చెందే ప్రక్రియను విద్యుదావేశిత కణచలనం లేదా ఎలక్ట్రోఫోరెసిస్ అంటారు.
ప్రశ్న 84.
విద్యుత్ ద్రవాభిసరణం అంటే ఏమిటి?
జవాబు:
కొల్లాయిడ్ కణాల చలనాన్ని అనువైన పద్ధతిలో ఆపగలిగితే విక్షేపణ యానకం వ్యతిరేక దిశలో ప్రయాణిస్తుంది. దీనిని విద్యుత్ ద్రవాభిసరణం లేదా ఎలక్ట్రోఆస్మాసిస్ అంటారు.
ప్రశ్న 85.
స్కందనం అంటే ఏమిటి? [TS 22]
జవాబు:
కొల్లాయిడ్ కణాలు ఒకదానికొకటి సమీపించి,వాటిపై ఉండే విద్యుదావేశాన్ని తటస్థపరచి పాత్ర అడుగుభాగంలో అవక్షేపంగా స్థిరపడే ప్రక్రియనే స్కందనం అంటారు.
ప్రశ్న 86.
ప్లాక్యులేషన్ విలువను నిర్వచించండి.
జవాబు:
రెండు గంటల కాలవ్యవధిలో ఒక సాల్ను స్కందనం చేయడానికి, అవసరమైన మిల్లీమోల్లు/లీటర్ లో విద్యుద్విశ్లేష్య కనిష్ట గాఢతను స్కందన విలువ అంటారు. ఈ విలువ తక్కువైన కొద్దీ ఒక అయాన్ స్కందన సామర్థ్యం అధికం అవుతుంది.
ప్రశ్న 87.
హార్డీ-షూల్జ్ నియమం తెలపండి.
జవాబు:
స్కందన అయాన్ వేలన్సీ పెరిగిన కొలదీ దాని స్కందన సామర్థ్యం పెరుగుతుంది. దీనినే హార్డీ-షూల్జ్ నియమం అంటారు.
ప్రశ్న 88.
ఆర్థఫెర్రిక్ క్లోరైడ్ కొల్లాయిడ్ ద్రావణానికి సోడియమ్ క్లోరైడ్ ద్రావణం కలిపితే స్కందనం జరుగుతుంది. వివరించండి.
జవాబు:
ఆర్థ ఫెర్రిక్ ఆక్సైడ్ సాల్ ఒక ధనావేశం గల కొల్లాయిడ్ ద్రావణం. దీనికి సోడియం క్లోరైడ్ను కలిపితే కొల్లాయిడ్ కణాలు క్లోరైడ్ అయానులతో చర్య జరిపి కొల్లాయిడ్ కణాల మీద ఆవేశాలు పరస్పరం తటస్థపరచబడి అవక్షేపం చెందుతాయి. ఈ రకం స్కందన ప్రక్రియను పరస్పర స్కందనం అంటారు.
ప్రశ్న 89.
లయోఫోబిక్ కొల్లాయిడ్లను స్కందనం ఘటన నుంచి ఎలా పరిరక్షిస్తారు?
జవాబు:
లయోఫిలిక్ సాల్లు, లయోఫోబిక్ సాల్ల కంటే స్థిరమైనవి. లయోఫిలిక్ కొల్లాయిడ్లకు, లయోఫోబిక్ కొల్లాయిడ్లను పరిరక్షించే విలక్షణ స్వభావం ఉంటుంది. లయోఫోబిక్ సాల్క లయోఫిలిక్ సాల్లను కలిపితే లయోఫిలిక్ కొల్లాయిడ్ కణాలు, లయోఫోబిక్ కొల్లాయిడ్ కణాల చుట్టూ పరిరక్షణ కవచాన్ని ఏర్పరుస్తాయి. ఫలితంగా లయోఫోబిక్ సాల్లలను విద్యుద్విశ్లేష్యకాల చర్య నుంచి కాపాడతాయి.
![]()
ప్రశ్న 90.
పరిరక్షణ కొల్లాయిడ్ అంటే ఏమిటి?
జవాబు:
లయోఫిలిక్ కొల్లాయిడ్ ఒక పరిరక్షిత కొల్లాయిడ్. లయోఫోబిక్ కొల్లాయిడ్కు ఒక ఎలక్ట్రోలైట్ను కలిపినప్పుడు స్కందనం జరిగే ప్రక్రియ నుండి ఇది కాపాడుతుంది. ఈ ప్రక్రియలో ఉపయోగించిన లయోఫిలిక్ కొల్లాయిడ్లను పరిరక్షణ కొల్లాయిడ్లు అంటారు.
ప్రశ్న 91.
ఎమల్షన్ అనగానేమి ఉదాహరణనిమ్ము?
జవాబు:
ఎమల్షన్లు:
విక్షేపక యానకము మరియు విక్షేపక ప్రావస్థ రెండూ ద్రవాలుగా గల ద్రావణాలను ఎమల్షన్లు అంటారు.
ఉదా: పాలు, చల్లని క్రీమ్
ప్రశ్న 92.
ఎమల్షన్లను ఎలా వర్గీకరిస్తారు? ఒక్కొక్క రకానికి ఒక్కొక్క ఉదాహరణ ఇవ్వండి.
జవాబు:
ఎమల్షన్లను రెండు రకాలుగా వర్గీకరిస్తారు.
a. నీటిలో విక్షిప్తం చెందిన తైలం (O/W) రకం
ఉదా: పాలు, వానిషింగ్ క్రీమ్
b. తైలంలో విక్షిప్తం చెందిన నీరు (W/O) రకం
ఉదా: వెన్న, చల్లని క్రీమ్
ప్రశ్న 93.
ఎమల్సీకరణ కారకం అంటే ఏమిటి?
జవాబు:
ఎమల్సీకరణ కారకము: ఎమల్షన్లను స్థిరంగా ఉంచుటకు కలిపే మూడవ పదార్థంను ఎమల్సీకరణి లేక ఎమల్సీకరణ కారకము అంటారు.
ప్రశ్న 94.
డీఎమల్సీకరణం అంటే ఏమిటి? రెండు డీఎమల్సిఫయర్లను తెలపండి.
జవాబు:
ఒక ఎమల్షన్ దానిలోని అనుఘటక ద్రవాలుగా వేరుపడే ప్రక్రియను డీఎమల్సీకరణం అంటారు. ఎమల్షన్లను వేడి చేయడం ద్వారా, ఘనీభవించడం ద్వారా, అపకేంద్రీకరణ ద్వారా, అనుఘటక ద్రవాలుగా వేరుపడవచ్చును.
ఉదా: పాలనుండి వెన్నను తీయడం.
ప్రశ్న 95.
కృత్రిమ వర్షాన్ని ఎలా సృష్టిస్తారు?
జవాబు:
విద్యుదీకరణం చెందిన ఇసుక రేణువులను లేదా మేఘాల విద్యుదావేశానికి విరుద్ధ విద్యుదావేశం గల సాల్ కణాలను విమానాల ద్వారా వాతావరణంలోకి పిచికారి చేయడం ద్వారా కృత్రిమ వర్షాన్ని కురిపిస్తారు.
ప్రశ్న 96.
అప్పుడే జరిగిన చర్మం కోత నుంచి కారే రక్తాన్ని పటిక ద్వారా ఆపుతారు. కారణాలు తెలపండి.
జవాబు:
ఆల్బుమినాయిడ్ పదార్థాల కొల్లాయిడ్ ద్రావణమే రక్తం. పటిక (ఆలమ్) లేదా ఫెర్రిక్ క్లోరైడ్ ద్రావణం రక్తానికి కలిపితే రక్తం గడ్డకట్టి, కారడం ఆగిపోతుంది.
ప్రశ్న 97.
నది సముద్రాన్ని కలిసే స్థానాల వద్ద డెల్టాలు ఏర్పడతాయి. ఎందువల్ల?
జవాబు:
నదీజలాలను బంకమట్టి కొల్లాయిడ్ ద్రావణాలుగా భావిస్తాం. సముద్రం నీటిలో చాలా విద్యుత్ విశ్లేష్యకాలు కరిగి ఉన్నాయి. కాబట్టి నదీజలం, సముద్రం నీటితో కలిసినప్పుడు సముద్రపు నీటిలోని విద్యుద్విశ్లేష్యకాలు -బంకమట్టి కొల్లాయిడ్ ద్రావణాన్ని స్కందన ప్రక్రియకు గురిచేస్తాయి. ఫలితంగా నదీజలంలోని బంకమట్టి, డెల్టాలుగా ఏర్పడుతుంది.
ప్రశ్న 98.
కొల్లాయిడ్ ద్రావణాల రెండు ఉపయోగాలను తెలపండి. [TS 22]
జవాబు:
కొల్లాయిడ్ ద్రావణాల అనువర్తనాలు :
a. రబ్బరు :
మొక్కలు ఏర్పరచే ఋణావేశ రబ్బరు కణాల కొల్లాయిడ్ ద్రావణాన్ని లాటెక్స్ (జిగురు పదార్థం) అంటాం. ఈ లాటెక్స్ నుంచి రబ్బరును స్కందనం ప్రక్రియ ద్వారా వేరుపరుస్తారు.
b. త్రాగేనీటిని శుద్ధిచేయటం :
ప్రకృతి వనరుల నుంచి లభ్యం అయిన నీటిలో సామాన్యంగా మలినాలు అవలంబనం చెంది ఉంటాయి. ఈ నీటికి పటికను కలిపినట్లైతే అవలంబిత కణాలు స్కందన ప్రక్రియకు గురి అవుతాయి. ఆ నీరు త్రాగడానికి అనువుగా ఉంటుంది.
![]()
ప్రశ్న 99.
పొగలోని కొల్లాయిడ్ కణాల ద్వారా కలిగే గాలి కాలుష్యాన్ని ఎలా నివారిస్తారు? వివరించండి.
జవాబు:
కార్బన్, ఆర్సినిక్ సమ్మేళనాలు, ధూళి కణాలు మొదలైన ఘనస్థితిలో ఉండే కణాలు గాలిలో ఏర్పరచే కొల్లాయిడ్ ద్రావణమే పొగ. పొగగొట్టం నుంచి పొగ బయటకు వచ్చే ముందుగానే అవక్షేపకరణి ద్వారా పంపుతారు. దీనిలో పొగ కణాల ఆవేశానికి విరుద్ధంగా ఉండే ఆవేశంగల ప్లేట్లు అమర్చి ఉంటాయి. కాబట్టి పొగలోని కణాలు వీటితో సంపర్కానికి వచ్చిన వెంటనే అవి వాటి ఆవేశాన్ని కోల్పోయి అవక్షేపణం చెందుతాయి. కాబట్టి గది నేలపై ఈ కణాలు స్థిరపడతాయి. ఈ అవక్షేపకరిణిని కాటరెల్ అవక్షేపకరిణి అంటారు.
ప్రశ్న 100.
ప్రకృతి వనరుల నుంచి వచ్చే నీటిని శుద్ధి చేయడానికి పటికను వాడతారు. వివరించండి.
జవాబు:
ప్రకృతి వనరుల నుంచి లభ్యం అయిన నీటిలో సామాన్యంగా మలినాలు అవలంబనం చెంది ఉంటాయి. ఈ నీటికి పటికను కలిపినట్లైతే అవలంబిత కణాలు స్కందన ప్రక్రియకు గురి అవుతాయి. ఆ నీరు త్రాగడానికి అనువుగా ఉంటుంది.
ప్రశ్న 101.
కొల్లాయిడ్ స్థితిలో ఉండే ఔషధాలు ఎందుకు అధిక క్రియాశీలత చూపుతాయి?
జవాబు:
కొల్లాయిడ్ల రూపంలో ఉండే ఔషధాలు చాలా ప్రభావితంగా ఉంటాయి. వీటి ఉపరితల వైశాల్యం అధికంగా ఉండటం కారణంగా ఇవి సులభంగా శరీరంలో జీర్ణమగును.
ప్రశ్న 102.
లాటెక్స్ నుంచి రబ్బరును ఎలా పొందుతారు?
జవాబు:
లాటెక్స్ నుంచి రబ్బరును స్కందనం ప్రక్రియ ద్వారా వేరుపరుస్తారు.
ప్రశ్న 103.
పాలు ఏ రకం ఎమల్షనన్ను చెందినవి?
జవాబు:
నీటిలో విక్షిప్తం చెందిన తైలం రకం.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
అధిశోషణం అంటే ఏమిటి? మనపదార్థాలపై వాయువులు ప్రదర్శించే అధిశోషణం చర్యా విధానాన్ని చర్చించండి.
జవాబు:
ఒక పదార్థము యొక్క ఉపరితలము పై వేరొక పదార్ధము వాయుస్థితిలో లేక ద్రవస్థితిలో పోగయ్యి అతుక్కునే ప్రక్రియను అధిశోషణము అంటారు.
పదార్థం ఉపరితలంపై చోటుచేసుకొని ఉన్న పదార్థ కణాలు అన్నీ ఒకే రసాయనిక వాతావరణంలో ఉండవు. అయితే పదార్థ అంతర్భాగంలోని కణాలు మాత్రం ఒకే వాతావరణంలో ఉంటాయి. అధిశోషకం అంతర్భాగంలోని కణాల మధ్య ఉండే బలాలు అన్నీ ఒక దానిని ఒకటి తుల్యం చేస్తాయి. అయితే ఉపరితలంపై ఉండే కణాల చుట్టూ అన్నివైపులా పరివేషితమై ఉండే పరమాణువులు, అణువులు ఈ కణాలకు చెందినవి కావు. కాబట్టి ఇవి తుల్యం కావు. అంటే అవశేష బలాలను పొంది ఉంటాయి. ఈ బలాలు, అధిశోషిత పదార్ధ అణువులు అధిశోషకం ఉపరితలంపై సాంద్రీకృతం కావడానికి లేదా ఆకర్షితమవడానికి కారణంగా ఉన్నాయి. నిర్ధేశిత ఉష్ణోగ్రత, పీడనం వద్ద ఏకాంకద్రవ్యరాశి గల అధిశోషకం ఉపరితలం పెరుగుదలతో అధిశోషణం విస్తృతి కూడా పెరుగుతుంది.
ప్రశ్న 2.
అధిశోషణం రకాలు ఏమిటి? ఈ భిన్న రకాల అధిశోషణాల అభిలాక్షణిక ధర్మాలలో భేదాలను నాలుగింటిని తెలపండి. [AP,TS 15,16,17,19,22]
జవాబు:
ఘనపదార్థాలపై వాయువులు అధిశోషణం ప్రధానంగా రెండు రకాలు. ఘన పదార్థం ఉపరితలంపై వాయువు సాంద్రీకృతం చెందడం బలహీన వాండర్వాల్ బలాల ద్వారా జరిగినట్లైతే ఆ అధిశోషణాన్ని భౌతిక అధిశోషణం లేదా ఫిజిసార్షన్ అంటారు. ఘనపదార్థాల ఉపరితలంపై వాయు అణువులు లేదా పరమాణువులు రసాయన బంధాల ద్వారా పోగు చేయబడితే, ఆ అధిశోషణాన్ని రసాయన అధిశోషణం లేదా కెమిసాల్షన్ అంటారు. [TS 20]
భౌతిక, రసాయన అధిశోషణాలను తులనం చేయడం: భౌతిక అధిశోషణం:
- వాండర్వాల్ బలాల ద్వారా జరుగుతుంది.
- స్వభావంలో విశిష్టత కనబరచదు.
- ద్విగత స్వభావం ఉంటుంది.
- వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. సులభంగా ద్రవాలుగా మారే వాయువులు సులభంగా అధిశోషణం చెందుతాయి.
- అధిశోషణం ఎంథాల్పీ అల్పం (20-40 kJ mol-1)
- అల్ప ఉష్ణోగ్రతలు అధిశోషణం ప్రక్రియను ప్రోత్సహిస్తాయి. ఉష్ణోగ్రత పెరుగుదలతో ఇది తగ్గుతుంది.
- దీని ఉత్తేజిత శక్తి విలువ నామమాత్రంగా ఉంటుంది.
- ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. ఉపరితల వైశాల్యం పెరిగితే అధిశోషణం పరిమాణం కూడా పెరుగుతుంది.
- అధిక పీడనాల వద్ద అధిశోషకం ఉపరితలంపై బహుపొరలు ఏర్పడతాయి.
రసాయన అధిశోషణం:
- రసాయన బంధం ఏర్పడం ద్వారా జరుగుతుంది.
- స్వభావంలో అత్యధిక విశిష్టతను కనబరుస్తుంది.
- అద్విగత స్వభావం ఉంటుంది.
- ఇది కూడా వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. అధిశోషకంతో రసాయనిక చర్యజరిపే వాయువులు కెమిస్టార్షన్ ప్రదర్శిస్తాయి.
- అధిశోషణం ఎంథాల్పీ అధికం(80-240 kJ mol-1)
- అధిశోషణం అధిక ఉష్ణోగ్రతల వద్ద జరుగుతుంది. ఉష్ణోగ్రత పెరిగితే ఇది కూడా పెరుగుతుంది.
- దీనికి కొన్ని సందర్భాలలో అధిక ఉత్తేజిత శక్తి అవసరమవుతుంది.
- ఇది కూడా ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. దీనిలో కూడా ఉపరితలం వైశాల్యం పెరిగితే, అధిశోషణం పరిమాణం పెరుగుతుంది.
- ఏకపొర మాత్రమే ఏర్పడుతుంది.
ప్రశ్న 3.
క్రింది పదాలను గురించి నీవు ఏమి తెలుసుకున్నావు?
a) అభిశోషణము
b) అధిశోషణము
c) అధిశోషకము మరియు అధిశోషితము
జవాబు:
a) అభిశోషణము :
ఈ ప్రక్రియలో వాయుఅణువులు లేక ద్రవము లేక ద్రావితము అణువులు . ఉపరితలముపై మాత్రమేకాక పదార్దము యొక్క అంతర భాగములో కూడా పీల్చుకోబడును. అభిశోషణము పదార్థాల ఆయతన ధర్మము.
b) అధిశోషణము :
అధిశోషణము ఉపరితల ధర్మము. ఒక పదార్ధము యొక్క ఉపరితలము పై వేరొక పదార్ధము వాయు స్థితిలో లేక ద్రవస్థితిలో పోగయ్యి అతుక్కొనే ప్రక్రియను అధిశోషణము అంటారు.
c. అధిశోషకము :
ఏ పదార్థము యొక్క ఉపరితలంపై అధిశోషణము జరుగునో ఆ పదార్ధంను అధిశోషకము అంటారు.
అధిశోషితము :
అధిశోషకము యొక్క ఉపరితలము పై ఏ పదార్థము యొక్క అణువులు అధిశోషణము చెందునో ఆ పదార్ధమును అధిశోషితము అంటారు.
ప్రశ్న 4.
ఘనపదార్థాల ఉపరితలాలపై వాయువుల అధిశోషణం సాధారణంగా ఎంట్రోపి తగ్గుదలతో జరుగుతుంది. అయితే అది అయత్నీకృత చర్యగానే ఉంటుంది. వివరించండి.
జవాబు:
అధిశోషణ ప్రక్రియ ప్రధానంగా ఉష్ణమోచక చర్యగానే ఉంటుంది. మరియు ఇది ఎంథాల్పీ తగ్గుదలను, ఎంట్రోపి తగ్గుదలను కూడా ప్రదర్శించే చర్యగానే ఉంటుంది. నిర్దేశిత ఉష్ణోగ్రత, పీడనాల వద్ద ఒక చర్య అయత్నీకృతంగా ఉండాలి అంటే ఉష్ణగతిక శాస్త్రీయ నిబంధన ప్రకారం చర్య గిబ్స్ శక్తి మార్పు ∆G ఋణ విలువ ఉండాలి. అంటే గిబ్స్ శక్తి తగ్గాలి.
∆G = ∆H-T∆S సమీకరణం ఆధారంగా ∆H కు అత్యధిక ఋణవిలువ, -T∆S కు ధన విలువ ఉన్నట్లైతేనే ∆G అధిక ఋణ విలువలో ఉండగలుగుతుంది. అధిశోషణ ప్రక్రియ అయత్నీకృత చర్య కాబట్టి పైన పేర్కొన్న రెండు కారణాంశాలు కలిసి ∆G కు ఋణ విలువను సమకూరుస్తాయి.
![]()
ప్రశ్న 5.
ఫ్రాయిండ్లిష్ సమోష్ణరేఖ సమీకరణంలోk, n. ల విలువలను ఎలా లెక్కిస్తారు?
జవాబు:
ఫ్రాయిండ్లిష్ అధిశోషణ సమోష్ణరేఖ సంబంధాన్ని \(\frac{x}{m}\) = kp1/n సమీకరణం ద్వారా సూచించారు.
ఇక్కడ p పీడనం వద్ద m ద్రవ్యరాశి గల అధిశోషకంపై అధిశోషణం చెందిన వాయువు పరిమాణం X అనే విషయాలను p,m, x లు తెలుపుతాయి. k,n లు స్థిరాంకాలు. ఇవి నిర్దేశిత ఉష్ణోగ్రత వద్ద అధిశోషకం, వాయువుల స్వభావాలపై ఆధారపడి ఉంటాయి. సమీకరణం సంవర్గమానం తీసుకుంటే
log \(\frac{x}{m}\) = logk + \(\frac{1}{n}\)log p
దీనిని y = mx + c అనే సరళరేఖ సమీకరణంతో పోల్చవచ్చును. y అక్షంపై తీసుకొన్న log(\(\frac{x}{m}\)) కు x అక్షంపై తీసుకున్న log p కు గీసిన రేఖాపటం ద్వారా ఫ్రాయిండ్లిష్ సమోష్టరేఖ చెల్లుబాటును నిర్ణయిస్తారు. ఇక్కడ సరళరేఖవాలును మరియు Y-అంతరఖండం k, లను గణించి తద్వారా n కనుగొనవచ్చును.
ప్రశ్న 6.
క్రింది వాటిపై అధిశోషణం పరిమాణం ఏవిధంగా ఆధారపడి ఉంది?
a) ఏకాంక ద్రవ్యరాశి గల అధిశోషకం ఉపరితల వైశాల్యం పెరుగుదల
b) వ్యవస్థ ఉష్ణోగ్రత పెరుగుదల
c) వాయువు పీడనం పెరుగుదల
జవాబు:
a) అధిశోషకం ఉపరితల వైశాల్యం పెరిగిన కొద్దీ అధిశోషణం విస్తృతి కూడా పెరుగుతుంది. కాబట్టి సూక్ష్మ విభాజిత లోహాలు, సచ్ఛిద్ర పదార్థాలకు అధిక పరిమాణంలో ఉపరితలం ఉండడం కారణంగా మంచి అధిశోషకాలుగా పనిచేస్తాయి.
b) ఉష్ణోగ్రత పెరుగుదలతో అధిశోషణ విస్తృతి తగ్గుతుంది.
c) వాయుపీడనం పెరుగుదలతో అధిశోషణ విస్తృతి పెరుగుతుంది.
ప్రశ్న 7.
ఉత్ప్రేరణం అంటే ఏమిటి? ఉత్ప్రేరణాన్ని ఎలా వర్గీకరిస్తారు? ప్రతీ రకానికి ఒక ఉదాహరణ ఇవ్వండి. [IPE ’14][TS-15][AP 16,18,20]
జవాబు:
ఉత్ప్రేరణం :
బాహ్యపదార్ధము కలుపుట ద్వారా ఒక రసాయన చర్యను వేగ వంతం చేసే ప్రక్రియను ఉత్ప్రేరణం అంటారు. అలా కలిపిన బాహ్యపదార్ధం ను ఉత్ప్రేరకము అంటారు.
ఉత్ప్రేరకము యొక్క భౌతిక స్థితి ఆధారముగా ఉత్ప్రేరణంను రెండు రకములుగా వర్గీకరించారు.
a) సజాతీయఉత్ప్రేరణం
b) విజాతీయ ఉత్ప్రేరణం
a) సజాతీయ ఉత్ప్రేరణం :
ఉత్ప్రేరకము మరియు క్రియాజనకాలు ఒకే భౌతిక స్థితిలో ఉండే ఉత్ప్రేరణంను సజాతీయ ఉత్ప్రేరణం అంటారు.
![]()
b) విజాతీయ ఉత్ప్రేరణం :
ఉత్ప్రేరకము మరియు క్రియాజనకాలు వేరు వేరు భౌతిక స్థితిలో ఉండే ఉత్ప్రేరణంను విజాతీయ ఉత్ప్రేరణం అంటారు.
![]()
ప్రశ్న 8.
విజాతి ఉత్ప్రేరణానికి సంబంధించిన అధిశోషణ సిద్దాంతం చర్యా విధానాన్ని చర్చించండి.
జవాబు:
ఉత్ప్రేరణం చర్యా విధానం ఐదు అంచెలలో కొనసాగుతుంది.
- ఉత్ప్రేరకం ఉపరితలం వద్దకు క్రియాజనకాల వ్యాపనం
- ఉత్ప్రేరకం ఉపరితలంపై క్రియాజనకాలు అధిశోషణం చెందడం.
- మధ్యస్థ పదార్థం ఏర్పడటం ద్వారా ఉత్ప్రేరకం ఉపరితలంపై రసాయన చర్య జరగడం.
- ఉత్ప్రేరకం ఉపరితలం నుండి క్రియాజన్యాలు విశోషణం చెందడం ఫలితంగా తిరిగి మరికొంతమేర రసాయన చర్య జరగడానికి శుద్ధ ఉపరితలాన్ని సమకూర్చడం.
- ఉత్ప్రేరకం ఉపరితలం నుంచి చర్య క్రియాజన్యాలు వ్యాపనం చెందడం.
ప్రశ్న 9.
జియోలైట్లు జరిపే ఉత్ప్రేరణానికి సంబంధించిన కొన్ని లక్షణాలను చర్చించండి.
జవాబు:
జియోలైట్లు జరిపే ఉత్ప్రేరణ లక్షణాలు:
- జియోలైట్లు కొన్ని సిలికాన్ పరమాణువులు, అల్యూమినియమ్ పరమాణువులతో ప్రతిక్షేపితమై త్రిమితీయ యూనిట్లు గల నిర్మాణంలో గల సిలికేట్లు.
- వీటిని ఉత్ప్రేరకాలుగా ఉపయోగించవలసి వచ్చినప్పుడు. వీటిని వేడి చేస్తారు. ఇవి రంధ్రములలో గల సార్థ జలమును కోల్పోవును. కనుక రంధ్రములు ఖాళీ అగును.
- రంధ్రముల యొక్క పరిమాణం 260 నుండి 740pm మధ్య మారుచుండును. కనుక ఈ రంధ్రం పరిమాణంలో ఇమడ గల చిన్న అణువులు మాత్రమే అధిశోషించబడి ఉత్ప్రేరకంగా పనిచేయును. కనుక ఇవి అణు జల్లెడ వలె పనిచేయును. లేదా ఆకార ఎంపిక ఉత్ప్రేరకాలు.
పెట్రోలియమ్ పరిశ్రమలో ఉపయోగించే ఒక ముఖ్యమైన జియోలైట్ ఉత్ప్రేరకం ZSM-5
ఇది ఆల్కహాల్లను అనార్ద్రీకరణ చర్యకు గురిచేసి గాసోలిన్లుగా పిలిచే హైడ్రోకార్బన్ల మిశ్రమంగా మారుస్తుంది.
ప్రశ్న 10.
సరైన పటం సహాయంతో ఎంజైమ్ ఉత్ప్రేరణ చర్యా విధానాన్ని క్లుప్తంగా వివరించండి.
జవాబు:
ఎంజైమ్ ఉత్ప్రేరణను వివరించే చర్యా విధానం:
ఎంజైమ్లు కొల్లాయిడ్ కణాలలో చాలా డొల్లలు ఉంటాయి. వీటికి అభిలాక్షణిక ఆకారాలు ఉంటాయి. వీటిలో -NH2, -COOH, -SH, –OH లాంటి క్రియాశీలత గల గ్రూపులు కూడా ఉంటాయి. ఇవి ఎంజైమ్ కణాల ఉపరితలాలపై ఉత్తేజిత కేంద్రాలుగా పనిచేస్తాయి. క్రియాజనకం అణువులకు ఎంజైమ్ డొల్లలలో ఖచ్చితంగా అమరేటట్లు ఉండే సంపూరక ఆకారాలు ఉంటాయి. ఇది ఒక తాళంలోకి అమర్చే తాళంచెవి. పరిస్థితిని పోలి ఉంటుంది. ఉత్తేజక గ్రూపులు ఉండటం కారణంగా, ఒక ఉత్తేజిత సంక్లిష్టం ఎంజైమ్-సబ్స్ట్రేట్ల మధ్య ఏర్పడుతుంది. ఇది తదుపరి చర్యలో క్రియాజన్యాలుగా వియోగం చెందుతుంది.
Step – 1 :
ఎంజైమ్తో క్రియాజనకం బంధితమై ఉత్తేజిత సంక్లిష్టం (ES*) ఏర్పడుతుంది.
E + S → ES*
Step-2:
ఈ ఉత్తేజిత సంక్లిష్టం క్రియాజన్యాలుగా వియోగం చెందడం.
ES* → E + P
![]()
ప్రశ్న 11.
ఎంజైమ్లు ఉత్ప్రేరణ క్రియాశీలతను ప్రభావితం చేసే అంశాలు చర్చిండి.
జవాబు:
a) యుక్తతమ ఉష్ణోగ్రత వద్ద మాత్రమే అధిక చర్యాశీలతను ప్రదర్శించడం :
యుక్తతమ ఉష్ణోగ్రత అనే ప్రత్యేక ఉష్ణోగ్రత వద్ద ఎంజైమ్ చర్యరేటు గరిష్టంగా ఉంటుంది. ఈ యుక్తతమ ఉష్ణోగ్రతకు రెండువైపులా గల ఉష్ణోగ్రతల వద్ద ఎంజైమ్ క్రియాశీలత తగ్గుతుంది. ఎంజైమ్ క్రియాశీలతకు అనువైన ఉష్ణోగ్రత వ్యాప్తి 298-310K గా ఉంటుంది. మానవ శరీర ఉష్ణోగ్రత 310K ఎంజైమ్ ఉత్ప్రేరణ చర్యలను అనువుగా ఉంటుంది.
b) యుక్తతమ pH వద్ద అత్యధిక చర్యాశీలతను ప్రదర్శించడం :
యుక్తతమ pH అనే ఒక ప్రత్యేకత pH విలువ వద్ద మాత్రమే ఎంజైమ్ ఉత్ప్రేరక చర్యరేటు గరిష్టంగా ఉంటుంది. ఇది 5-7pH ల మధ్య ఉంటుంది.
c) ఉత్తేజకాలు, కో-ఎంజైమ్ల సమక్షంలో క్రియాశీలత పెరుగుదల :
కో-ఎంజైమ్లు అనే కొన్ని ఇతర పదార్థాల సమక్షంలో ఎంజైమ్ల క్రియాశీలత పెరుగుతుంది. ఒక ఎంజైమ్తో సహా కొద్ది పరిమాణంలో ప్రోటీన్ కాని వేరొక పదార్థం కూడా ఉన్నట్లైతే, ఎంజైమ్ క్రియాశీలత గణనీయంగా పెరుగుతుంది.
Na+, Mn+2, Co+2, Cu+2 లాంటి లోహ అయాన్లు సాధారణంగా ఉత్తేజకాలుగా ఉంటాయి. ఈ లోహ అయాన్లు, ఎంజైమ్ అణువులతో బలహీనంగా బంధితమై, ఎంజైమ్ క్రియాశీలతను పెంచుతాయి.
d) నిరోధకాలు, విషపదార్థాల ప్రభావం :
సాధారణ ఉత్ప్రేరకాల మాదిరిగానే ఇతర పదార్థాల సమక్షంలో ఎంజైమ్లు కూడా నిరోధకాలు లేదా విషపదార్థాలుగా పనిచేస్తాయి.
ప్రశ్న 12.
ఎంజైమ్ ఉత్ప్రేరణ చర్యలు ఆరింటిని వ్రాయండి. [AP-19]
జవాబు:
a) చక్కెర విలోమ చర్య:
f) పాలలోని లాక్టోబాసిలై, పాలను పెరుగుగా మారుస్తుంది.
ప్రశ్న 13.
ఉత్ప్రేరకాల క్రియాశీలత, వరణాత్మకత అంటే ఏమిటి?
జవాబు:
క్రియాశీలత :
ఒక చర్యారేటును పెంచే సామర్థ్యాన్ని తెలిపేదే క్రియాశీలత. చాలవరకు కెమిసాల్షన్ బలంపైనే ఉత్ప్రేరకం క్రియాశీలత ఆధారపడి ఉంటుంది. అయితే ఇవి మిక్కిలి బలంగా అధిశోషణం చెందకూడదు. ఎందుకంటే, ఆ పరిస్థితులలో ఇవి కదలని స్థితిని సంతరించుకుంటాయి. ఫలితంగా ఉత్ప్రేరకం ఉపరితలంపై కొత్త క్రియాజనకాలకు అధిశోషణం చెందడానికి చోటు లేకుండా పోతుంది.
వరణాత్మకత :
ఒక రసాయన చర్యలో పాల్గోనే క్రియాజనకాలు ఆశించిన భిన్న క్రియాజన్యాలను ఏర్పరచే విధంగా చర్యను దిశాత్మకం చేయడాన్నే వరణాత్మకత అంటాం. ఉదాహరణకు H2 మరియు CO క్రియాజనకాలు భిన్న ఉత్ప్రేరకాల సమక్షంలో భిన్న క్రియాజన్యాలను ఏర్పరుస్తాయి.
![]()
దీనిని అనుసరించి ఒక ఉత్ప్రేరకం చర్య బలమైన వరణాత్మక స్వభావాన్ని ప్రదర్శిస్తుంది.
ప్రశ్న 14.
అనుఘటకాల భౌతిక స్థితుల ఆధారంగా కొల్లాయిడ్లను ఎలా వర్గీకరిస్తారు?
జవాబు:
విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం అనేవి ఘనస్థితి పదార్థాలా, ద్రవస్థితి పదార్థాలా, వాయుస్థితి పదార్థాలా అనే దానిని అనుసరించి కొల్లాయిడ్ వ్యవస్థలను ఎనిమిది రకాలుగా వర్గీకరించడం సాధ్యం అవుతుంది.
ప్రశ్న 15.
విక్షేపణ యానకం పరంగా కొల్లాయిడ్లను ఎలా వర్గీకరిస్తారు?
జవాబు:
| విక్షేపన యానకం | కొల్లాయిడ్ |
| నీరు | ఆక్వాసాల్ లేదా హైడ్రోసాల్ |
| ఆల్కహాల్ | ఆల్కాసాల్ |
| బెంజీన్ | బెంజోసాల్ |
| గాలి | ఎయిరోసాల్ |
![]()
ప్రశ్న 16.
విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం వీటి మధ్య గల అన్యోన్య చర్యల ఆధారంగా కొల్లాయిడ్లను ఎలా వర్గీకరిస్తారు?
జవాబు:
విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం, వీటి మధ్య గల అన్యోన్య చర్యల స్వభావం ఆధారంగా కొల్లాయిడల్ సాల్లను రెండు రకాలుగా విభజిస్తాం. ఇది లయోఫిలిక్ (ద్రావణిని ఆకర్షించేవి), లయోఫోబిక్ (ద్రావణిని వికర్షించేవి). నీరు విక్షేపన యానకం అయితే వీటిని హైడ్రోఫిలిక్, హైడ్రోఫోబిక్ అని విభజిస్తాం.
లయోఫిలిక్ కొల్లాయిడ్లు :
లయోఫిలిక్ పదానికి ద్రావణి ప్రియ అని అర్థం. జిగురు, జిలటిన్, స్టార్చ్, రబ్బరు మొదలైన పదార్థాలను ప్రత్యక్షంగా అనువైన ద్రావణితో కలపడం ద్వారా ఏర్పడే సాల్లలను లయోఫిలిక్ సాల్లు అంటారు.
ఈ సాల్ల ముఖ్యమైన అభిలాక్షణిక ధర్మం ఏమిటంటే, విక్షేపణ యానకాన్ని విక్షిప్త ప్రావస్థ నుంచి వేరుపరిస్తే, వేరుపడిన విక్షిప్త ప్రావస్థకు విక్షేపణ యానకాన్ని కలిపి గిలకరించి సాల్ను తిరిగి నిర్మించవచ్చు. ఈ కారణంగా ఆ సాల్లను ఉత్రమణీయ సాల్లు అంటారు. ఇవి చాలా స్థిరమైనవి. వీటిని సులభంగా స్కందన ప్రక్రియకు గురి చేయలేం.
లయోఫోబిక్ కొల్లాయిడ్లు :
లయోఫోబిక్ పదానికి ద్రావణి విరోధి అని అర్థం. లోహాలు, లోహ సల్ఫైడ్ల వంటి పదార్థాలను విక్షేపణ యానకంతో కలిపినంత మాత్రాన ఈ కొల్లాయిడ్ సాల్లు ఏర్పడవు. ఈ సాల్లలను కొన్ని ప్రత్యేక పద్ధతులలో మాత్రమే తయారు చేయవలసి ఉంటుంది. ఈ రకం సాల్లను లయోఫోబిక్ సాల్లు అంటారు. వీటికి కొద్ది పరిమాణంలో విద్యుద్విశ్లేష్యకాలను కలిపినా లేదా వీటిని వేడిచేసినా లేదా వీటిని గిలకరించినా ఇవి సులభంగా అవక్షేపణం చెందుతాయి. ఇవి స్థిరమైనవి కావు. అంతేకాకుండా అవక్షేపానికి విక్షేపణ యానకాన్ని కలిపి గిలకరిస్తే తిరిగి ఈ కొల్లాయిడ్ సాల్లు ఏర్పడవు. కాబట్టి ఈ సాల్లను అనుత్రమణీయ సాల్లు అంటారు. లయోఫోబిక్ సాల్లను నిల్వచేసి ఉంచడానికి వాటికి స్థిరీకరణ కారకాలను చేర్చవలసి ఉంటుంది.
ప్రశ్న 17.
కొల్లాయిడ్సాల్, జెట్, ఎమల్షన్, ఫోమ్ వీటి మధ్య గల భేదాలను వ్రాయండి.
జవాబు:
కొల్లాయిడ్సాల్లో విక్షిప్త ప్రావస్థ ఒక ఘనపదార్థం మరియు విక్షేపన యానకం ఒక ద్రవపదార్థం.
జెల్లో పైదానికి వ్యతిరేకంగా ఉండును.
ఎమల్షన్లో విక్షిప్త ప్రావస్థ మరియు విక్షేపన యానకం రెండూ కూడా ద్రవపదార్థాలే.
ఫోమ్ విక్షిప్త ప్రావస్థ ఒక వాయువు మరియు విక్షేపన యానకం ఒక ద్రవపదార్థం.
ప్రశ్న 18.
లయోఫిలిక్, లయోఫోబిక్ సాల్లు అంటే ఏమిటి? స్థిరత్వం, ఉత్రమణీయత ఆధారంగా పై రెండు పదాలను పోల్చండి. [TS 22]
జవాబు:
ఈ ప్రశ్నకు 119 ప్రశ్న సమాధానం వ్రాయవలెను.
ప్రశ్న 19.
లయోఫిలిక్, లయోఫోబిక్ భాగాలు గల అణువులు ఉన్న పదార్థం పేరు వ్రాయండి. దైనందిన జీవితంలో దాని ఉపయోగమేమిటి?
జవాబు:
సహచరిత కొల్లాయిడ్లు లయోఫోబిక్ మరియు లయోఫిలిక్ అనే రెండు భాగాలను కలిగి ఉంటుంది.
ఉదా: సబ్బులు, డిటర్జెంట్లు
వీటిని ఉపయోగించి గ్రీజు లేదా బట్టలు ఉపరితలంపై అతుక్కొని ఉన్న నూనెలను తొలగిస్తారు.
ప్రశ్న 20.
పటం సహాయంతో కొల్లాయిడ్లను తయారు చేసే బ్రెడిగ్ విద్యుత్ చాప పద్ధతిని వర్ణించండి.
జవాబు:
బ్రెడిగ్ విద్యుత్ చాప పద్దతి :
ఈ పద్ధతిలో విక్షేపణం, సాంద్రీకరణం రెండు ప్రక్రియలు ఇమిడి ఉన్నాయి.
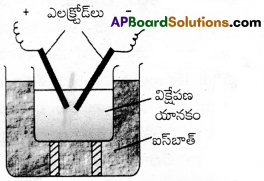
గోల్డ్, సిల్వర్, ప్లాటినమ్ మొదలైన లోహ కొల్లాయిడ్ సాల్లను ఈ పద్ధతిలో తయారు చేస్తారు. ఈ పద్ధతిలో విక్షేపణ యానకంలో ముంచి ఉంచిన లోహ ఎలక్ట్రోడ్ మధ్య విద్యుత్ చాపాన్ని అనువర్తిస్తారు. పద్ధతిలో అత్యధిక పరిమాణంలో వెలువడిన ఉష్ణం లోహబాష్పాలను ఏర్పరుస్తుంది. ఈ బాష్పాలు సాంద్రీకరణ చెంది కొల్లాయిడ్ల పరిమాణంలో కణాలను ఏర్పరుస్తాయి.
ప్రశ్న 21.
రసాయన పద్ధతులలో కొల్లాయిడ్లను తయారుచేసే నాలుగు పద్ధతులను రసాయన సమీకరణాలతో సహా వివరించండి.
జవాబు:
క్రియాజన్య జాతులను ఏర్పరచే ద్వంద్వ వియోగం, ఆక్సీకరణం, క్షయకరణం, జలవిశ్లేషణం మొదలైన రసాయన చర్యల ఆధారంగా కొల్లాయిడ్లను తయారు చేస్తారు. క్రియాజన్య జాతులు సముచ్ఛయం చెంది, సాల్లను ఏర్పరుస్తాయి.

ప్రశ్న 22.
కొల్లాయిడ్ల శుద్ధి ప్రక్రియను పటం సహాయంతో డయాలసిస్ దృగ్విషయం లేదా ఘటన ద్వారా వివరించండి. [AP18]
జవాబు:
డయాలసిస్ :
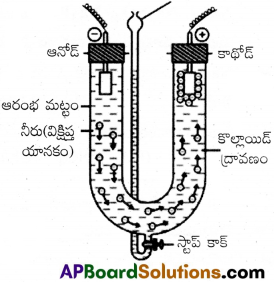
ఇది అనువైన పటలం లేదా పొరను ఉపయోగించి కరిగే స్థితిలో ఉండే పదార్థాలను కొల్లాయిడ్ ద్రావణం నుంచి తొలగించే ప్రక్రియ. నిజద్రావణంలో ఉండే అయాన్లు, లఘు అణువులు జంతుపటలం (బ్లాడర్) లేదా పార్చిమెంట్ కాగితం లేదా సెల్లోఫేన్ రేకు ద్వారా పోగల్గుతాయి. కాని కొల్లాయిడ్ కణాలు వీటి గుండా పోలేవు కాబట్టి ఈ పొరలను ఉపయోగించి డయాలసిస్ ప్రక్రియను జరుపుతారు. ఈ ప్రక్రియలో వాడే సాధనాన్ని డయలెజర్ అంటారు.
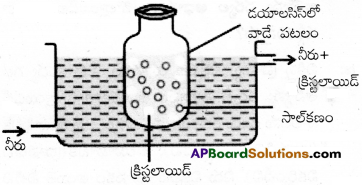
కొల్లాయిడ్ ద్రావణంతో నింపిన అనువైన పటలంతో తయారు చేసిన సంచిని దానిలోకి నిరంతరంగా అనువైన పటలంతో తయారు చేసిన సంచీని దానిలోకి నిరంతరంగా నీరు ప్రవహిస్తున్న పాత్రలో ముంచి ఉంచుతారు. అణువులు అయాన్లు పటలం ద్వారా వ్యాపనం చెంది పాత్రలోని నీటిలోకి పోతాయి. సంచిలో శుద్ధ కొల్లాయిడ్ ద్రావణం మిగిలి ఉంటుంది.
![]()
ప్రశ్న 23.
రేఖాపటం సహాయంతో మిసెల్లు ఏర్పడటాన్ని వివరించండి.
జవాబు:
మిసెల్లు ఏర్పడే చర్యా విధానం:
ముసబ్బుద్రావణాన్ని ఉదాహరణగా తీసుకొందాం. భార కొవ్వు ఆమ్లాల సోడియమ్ లేదా పొటాషియమ్ లవణాన్ని సబ్బు అంటాం. దీనికి RCOO-Na (సోడియమ్ స్టియరేట్ CH3(CH2)16COO–Na+, అంటారు. ఇది చాలా బార్ సబ్బులలో ప్రధాన అనుఘటకంగా ఉంది). దీనిని నీటిలో కరిగిస్తే ఇది COO–గాను, Na+ గాను వియోజనం చెందుతుంది. RCOO– అయాన్లో రెండు భాగాలు ఉన్నాయి. ఇవి పొడవైన హైడ్రోకార్బన్ గొలుసు R (దీనిని అధ్రువ భాగం లేదా ‘తోక’ అంటారు. ఇది హైడ్రోఫోబిక్ (నీటిని వికర్షించే భాగం), COO– ధ్రువం భాగం (ధ్రువ-అయానిక లేదా తల భాగం) ఇది హైడ్రోఫిలిక్ (నీటిని ఆకర్షించే భాగం)
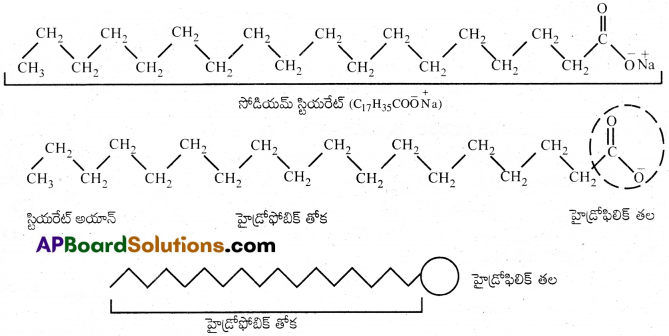
ఉపరితలంపై ఉండే RCOO– అయాన్లు COO– గ్రూపులు నీటిలోను హైడ్రోకార్బన్ గొలుసు (R) నీటికి దూరంగా ఉపరితలం వద్ద ఉంటాయి. అయితే సందిగ్ధమిసెల్ గాఢత వద్ద COO– అయాన్లు, ద్రావణం లోపలికి లాగబడతాయి. ఈ పరిస్థితులలో అవి సముచ్ఛయం చెంది గోళాకారంలోకి మారతాయి. హైడ్రోకార్బన్ గొలుసులు గోళం కేంద్రకం వైపుగా చొచ్చుకొని ఉంటాయి. COO– గ్రూపులు గోళం ఉపరితలంపై ఊర్ధ్వభాగం వైపుగా చోటు చేసుకొని ఉంటాయి. ఈ విధంగా ఏర్పడిన సముచ్ఛయాన్ని అయానిక్ మిసైల్ అంటారు. ఈ అణువులలో సుమారు 100 సాధారణ అణువులు ఉంటాయి.
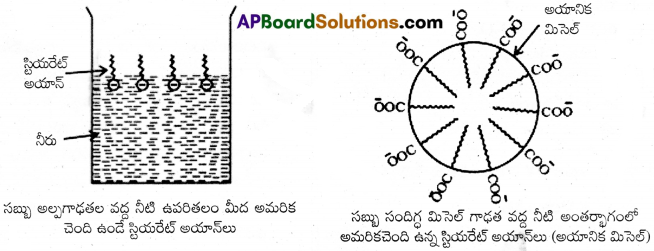
ఇదే విధంగా సోడియమ్ లారిల్ సల్ఫేట్ CH3(CH2)11SO3–Na+ వంటి డిటర్జెంట్లలో – SO3– పోలారఁ గ్రూపుగా పొడవైన హైడ్రోకార్బన్ గొలుసుతో కూడా ఉంటుంది. కాబట్టి వీటి విషయంలో కూడా మిసెల్ ఏర్పాటు విధానం సబ్బులలో మాదిరిగానే ఉంటుంది.
ప్రశ్న 24.
ఎమల్సిఫికేషన్, మిసెల్ ఏర్పాటు వీటి ద్వారా సబ్బు జరిపే శుద్ధి ప్రక్రియ ఉంది. దీనిని గురించి తెలపండి.
జవాబు:
సబ్బుతో మురికిని తొలగించే ప్రక్రియ :
మిసెల్లో, హైడ్రోఫోబిక్ హైడ్రోకార్బన్ గొలుసు కేంద్రగర్భంగా ఉంటుంది. సబ్బులు మురికిని తొలగించే ప్రక్రియలో సబ్బు అణువులు మిసెల్ను మురికి బిందువు వద్ద ఏర్పరుస్తాయి. ఈ చర్యలో స్టియరేట్ అయాన్లోని హైడ్రోఫోబిక్ భాగం మురికి బిందుకలోకి, హైడ్రోఫిలిక్ భాగం నిక్కబొడిచిన వెంట్రుకల్లాగా మురికి (గ్రీజు) బిందుక నుంచి బయట భాగానికి ప్రక్షేపణం చెందుతాయి. పోలార్ గ్రూపులు నీటితో చర్యలో పాల్గోంటాయి. కాబట్టి స్టియరేట్ అయాన్తో పరివేష్టితమై ఉండి మురికి బిందుక నీటిలోనికి లాగబడుతుంది. ఫలితంగా మురికి ఉపరితలం నుంచి తొలగించబడుతుంది. ఈ విధంగా సబ్బు ఎమల్షన్ ఏర్పాటుకు సహాయపడి, నూనెలు, క్రొవ్వులు ఏర్పరచే మురికిని తొలగిస్తుంది.గోళికలు చుట్టూ ఋణావేశిత తొడుగు ఉండడం కారణంగా ఈ గోళికలు దగ్గరగా చేరి సముచ్ఛయాలు ఏర్పడవు.
ప్రశ్న 25.
బ్రౌనియన్ చలనం ఘటనను వివరించి, ఈ ఘటనానికి గల కారణాలను తెలపండి.
జవాబు:

బ్రౌనియన్ చలనం :
శక్తివంతమైన అతి సూక్ష్మదర్శిని సహాయంంతో కొల్లాయిడ్ ద్రావణాలను పరిశీలిస్తే కణాలు నిరంతరంగా జిగ్-జాగ్ చలనంలో ఉన్నట్లు మన దృష్టిపరిధిలో కనిపిస్తాయి. ఈ చలనాన్ని తొలిసారిగా బ్రిటీష్ వృక్షశాస్త్రవేత్త రాబర్ట్ బ్రౌన్ కనుక్కొన్నాడు. కాబట్టి ఈచలనాన్ని బ్రౌనియన్ చలనం అంటారు. అ చలనం కొల్లాయిడ్ ద్రావణం రసాయన స్వభావం మీద ఆధారపడి ఉండదు. అయితే ఇది కొల్లాయిడ్ కణాల పరిమాణం, ద్రావణం స్నిగ్ధత మీద ఆధారపడి ఉంటుంది. కణాల పరిమాణం తక్కువగాను, స్నిగ్ధత తక్కువగాను ఉన్నట్లైతే చలనవేగం ఎక్కువగా ఉంటుంది. బ్రౌనియన్ చలనం కొల్లాయిడ్ కణాలు, విక్షిప్తయానయ కణాలతో జరిపే సంతులనం కాని గాధనాల కారణంగా ప్రాప్తిస్తున్నది అని వివరించాడు. బ్రౌనియన్ చలనానికి గిలకరించే స్వభావం ఫలితంగా కొల్లాయిడ్ కణాలు పాత్ర అడుగు భాగానికి చేరలేవు. దీని కారణంగా కొల్లాయిడ్ ద్రావణానికి స్థిరత్వం ప్రాప్తిస్తుంది.
ప్రశ్న 26.
నాలుగు ధనావేశ కొల్లాయిడ్లను పేర్కొనండి.
జవాబు:
ధనావేశ కొల్లాయిడ్లు:
a) ఆర్ద్ర లోహాక్సైడ్ సాల్లు
ఉదా: Al2O3, xH2O
b) క్షారగుణం గల రంజన పదార్థాలు
ఉదా: మెథిలిన్ బ్లూసాల్
c) హిమోగ్లోబిన్ (రక్తం)
d) ఆక్సైడ్లు. ఉదా: TiO2 సాల్.
ప్రశ్న 27.
నాలుగు ఋణావేశ కొల్లాయిడ్లను పేర్కొనండి.
జవాబు:
ఋణావేశ కొల్లాయిడ్లు:
a) లోహసాల్లు.
ఉదా: కాపర్, సిల్వర్, గోల్డ్సెల్లు
b) లోహ సల్ఫైడ్సాల్లు.
ఉదా: As2S3, Sb2S3 సాల్లు
c) ఆమ్లగుణం గల రంజన పదార్థాలు
ఉదా: ఇయోసిన్, కాంగోరెడ్ సాల్లు
d) స్టార్చ్,జిగురు,జిలటీన్,బంకమట్టి, బొగ్గు సాల్లు మొ||
![]()
ప్రశ్న 28.
హెల్మ్ హోల్జ్ పటల ద్వయం, జీటా పొటెన్షియల్ పదాలను వివరించండి. కొల్లాయిడ్ ద్రావణాలలో వీటి ప్రాముఖ్యం ఏమిటి?
జవాబు:
కొల్లాయిడ్ కణం చుట్టూ విరుద్ద ఆవేశాలు గల రెండు పటలాల సంయుగ్మాన్ని హెలో హోల్డ్ విద్యుత్ పటలద్వయం అంటారు. సూతన ఆలోచనల ప్రకారం మొదటి పటలం కణానికి సన్నిహితంగా అతుక్కుని ఉంటుంది. దీనిని స్థిరపటలం అంటారు. రెండవ పటలానికి చలన శీల స్వభావం ఉంటుంది.దీనిని విసరిత పటలం అంటారు. ఆవేశాల విభజన పొటెన్షియల్ ఏర్పడటానికి కారణంగా ఉంటుంది. కాబట్టి స్థిర పటలం విసరిత పటలం వీటిమీద ఉండే విరుద్ధ ఆవేశాలు, ఈ రెండు పటలాల మధ్య పొటెన్షియల్ భేదానికి కారణంగా ఉన్నాయి. విరుద్ధ ఆవేశాలు గల స్థిరపటలం, విసరిత పటలం మధ్య గల పొటెన్షియల్ భేదాన్ని విద్యుత్ గతిక పొటెన్షియల్ లేదా జీటా పొటెన్షియల్ అంటారు.
ప్రశ్న 29.
ఎలక్ట్రోఫోరిసిస్ ఘటనను పటం సహాయంతో వివరించండి.
జవాబు:
విద్యుదావేశిత కణచలనం (ఎలక్ట్రోఫోరిసిస్): కొల్లాయిడ్ కణానికి విద్యుదావేశం ఉంది అనే వాస్తవాన్ని విద్యుదావేశిత కణచలనం ప్రయోగం నిర్ధారించింది. కొల్లాయిడ్ ద్రావణంలో రెండు ప్లాటినమ్ ఎలక్ట్రోడ్లను ముంచి ఉంచి వాటి మధ్య విద్యుత్ పొటెన్షియల్ను ఆరంభ మట్టం. ఆవర్తనం చేసినట్లైతే కొల్లాయిడ్ కణాలు రెండు ఎలక్ట్రోడ్లలో ఏదో ఒక దానివైపుగా ప్రయాణిస్తాయి. కాబట్టి అనువర్తిత emf ప్రభావంతో కొల్లాయిడ్ కణం చలనం చెందే ప్రక్రియను విద్యుదావేశిత కణచలనం లేదా ఎలక్ట్రోఫోరెసిస్ అంటారు.
కొల్లాయిడ్ కణాల చలనాన్ని అనువైన పద్దతిలో ఆపగలిగితే విక్షేపణ యానకం వ్యతిరేక దిశలో ప్రయాణిస్తుంది. దీనిని విద్యుత్ ద్రవాభిసరణం లేదా ఎలక్ట్రోఆస్మాసిస్ అంటారు.
ప్రశ్న 30.
క్రింది పదాలను వివరించండి.
(i) ఎలక్ట్రోఫోరిసిస్ (ii) స్కందనం (iii) టిండాల్ ఫలితం
జవాబు:
i) ఎలక్ట్రోఫోరిసిస్ :
అనువర్తిత emf ప్రభావంతో కొల్లాయిడ్ కణం చలనం చెందే ప్రక్రియను విద్యుదావేశిత కణచలనం లేదా ఎలక్ట్రోఫోరెసిస్ అంటారు.
ii) స్కందనం :
కొల్లాయిడ్ కణాలు ఒకదానికొకటి సమీపించి, వాటిపై ఉండే విద్యుదావేశాన్ని తటస్థపరచి పాత్ర అడుగుభాగంలో అవక్షేపంగా స్థిరపడే ప్రక్రియనే స్కందనం అంటారు.
iii) టిండాల్ ఫలితం :
కొల్లాయిడ్ ద్రావణంలోని ద్రావిత కణాలు కాంతి కిరణాలను పరిక్షేపణం చెందించి కాంతి మార్గమును కనిపించేటట్లు చేయు ప్రక్రియను టిండాల్ ప్రభావం అంటారు.
![]()
ప్రశ్న 31.
క్రింది వాటిలో కనిపించే ఘటనలను వివరించండి.
i) కొల్లాయిడ్ సాల్ గుండా కాంతిపుంజాన్ని పంపినప్పుడు
ii) ఆర్థఫెర్రిక్ ఆక్సైడ్కు NaCl విద్యుద్విశ్లేష్యకం కలిపినప్పుడు
iii) కొల్లాయిడ్ ద్రావణం ద్వారా విద్యుత్ ప్రసారం జరిగినప్పుడు
జవాబు:
i) కొల్లాయిడ్ కణాలు కాంతిని అన్ని దిశలలోనూ పరిక్షేపణ చేస్తాయి. అందువల్ల కొల్లాయిడ్ ద్రావణంలో ప్రయాణించే కాంతి మార్గం కాంతివంతం అవుతుంది. (టిండాల్ ఫలితం).
ii) ఆర్థఫెర్రిక్ ఆక్సైడ్ యొక్క ధనావేశిత కణాలు, NaCl ఎలక్ట్రోలైట్ వలన జనించే ఋణావేశిత కణాలు వలన స్కందనం చెందుతాయి.
iii) విద్యుత్ ద్రవాభిసరణ జరుగుతుంది.
ప్రశ్న 32.
పటం సహాయంతో కాటరెల్ పొగ అవక్షేపకరణిని వర్ణించండి.
జవాబు:
కార్బన్, ఆర్సినిక్ సమ్మేళనాలు, ధూళి కణాలు మొదలైన ఘనస్థితిలో ఉండే కణాలు గాలిలో ఏర్పరచే కొల్లాయిడ్ ద్రావణమే పొగ, పొగగొట్టం నుంచి పొగ బయటకు వచ్చే ముందుగానే అవక్షేపకరణి ద్వారా పంపుతారు.
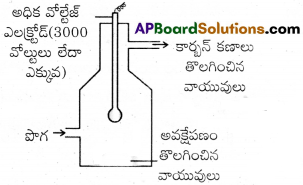
దీనిలో పొగ కణాల ఆవేశానికి విరుద్ధంగా ఉండే ఆవేశంగల ప్లేట్లు అమర్చి ఉంటాయి. కాబట్టి పొగలోని కణాలు వీటితో సంపర్కానికి వచ్చిన వెంటనే అవి వాటి ఆవేశాన్ని కోల్పోయి అవక్షేపణం చెందుతాయి. కాబట్టి గది నేలపై ఈ కణాలు స్థిరపడతాయి. ఈ అవక్షేపకరిణిని కాటరెల్ అవక్షేపకరిణి అంటారు.
ప్రశ్న 33.
ఆర్థ ఫెర్రిక్ క్లోరైడ్ సాల్ను స్కందనం చేయడానికి NaCl, Na2SO4, Na3PO4 లలో ఏది అధిక ప్రభావం చూపుతుంది? కారణం ఏమిటి?
జవాబు:
Na3PO4. ఆర్ద్ర ఫెర్రిక్ఆక్సైడ్సాల్ ఒక ధనావేశిత సాల్. స్కందన అయాన్ వేలన్సీ పెరిగిన కొలదీ దాని స్కందన సామర్థ్యం పెరుగుతుంది. (PO4-3 > SO4-2 > Cl–)
ప్రశ్న 34.
ఒక లయోఫిలిక్ కొల్లాయిడ్, ఒక లయోఫోబిక్ కొల్లాయిడ్ను ఎలా పరిరక్షిస్తుంది?
జవాబు:
లయోఫిలిక్ సాల్లు, లయోఫోబిక్ సాల్లల కంటే స్థిరమైనవి. లయోఫిలిక్ కొల్లాయిడ్లకు, లయోఫోబిక్ కొల్లాయిడ్లను పరిరక్షించే విలక్షణ స్వభావం ఉంటుంది. లయోఫోబిక్ సాల్కు లయోఫిలిక్ సాల్లను కలిపితే లయోఫిలిక్ కొల్లాయిడ్ కణాలు, లయోఫోబిక్ కొల్లాయిడ్ కణాల చుట్టూ పరిరక్షణ కవచాన్ని ఏర్పరుస్తాయి. ఫలితంగా లయోఫోబిక్ సాల్లలను విద్యుద్విశ్లేష్యకాల చర్య నుంచి కాపాడతాయి. ఈ ప్రక్రియలో ఉపయోగించిన లయోఫిలిక్ కొల్లాయిడ్లను పరిరక్షణ కొల్లాయిడ్లు అంటారు.
![]()
ప్రశ్న 35.
క్రింది వాటిలో కొల్లాయిడ్ల ఉపయోగం తెలపండి.
i) త్రాగేనీటిని శుద్ధి చేయడం
ii) టానింగ్
iii) ఔషధాలు
జవాబు:
i) త్రాగేనీటిని శుద్ధి చేయడం :
ప్రకృతి వనరుల నుంచి లభ్యం అయిన నీటిలో సామాన్యంగా మలినాలు అవలంబనం చెంది ఉంటాయి. ఈ నీటికి పటికను కలిపినట్లైతే అవలంబిత కణాలు స్కందన ప్రక్రియకు గురి అవుతాయి. ఆ నీరు త్రాగడానికి అనువుగా ఉంటుంది.
ii) టానింగ్ :
జంతుచర్మాలకు కొల్లాయిడ్ స్వభావం ఉంటుంది. ధనావేశం గల కణాలు గల చర్మాన్ని టానిన్లో నానబెట్టినట్లైతే టానిన్లోని ఋణావేశ కొల్లాయిడ్ కణాలు చర్మంలోని ధనావేశ కణాలు పరస్పరం స్కందన ప్రక్రియకు గురవుతాయి. ఈ ప్రక్రియ ద్వారా చర్మం గట్టిపడుతుంది. ఈ ప్రక్రియను టానింగ్ అంటారు. టానిన్కు బదులుగా క్రోమియమ్న కూడా ఉపయోగిస్తారు.
iii) కొల్లాయిడ్ల రూపంలో ఉండే ఔషధాలు చాలా ప్రభావితంగా ఉంటాయి. ఎందుకంటే వీటి ఉపరితల వైశాల్యం అధికంగా ఉండటం కారణంగా ఇవి సులభంగా శరీరంలో జీర్ణించుకొంటాయి.
ప్రశ్న 36.
గోల్డ్ సంఖ్యను నిర్వచించండి.
జవాబు:
1 మి.లీ. 10% NaCl ద్రావణము 10 మి.లీ. ప్రమాణ గోల్డ్ సాలు కలుపగా అవక్షేపం కాకుండా నిరోధించుటకు అవసరమయ్యే ద్రవప్రియ సాల్ యొక్క కనిష్ట మిల్లీ గ్రాముల సంఖ్యను గోల్డ్ నంబర్ అంటారు.
ప్రశ్న 37.
ఎమల్షన్ను, ఎమల్సిఫయర్లు ఎలా స్థిరపరుస్తాయి? రెండు ఎమల్సిఫయర్లను తెలపండి.
జవాబు:
ఎమల్షన్ అస్థిరం. ఇవి కాలానుగతిన రెండు పొరలుగా వేరుపడతాయి. ఎమల్షను స్థిరీకరణం చేయడానికి మూడవ పదార్థాన్ని వీటికి కలుపుతారు. వీటిని ఎమల్సీకరణ కారకాలు అంటారు. ఎమల్సీకరణ కారకం, విక్షిప్తం చెందిన కణాలు, విక్షేపణ యానకం కణాల మధ్య అంతర్అల పొరగా ఏర్పడుతుంది. ఉదా: కేసిన్, సిలికా
Long Answer Questions (దీర్ఘ సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
అభిశోషణం, అధిశోషణం, శోషణం పదాలను వివరించండి. భిన్నరకాల అధిశోషణాలను వివరించండి.
జవాబు:
a) అభిశోషణము :
ఈ ప్రక్రియలో వాయుఅణువులు లేక ద్రవము లేక ద్రావితము అణువులు ఉపరితలముపై మాత్రమేకాక పదార్దము యొక్క అంతర భాగములో కూడా పీల్చుకోబడును. అభిశోషణము పదార్థాల ఆయతన ధర్మము.
b) అధిశోషణము :
అధిశోషణము ఉపరితల ధర్మము. ఒక పదార్ధము యొక్క ఉపరితలము పై వేరొక పదార్ధము వాయు స్థితిలో లేక ద్రవస్థితిలో పోగయ్యి అతుక్కొనే ప్రక్రియను అధిశోషణము అంటారు.
శోషణం :
అధిశోషణం, అభిశోషణం రెండూ కూడా ఒకేసారి జరుగుతాయి. ఈ ప్రక్రియను ‘శోషణం’ అంటారు. ఘనపదార్థాలపై వాయువులు అధిశోషణం ప్రధానంగా రెండు రకాలు. ఘన పదార్థం ఉపరితలంపై వాయువు సాంద్రీకృతం చెందడం బలహీన వాండర్వాల్ బలాల ద్వారా జరిగినట్లైతే ఆ అధిశోషణాన్ని భౌతిక అధిశోషణం లేదా ఫిజిసార్షన్ అంటారు. ఘనపదార్థాల ఉపరితలంపై వాయు అణువులు లేదా పరమాణువులు రసాయన బంధాల ద్వారా పోగు చేయబడితే, ఆ అధిశోషణాన్ని రసాయన అధిశోషణం లేదా కెమిసార్షన్ అంటారు.
భౌతిక, రసాయన అధిశోషణాలను తులనం చేయడం:
భౌతిక అధిశోషణం: [AP 15]
- వాండర్వాల్ బలాల ద్వారా జరుగుతుంది.
- స్వభావంలో విశిష్టత కనబరచదు.
- ద్విగత స్వభావం ఉంటుంది.
- వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. సులభంగా ద్రవాలుగా మారే వాయువులు సులభంగా అధిశోషణం చెందుతాయి.
- అధిశోషణం ఎంథాల్పీ అల్పం (20-40 kJ mol-1)
- అల్ప ఉష్ణోగ్రతలు అధిశోషణం ప్రక్రియను ప్రోత్సహిస్తాయి. ఉష్ణోగ్రత పెరుగుదలతో ఇది తగ్గుతుంది.
- దీని ఉత్తేజిత శక్తి విలువ నామమాత్రంగా ఉంటుంది.
- ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. ఉపరితల వైశాల్యం పెరిగితే అధిశోషణం పరిమాణం కూడా పెరుగుతుంది.
- అధిక పీడనాల వద్ద అధిశోషకం ఉపరితలంపై బహుపొరలు ఏర్పడతాయి.
రసాయన అధిశోషణం:
- రసాయన బంధం ఏర్పడడం ద్వారా జరుగుతుంది.
- స్వభావంలో అత్యధిక విశిష్టతను కనబరుస్తుంది.
- అద్విగత స్వభావం ఉంటుంది.
- ఇది కూడా వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. అధిశోషకంతో రసాయనిక చర్యజరిపే వాయువులు కెమిసార్షన్ ప్రదర్శిస్తాయి.
- అధిశోషణం ఎంథాల్పీ అధికం(80-240 kJ mol-1)
- అధిశోషణం అధిక ఉష్ణోగ్రతల వద్ద జరుగుతుంది. ఉష్ణోగ్రత పెరిగితే ఇది కూడా పెరుగుతుంది.
- దీనికి కొన్ని సందర్భాలలో అధిక ఉత్తేజిత శక్తి అవసరమవుతుంది.
- ఇది కూడా ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. దీనిలో కూడా ఉపరితలం వైశాల్యం పెరిగితే, అధిశోషణం పరిమాణం పెరుగుతుంది.
- ఏకపొర మాత్రమే ఏర్పడుతుంది.
ప్రశ్న 2.
భౌతిక అధిశోషణం అభిలాక్షణిక లక్షణాలను చర్చించండి.
జవాబు:
అభిశోషణము :
ఈ ప్రక్రియలో వాయుఅణువులు లేక ద్రవము లేక ద్రావితము అణువులు ఉపరితలముపై మాత్రమేకాక పదార్దము యొక్క అంతర భాగములో కూడా పీల్చుకోబడును. అభిశోషణము పదార్థాల ఆయతన ధర్మము.
భౌతిక అధిశోషణం:
- వాండర్వాల్ బలాల ద్వారా జరుగుతుంది.
- స్వభావంలో విశిష్టత కనబరచదు.
- ద్విగత స్వభావం ఉంటుంది.
- వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. సులభంగా ద్రవాలుగా మారే వాయువులు సులభంగా అధిశోషణం చెందుతాయి.
- అధిశోషణం ఎంథాల్పీ అల్పం (20-40 kJ mol-1)
- అల్ప ఉష్ణోగ్రతలు అధిశోషణం ప్రక్రియను ప్రోత్సహిస్తాయి. ఉష్ణోగ్రత పెరుగుదలతో ఇది తగ్గుతుంది.
- దీని ఉత్తేజిత శక్తి విలువ నామమాత్రంగా ఉంటుంది.
- ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. ఉపరితల వైశాల్యం పెరిగితే అధిశోషణం పరిమాణం కూడా పెరుగుతుంది.
- అధిక పీడనాల వద్ద అధిశోషకం ఉపరితలంపై బహుపొరలు ఏర్పడతాయి.
ప్రశ్న 3.
కెమిసాల్షన్ అభిలాక్షణిక ధర్మాలను చర్చిండి.
జవాబు:
అధిశోషణము :
అధిశోషణము ఉపరితల ధర్మము. ఒక పదార్ధము యొక్క ఉపరితలము పై వేరొక పదార్ధము వాయు స్థితిలో లేక ద్రవస్థితిలో పోగయ్యి అతుక్కొనే ప్రక్రియను అధిశోషణము అంటారు.
రసాయన అధిశోషణం:
- రసాయన బంధం ఏర్పడడం ద్వారా జరుగుతుంది.
- స్వభావంలో అత్యధిక విశిష్టతను కనబరుస్తుంది.
- అద్విగత స్వభావం ఉంటుంది.
- ఇది కూడా వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. అధిశోషకంతో రసాయనిక చర్యజరిపే వాయువులు కెమిసార్షన్ ప్రదర్శిస్తాయి.
- అధిశోషణం ఎంథాల్పీ అధికం(80-240 kJ mol-1)
- అధిశోషణం అధిక ఉష్ణోగ్రతల వద్ద జరుగుతుంది. ఉష్ణోగ్రత పెరిగితే ఇది కూడా పెరుగుతుంది.
- దీనికి కొన్ని సందర్భాలలో అధిక ఉత్తేజిత శక్తి అవసరమవుతుంది.
- ఇది కూడా ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. దీనిలో కూడా ఉపరితలం వైశాల్యం పెరిగితే, అధిశోషణం పరిమాణం పెరుగుతుంది.
- ఏకపొర మాత్రమే ఏర్పడుతుంది.
![]()
ప్రశ్న 4.
ఫిజిసాప్షన్, కెమిసార్షన్ దృగ్విషయాలను లేదా ఘటనలు తులనం చేయండి. భేదపరచండి.
జవాబు:
a) అభిశోషణము :
ఈ ప్రక్రియలో వాయుఅణువులు లేక ద్రవము లేక ద్రావితము అణువులు ఉపరితలముపై మాత్రమేకాక పదార్దము యొక్క అంతర భాగములో కూడా పీల్చుకోబడును. అభిశోషణము పదార్థాల ఆయతన ధర్మము.
b) అధిశోషణము :
అధిశోషణము ఉపరితల ధర్మము. ఒక పదార్ధము యొక్క ఉపరితలము పై వేరొక పదార్ధము వాయు స్థితిలో లేక ద్రవస్థితిలో పోగయ్యి అతుక్కొనే ప్రక్రియను అధిశోషణము అంటారు.
శోషణం :
అధిశోషణం, అభిశోషణం రెండూ కూడా ఒకేసారి జరుగుతాయి. ఈ ప్రక్రియను ‘శోషణం’ అంటారు. ఘనపదార్థాలపై వాయువులు అధిశోషణం ప్రధానంగా రెండు రకాలు. ఘన పదార్థం ఉపరితలంపై వాయువు సాంద్రీకృతం చెందడం బలహీన వాండర్వాల్ బలాల ద్వారా జరిగినట్లైతే ఆ అధిశోషణాన్ని భౌతిక అధిశోషణం లేదా ఫిజిసార్షన్ అంటారు. ఘనపదార్థాల ఉపరితలంపై వాయు అణువులు లేదా పరమాణువులు రసాయన బంధాల ద్వారా పోగు చేయబడితే, ఆ అధిశోషణాన్ని రసాయన అధిశోషణం లేదా కెమిసార్షన్ అంటారు.
భౌతిక, రసాయన అధిశోషణాలను తులనం చేయడం:
భౌతిక అధిశోషణం: [AP 15]
- వాండర్వాల్ బలాల ద్వారా జరుగుతుంది.
- స్వభావంలో విశిష్టత కనబరచదు.
- ద్విగత స్వభావం ఉంటుంది.
- వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. సులభంగా ద్రవాలుగా మారే వాయువులు సులభంగా అధిశోషణం చెందుతాయి.
- అధిశోషణం ఎంథాల్పీ అల్పం (20-40 kJ mol-1)
- అల్ప ఉష్ణోగ్రతలు అధిశోషణం ప్రక్రియను ప్రోత్సహిస్తాయి. ఉష్ణోగ్రత పెరుగుదలతో ఇది తగ్గుతుంది.
- దీని ఉత్తేజిత శక్తి విలువ నామమాత్రంగా ఉంటుంది.
- ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. ఉపరితల వైశాల్యం పెరిగితే అధిశోషణం పరిమాణం కూడా పెరుగుతుంది.
- అధిక పీడనాల వద్ద అధిశోషకం ఉపరితలంపై బహుపొరలు ఏర్పడతాయి.
రసాయన అధిశోషణం:
- రసాయన బంధం ఏర్పడడం ద్వారా జరుగుతుంది.
- స్వభావంలో అత్యధిక విశిష్టతను కనబరుస్తుంది.
- అద్విగత స్వభావం ఉంటుంది.
- ఇది కూడా వాయువు స్వభావంపై ఆధారపడి ఉంటుంది. అధిశోషకంతో రసాయనిక చర్యజరిపే వాయువులు కెమిసార్షన్ ప్రదర్శిస్తాయి.
- అధిశోషణం ఎంథాల్పీ అధికం(80-240 kJ mol-1)
- అధిశోషణం అధిక ఉష్ణోగ్రతల వద్ద జరుగుతుంది. ఉష్ణోగ్రత పెరిగితే ఇది కూడా పెరుగుతుంది.
- దీనికి కొన్ని సందర్భాలలో అధిక ఉత్తేజిత శక్తి అవసరమవుతుంది.
- ఇది కూడా ఉపరితల వైశాల్యంపై ఆధారపడి ఉంటుంది. దీనిలో కూడా ఉపరితలం వైశాల్యం పెరిగితే, అధిశోషణం పరిమాణం పెరుగుతుంది.
- ఏకపొర మాత్రమే ఏర్పడుతుంది.
ప్రశ్న 5.
అధిశోషణం సమోష్ణరేఖ అంటే ఏమిటి? ఫ్రాయిండ్లిష్ అధిశోషణ సమోష్ణరేఖ ద్వారా ఘనపదార్థాలపై వాయువుల అధిశోషణాన్ని వివరించండి.
జవాబు:
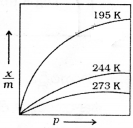
నిర్దేశిత ఉష్ణోగ్రత వద్ద ఏకాంక ద్రవ్యరాశిగల ఘనస్థితిలోని అధిశోషకంపై అధిశోషణం చెందే వాయువు పరిమాణానికి, వాయువు పీడనానికి మధ్య గల అనుభావిక సంబంధాన్ని సూచించే రేఖను అధిశోషణ సమోష్ణ రేఖ అంటారు.
ఫ్రాయిండ్లిష్ అధిశోషణ సమోష్ణరేఖ సంబంధాన్ని \(\frac{x}{m}\) = kp1/n …… (1) సమీకరణం ద్వారా సూచించారు. ఇక్కడ p పీడనం వద్ద m ద్రవ్యరాశి గల అధిశోషకంపై అధిశోషణం చెందిన వాయువు పరిమాణం X అనే విషయాలను p,m, x లు తెలుపుతాయి. k,n లు స్థిరాంకాలు. ఇవి నిర్ధేశిత ఉష్ణోగ్రత వద్ద అధిశోషకం, వాయువుల స్వభావాలపై ఆధారపడి ఉంటాయి. 1 గ్రామ్ అధిశోషకంపై అధిశోషణం చెందిన వాయువు ద్రవ్యరాశికి-పీడనానికి మధ్య గీసిన రేఖాపటం పై పేర్కొన్న సంబంధాన్ని తెలుపుతారు. పటంలోని వక్రాలు క్రింది విషయాన్ని తెలుపుతాయి. స్థిరపీడనం వద్ద ఉష్ణోగ్రత పెరుగుదలలో భౌతిక అధిశోషణం పరిమాణం తగ్గుతుంది. అధిక పీడనాల వద్ద, అధిశోషణం ప్రక్రియ సంతృప్తం కావడం కారణంగా వక్రాలు స్థిరత్వం చేరే స్వభావాన్ని కనబరుస్తాయి. సమీకరణం(1)కు సంవర్గమానం తీసుకుంటే
log\(\frac{x}{m}\) = logk + \(\frac{1}{n}\)logp… (2) వచ్చును.
దీనిని y = mx + c అనే సరళరేఖ సమీకరణంతో పోల్చవచ్చును. y అక్షంపై తీసుకొన్న log(\(\frac{x}{m}\)) కు x అక్షంపై తీసుకున్న log p కు గీసిన రేఖాపటం ద్వారా ఫ్రాయిండ్లిష్ సమోష్టరేఖ చెల్లుబాటును నిర్ణయిస్తారు. ఈ రేఖాపటం సరళరేఖ రేఖాపటంగా ఉన్నట్లైతే, ఫ్రాయిండ్లిష్ సమోష్ణరేఖ చెల్లుబాటును నిర్ధారిస్తుంది. లేనిపక్షంలో చెల్లుబాటులేనట్టే. సరళరేఖ వాలు 1/n విలువను తెలుపుతుంది. y – అక్షంపై logk అంతరఖండం విలువను తెలుపుతుంది.
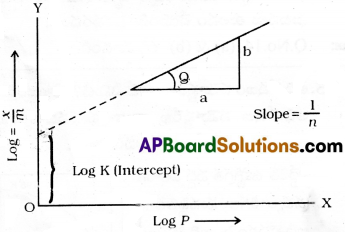
ఫ్రాయిండ్లిష్ సమోష్టరేఖ అధిశోషణ స్వభావాన్ని ఉజ్జాయింపుగా తెలుపుతుంది. 1/n కారణాంశం 0-1 మధ్యగా ఉండే విలువను తెలుపుతుంది. (0.1 నుంచి 0.5 సాధారణంగా ఉండే విస్తృతి). సమీకరణం (2) కొన్ని పీడనాల విస్తృతిలోనే చెల్లుబాటు అవుతుంది.
అయితే \(\frac{1}{n}\) = 0 స్థిరం. పీడనంపై ఆధారపడదు. \(\frac{x}{m}\) అంటే అధిశోషణం పీడనంపై ఆధారపడదు.
\(\frac{1}{n}\) = 1 అయితే \(\frac{x}{m}\) = kp ⇒ \(\frac{x}{m}\) ∝ p.
అధిశోషణం పీడనంతో అనులోమానుపాతంలో మారుతుంది. ఈ రెండు నిబంధనలను ప్రయోగాత్మక ఫలితాలు నిర్ధారించాయి. ప్రయోగ ఫలితాలు అధిక పీడనాల వద్ద సంతృప్త విలువలను చేరుకున్నాయి. దీనిని ఫ్రాయిండ్లిష్ సమోష్ణరేఖ వివరించలేకపోయింది. కాబట్టి ఇది అధిక పీడనాల వద్ద చెల్లుబాటు కాదు లేదా వర్తించదు అని తెలుస్తుంది.
ప్రశ్న 6.
అధిశోషణం అనువర్తనాలను గురించి వివరంగా తెలపండి.
జవాబు:
ముఖ్యమైన అధిశోషణం అనువర్తనాలు:
i) అధిక శూన్యస్థితిని ఏర్పరచడం :
ఒక పాత్రలో అధిక శూన్య స్థితిని పొందడానికి ఆ పాత్రలోని గాలిని నిర్వాత పంపు ద్వారా తొలగిస్తారు. ఈ ప్రక్రియలో పాత్రలో ఇంకా మిగిలి ఉన్న కొద్దిపాటి గాలినీ, బొగ్గును ఉపయోగించి అధిశోషణ ప్రక్రియ ద్వారా తొలగిస్తారు.
ii) వాయు ముసుగు :
బొగ్గుగనులలో పనిచేసే కార్మికులు గాలిని పీల్చుకొనేటప్పుడు గాలిలోని విషవాయువులను అధిశోషించుకోవడానికి వాడే సాధనాన్ని వాయు ముసుగు అంటారు. ఇది ఉత్తేజపరిచిన బొగ్గు లేదా ఇత అధిశోషకాల మిశ్రమంతో నిండి ఉంటుంది.
ii) తేమను నియంత్రణ చేయడం :
నివాస గదులలో ఉండే తేమను తొలగించి, గాలిలోని తేమను నియంత్రణ చేయడానికి సిలికాజెల్ అల్యూమినాజెల్లను అధిశోషకాలుగా ఉపయోగిస్తారు.
iv) మలిన రంగు ద్రావణాల నుంచి రంగు మలినాలను తొలగించడం :
మలినరంగు ద్రావణాల రంగుకు కారణమైన రంగు మలినాలను, ద్రావణాల నుంచి జాంతవ బొగ్గు ద్వారా తొలగిస్తారు.
v) విజాతి ఉత్ప్రేరణం :
ఘనస్థితిలో ఉండే ఉత్ప్రేరకాల ఉపరితలాలపై చర్యలోని క్రియాజనకాలు అధిశోషణం చెందడం ద్వారా చర్యావేగం పెరుగుతుంది. ఘనస్థితి ఉత్ప్రేరకాల వాడకాన్ని పారిశ్రామిక ప్రాముఖ్యం ఉన్న చాలా వాయుస్థితి చర్యలలో మనం గమనిస్తాం. హేబర్ పద్ధతిలో అమోనియా సంశ్లేషణంలో ఐరన్ ను, స్పర్శ(కాంటాక్ట్) పద్దతిలో H2SO2 తయారీలో V2O5ను, తైలాలను హైడ్రోజనీయరణం చేసే(వనస్పతి) చర్యలలో సూక్ష్మవిభాజిత Ni ను ఉత్ప్రేరకాలుగా ఉపయోగించే చర్యలు విజాతి ఉత్ప్రేరణ చర్యలకు ఉదాహరణలు.
vi) జడవాయువులను వాటి మిశ్రమం నుంచి వేరుపరచడం :
బొగ్గుపై వాయువులు అధిశోషణం సామర్థ్యం లేదా అవధి భిన్న వాయువులకు భిన్నంగా ఉంటుంది. కొబ్బరి బొగ్గుపై భిన్న జడవాయువుల అధిశోషణం అవధి భిన్న ఉష్ణోగ్రతల వద్ద భిన్నంగా ఉండటం ఆధారంగా, వ్యక్తిగత జడవాయువులను వాటి మిశ్రమం నుంచి భిన్న ఉష్ణోగ్రతల వద్ద జరిపి అధిశోషణ ప్రక్రియ ద్వారా వేరుపరుస్తారు.
vii) వ్యాధులను నయం చేయడం :
క్రిముల ద్వారా కలిగే వ్యాధులను నయం చేయడానికి వాడే చాలా ఔషధాలు ఈ క్రిములపై అధిశోషణం చెంది వాటిని చంపుతాయి.
viii) నురుగు ప్లవన ప్రక్రియ :
అల్ప నాణ్యత గల సల్ఫైడ్ ఖనిజాల నుంచి సిలికా లేదా ఇతర మట్టి మలినాలను పైన్ నూనెను నురుగు కారకాలను వాడి తొలగించి, ఖనిజాన్ని గాఢతపరచే విధానంలో అధిశోషణం ప్రక్రియ చోటుచేసుకుంది.
ix) అధిశోషణ సూచికలు :
సిల్వర్ హాలైడ్ల వంటి కొన్ని అవక్షేపాలు, వాటి ఉపరితలాలపై ఇయోసిన్, ఫ్లోరసీన్ లాంటి కొన్ని రంజనాలను అధిశోషణ చెందించుకొని, అభిలాక్షణిక రంగు మార్పును కలిగించుకుంటాయి. దీని ఆధారంగా ఆర్జెంటోమెట్రిక్ టైట్రేషన్లలో అంతిమ బిందువును రంజన పదార్థాల ద్వారా నిర్ణయిస్తారు.
x) క్రొమొటోగ్రాఫిక్ విశ్లేషణం :
విశ్లేషణ పద్ధతులలోను, పారిశ్రామిక పద్ధతులలోను, అధిశోషణ దృగ్విషయం ఆధారంగా రూపొందించబడిన క్రొమొటోగ్రాఫిక్ పద్ధతులను విస్తారంగా ఉపయోగిస్తారు.
ప్రశ్న 7.
ఉత్ప్రేరణం అంటే ఏమిటి? ఉత్ప్రేరణాన్ని ఎలా వర్గీకరిస్తాం? ఉదాహరణలు ఇవ్వండి.
జవాబు:
ఉత్ప్రేరణం :
బాహ్యపదార్ధము కలుపుట ద్వారా ఒక రసాయన చర్యను వేగ వంతం చేసే ప్రక్రియను ఉత్ప్రేరణం అంటారు. అలా కలిపిన బాహ్యపదార్ధం ను ఉత్ప్రేరకము అంటారు.
ఉత్ప్రేరకము యొక్క భౌతిక స్థితి ఆధారముగా ఉత్ప్రేరణంను రెండు రకములుగా వర్గీకరించారు.
a) సజాతీయ ఉత్ప్రేరణం
b) విజాతీయ ఉత్ప్రేరణం
a) సజాతీయ ఉత్ప్రేరణం :
ఉత్ప్రేరకము మరియు క్రియాజనకాలు ఒకే భౌతిక స్థితిలో ఉండే ఉత్ప్రేరణంను సజాతీయ ఉత్ప్రేరణం అంటారు.
b) విజాతీయ ఉత్ప్రేరణం :
ఉత్ప్రేరకము మరియు క్రియాజనకాలు వేరు వేరు భౌతిక స్థితిలో ఉండే ఉత్ప్రేరణంను విజాతీయ ఉత్ప్రేరణం అంటారు.
![]()
ప్రశ్న 8.
విజాతి ఉత్ప్రేరణం చర్యా విధానాన్ని చర్చించండి.
జవాబు:
ఉత్ప్రేరణం చర్యా విధానం ఐదు అంచెలలో కొనసాగుతుంది.
- ఉత్ప్రేరకం ఉపరితలం వద్దకు క్రియాజనకాల వ్యాపనం
- ఉత్ప్రేరకం ఉపరితలంపై క్రియాజనకాలు అధిశోషణం చెందడం.
- మధ్యస్థ పదార్థం ఏర్పడటం ద్వారా ఉత్ప్రేరకం ఉపరితలంపై రసాయన చర్య జరగడం
- ఉత్ప్రేరకం ఉపరితలం నుండి క్రియాజన్యాలు విశోషణం చెందడం ఫలితంగా తిరిగి మరికొంతమేర రసాయన చర్య జరగడానికి శుద్ధ ఉపరితలాన్ని సమకూర్చడం.
- ఉత్ప్రేరకం ఉపరితలం నుంచి చర్య క్రియాజన్యాలు వ్యాపనం చెందడం.
ప్రశ్న 9.
ఎంజైమ్లు అంటే ఏమిటి? ఎంజైమ్ ఉత్ప్రేరణాన్ని వివరణ, ఉదాహరణలతో సహా చర్చించండి.
జవాబు:
ప్రాణం గల మొక్కలు, జంతువులు ఉత్పత్తి చేసే సంక్లిష్ట నైట్రోజన్ కర్బన సమ్మేళనాలు ఎంజైమ్లు. ఇవి వాస్తవానికి అధిక మోలార్ ద్రవ్యరాశి గల ప్రోటీన్ అణువులు ఇవి నీటిలో కొల్లాయిడ్ ద్రవణాలను ఏర్పరుస్తాయి.
ఎంజైమ్ ఉత్ప్రేరణను వివరించే చర్యా విధానం :
(సబ్ స్ట్రేట్) (ఉత్ప్రేరకం) ఎంజైమ్లు కొల్లాయిడ్ కణాలలో చాలా డొల్లలు ఉంటాయి. వీటికి అభిలాక్షణిక ఆకారాలు ఉంటాయి. వీటిలో -NH2, -COOH, -SH, OH లాంటి క్రియాశీలత గల గ్రూపులు కూడా ఉంటాయి. ఇవి ఎంజైమ్ కణాల ఉపరితలాలపై ఉత్తేజిత కేంద్రాలుగా పనిచేస్తాయి. క్రియాజనకం అణువులకు ఎంజైమ్ డొల్లలలో ఖచ్చితంగా అమరేటట్లు ఉండే సంపూరక ఆకారాలు ఉంటాయి. ఇది ఒక తాళంలోకి అమర్చే తాళంచెవి. పరిస్థితిని పోలి ఉంటుంది. ఉత్తేజక గ్రూపులు ఉండటం కారణంగా, ఒక ఉత్తేజిత సంక్లిష్టం ఎంజైమ్-సబ్ట్ల మధ్య ఏర్పడుతుంది. ఇది తదుపరి చర్యలో క్రియాజన్యాలుగా వియోగం చెందుతుంది.
Step-1 :
ఎంజైమ్తో క్రియాజనకం బంధితమై ఉత్తేజిత సంక్లిష్టం (ES*) ఏర్పడుతుంది.
E + S → ES*
Step-2 :
ఈ ఉత్తేజిత సంక్లిష్టం క్రియాజన్యాలుగా వియోగం చెందడం.
ES* → E + P
![]()
ప్రశ్న 10.
కొల్లాయిడ్ ద్రావణాలు అంటే ఏమిటి? వీటిని ఎలా వర్గీకరిస్తారు? ఉదాహరణలు ఇవ్వండి.
జవాబు:
ఒక పదార్థం (విక్షేపణ యానకం) లో పెద్దసైజు కణాలుగా వేరొక పదార్థం (విక్షిప్త ప్రావస్థ) విక్షేపణం చెంది ఏర్పరచిన విజాతి వ్యవస్థను కొల్లాయిడ్ ద్రావణం అంటారు. నిజ ద్రావణానికి, కొల్లాయిడ్ ద్రావణానికి గల ముఖ్యమైన భేదం, విక్షిప్త ప్రావస్థగా ఉండే పదార్థకణ పరిమాణం. నిజ ద్రావణంలో విక్షిప్త ప్రావస్థకణాలు అయాన్లు లేదా చిన్న అణువులుగా ఉంటాయి.
కొల్లాయిడ్లలో బృహత్ అణువులు (ప్రోటీన్లు లేదా సంశ్లేషిత పాలిమర్లు వంటివి) లేదా అధిక సంఖ్యలో పరమాణువులు లేదా అయాన్లు, లేదా అణువులు కలసి ఏర్పరచిన సముచ్ఛయాలు విక్షిప్త ప్రావస్థ పదార్థకణాలుగా ఉంటాయి. కొల్లాయిడ్ కణాలు, సాధారణ అణువుల కంటే పెద్దవిగా ఉంటాయి. అయితే అవి అవలంబన స్థితిలో ఉండటానికి వీలైన పరిమాణంలో ఉంటాయి.
I) విక్షేపన యానకంపరంగా కొల్లాయిడ్లు:
| విక్షేపన యానకం | కొల్లాయిడ్ |
| నీరు | ఆక్వాసాల్ లేదా హైడ్రోసాల్ |
| ఆల్కహాల్ | ఆల్కాసాల్ |
| బెంజీన్ | బెంజోసాల్ |
| గాలి | ఎయిరోసాల్ |
II) విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం అనుసరించి కొల్లాయిడ్ వ్యవస్థలను ఎనిమిది రకాలుగా వర్గీకరించవచ్చు

III) విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం, వీటి మధ్య గల అన్యోన్య చర్యల స్వభావం ఆధారంగా కొల్లాయిడల్ సాల్లను రెండు రకాలుగా విభజిస్తాం.
లయోఫిలిక్ కొల్లాయిడ్లు :
లయోఫిలిక్ పదానికి ద్రావణి ప్రియ అని అర్థం. జిగురు, జిలటిన్, స్టార్చ్, రబ్బరు మొదలైన పదార్థాలను ప్రత్యక్షంగా అనువైన ద్రావణితో కలపడం ద్వారా ఏర్పడే సాల్లను లయోఫిలిక్ సాల్లు అంటారు. ఈ సాల్ల ముఖ్యమైన అభిలాక్షణిక ధర్మం ఏమిటంటే, విక్షేపణ యానకాన్ని విక్షిప్త ప్రావస్థ నుంచి వేరుపరిస్తే, వేరుపడిన విక్షిప్త ప్రావస్థకు విక్షేపణ యానకాన్ని కలిపి గిలకరించి సాల్ను తిరిగి నిర్మించవచ్చు. ఈ కారణంగా ఆ సాల్లను ఉత్రమణీయ సాల్లు అంటారు. ఇవి చాలా స్థిరమైనవి. వీటిని సులభంగా స్కందన ప్రక్రియకు గురి చేయలేం.
లయోఫోబిక్ కొల్లాయిడ్లు :
లయోఫోబిక్ పదానికి ద్రావణి విరోధి అని అర్థం. లోహాలు, లోహ సల్ఫైడ్ల వంటి పదార్థాలను విక్షేపణ యానకంతో కలిపినంత మాత్రాన ఈ కొల్లాయిడ్ సాల్లు ఏర్పడవు. ఈ సాల్లలను కొన్ని ప్రత్యేక పద్ధతులలో మాత్రమే తయారు చేయవలసి ఉంటుంది. ఈ రకం సాల్లను లయోఫోబిక్ సాల్లు అంటారు. వీటికి కొద్ది పరిమాణంలో విద్యుద్విశ్లేష్యకాలను కలిపినా లేదా వీటిని వేడిచేసినా లేదా వీటిని గిలకరించినా ఇవి సులభంగా అవక్షేపణం చెందుతాయి. ఇవి స్థిరమైనవి కావు. అంతేకాకుండా అవక్షేపానికి విక్షేపణ యానకాన్ని కలిపి గిలకరిస్తే తిరిగి ఈ కొల్లాయిడ్ సాల్లు ఏర్పడవు. కాబట్టి ఈ సాల్లను అనుత్రమణీయ సాల్లు అంటారు. లయోఫోబిక్ సాల్లను నిల్వచేసి ఉంచడానికి వాటికి స్థిరీకరణ కారకాలను చేర్చవలసి ఉంటుంది.
ప్రశ్న 11.
విక్షిప్త ప్రావస్థ, విక్షేపన యానకం వీటి మధ్య గల అన్యోన్య చర్యల ఆధారంగా కొల్లాయిడ్లను ఎలా వర్గీకరిస్తారు? ప్రతీ రకానికి ఒక ముఖ్య ఉదాహరణ ఇవ్వండి. సాల్ను నిల్వ ఉంచడానికి ఏ రకం సాలు స్థిరీకరణ కారకం చేర్చాలి?
జవాబు:
ఒక పదార్థం (విక్షేపణ యానకం) లో పెద్దసైజు కణాలుగా వేరొక పదార్థం (విక్షిప్త ప్రావస్థ) విక్షేపణం చెంది ఏర్పరచిన విజాతి వ్యవస్థను కొల్లాయిడ్ ద్రావణం అంటారు. నిజ ద్రావణానికి, కొల్లాయిడ్ ద్రావణానికి గల ముఖ్యమైన భేదం, విక్షిప్త ప్రావస్థగా ఉండే పదార్థకణ పరిమాణం. నిజ ద్రావణంలో విక్షిప్త ప్రావస్థకణాలు అయాన్లు లేదా చిన్న అణువులుగా ఉంటాయి.
కొల్లాయిడ్లలో బృహత్ అణువులు (ప్రోటీన్లు లేదా సంశ్లేషిత పాలిమర్లు వంటివి) లేదా అధిక సంఖ్యలో పరమాణువులు లేదా అయాన్లు, లేదా అణువులు కలసి ఏర్పరచిన సముచ్ఛయాలు విక్షిప్త ప్రావస్థ పదార్థకణాలుగా ఉంటాయి. కొల్లాయిడ్ కణాలు, సాధారణ అణువుల కంటే పెద్దవిగా ఉంటాయి. అయితే అవి అవలంబన స్థితిలో ఉండటానికి వీలైన పరిమాణంలో ఉంటాయి.
I) విక్షేపన యానకంపరంగా కొల్లాయిడ్లు:
| విక్షేపన యానకం | కొల్లాయిడ్ |
| నీరు | ఆక్వాసాల్ లేదా హైడ్రోసాల్ |
| ఆల్కహాల్ | ఆల్కాసాల్ |
| బెంజీన్ | బెంజోసాల్ |
| గాలి | ఎయిరోసాల్ |
II) విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం అనుసరించి కొల్లాయిడ్ వ్యవస్థలను ఎనిమిది రకాలుగా వర్గీకరించవచ్చు

III) విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం, వీటి మధ్య గల అన్యోన్య చర్యల స్వభావం ఆధారంగా కొల్లాయిడల్ సాల్లను రెండు రకాలుగా విభజిస్తాం.
![]()
ప్రశ్న 12.
మిసెల్లు అంటే ఏమిటి? మిసెల్ ఏర్పడే విధానాన్ని తెలిపి, సబ్బు ప్రదర్శించే శుద్ధి ప్రక్రియను చర్చించండి.
జవాబు:
మిసెల్లు :
ఒక చివర జలప్రియ మరొక చివర జల విరోధి స్వభావం గల కణాల సహచరితం వలన ఏర్పడే కణమును మిసెల్ అంటారు.
ఉదా: నీటిలో సోడియంస్టియరేట్ ఒక మిసైల్ను ఏర్పరుచును.
మిసెల్లు ఏర్పడే చర్యా విధానం:
ముసబ్బుద్రావణాన్ని ఉదాహరణగా తీసుకొందాం. భార కొవ్వు ఆమ్లాల సోడియమ్ లేదా పొటాషియమ్ లవణాన్ని సబ్బు అంటాం. దీనికి RCOO-Na (సోడియమ్ స్టియరేట్ CH3(CH2)16COO–Na+, అంటారు. ఇది చాలా బార్ సబ్బులలో ప్రధాన అనుఘటకంగా ఉంది). దీనిని నీటిలో కరిగిస్తే ఇది COO–గాను, Na+ గాను వియోజనం చెందుతుంది. RCOO– అయాన్లో రెండు భాగాలు ఉన్నాయి. ఇవి పొడవైన హైడ్రోకార్బన్ గొలుసు R (దీనిని అధ్రువ భాగం లేదా ‘తోక’ అంటారు. ఇది హైడ్రోఫోబిక్ (నీటిని వికర్షించే భాగం), COO– ధ్రువం భాగం (ధ్రువ-అయానిక లేదా తల భాగం) ఇది హైడ్రోఫిలిక్ (నీటిని ఆకర్షించే భాగం)
సబ్బుతో మురికిని తొలగించే ప్రక్రియ:
మిసెల్లో, హైడ్రోఫోబిక్ హైడ్రోకార్బన్ గొలుసు కేంద్రగర్భంగా ఉంటుంది. సబ్బులు మురికిని తొలగించే ప్రక్రియలో సబ్బు అణువులు మిసెల్ను మురికి బిందువు వద్ద ఏర్పరుస్తాయి. ఈ చర్యలో స్టియరేట్ అయాన్లోని హైడ్రోఫోబిక్ భాగం మురికి బిందుకలోకి, హైడ్రోఫిలిక్ భాగం నిక్కబొడిచిన వెంట్రుకల్లాగా మురికి (గ్రీజు) బిందుక నుంచి బయట భాగానికి ప్రక్షేపణం చెందుతాయి. పోలార్ గ్రూపులు నీటితో చర్యలో పాల్గోంటాయి. కాబట్టి స్టియరేట్ అయాన్తో పరివేష్టితమై ఉండి మురికి బిందుక నీటిలోనికి లాగబడుతుంది. ఫలితంగా మురికి ఉపరితలం నుంచి తొలగించబడుతుంది. ఈ విధంగా సబ్బు ఎమల్షన్ ఏర్పాటుకు సహాయపడి, నూనెలు, క్రొవ్వులు ఏర్పరచే మురికిని తొలగిస్తుంది.గోళికలు చుట్టూ ఋణావేశిత తొడుగు ఉండడం కారణంగా ఈ గోళికలు దగ్గరగా చేరి సముచ్ఛయాలు ఏర్పడవు.
ప్రశ్న 13.
కొల్లాయిడ్ తయారీని, అవసరమైనచోట పటాల సహాయంతో వర్ణించండి.
జవాబు:
కొల్లాయిడ్ ద్రావణాల ధర్మాలు:
i) కణాధార ధర్మాలు :
కొల్లాయిడ్ కణాలు బృహత్ పరిమాణంలో గల సముచ్ఛయం. కాబట్టి కొల్లాయిడ్ ద్రావణాలలో ఉండే ఈ కణాల సంఖ్య నిజద్రావణాలలో ఉండే కణాల సంఖ్య కంటే చాలా తక్కువ. కాబట్టి అదే గాఢత వద్ద నిజ ద్రావణాలు ప్రదర్శించే కణధార ధర్మాల కంటే కొల్లాయిడ్ ద్రావణాలు ప్రదర్శించే కణాధార ధర్మాల(ద్రవాభిసరణ, పీడనం, బాష్పీభవన నిమ్నత, ఘనీభవన ఉష్ణోగ్రత నిమ్నత, మరిగే ఉష్ణోగ్రత ఉన్నతి) పరిమాణం చాలా తక్కువ.
ii) స్కందనం :
కొల్లాయిడ్ కణాలు ఒకదానికొకటి సమీపించి, వాటిపై ఉండే విద్యుదావేశాన్ని తటస్థపరచి పాత్ర అడుగుభాగంలో అవక్షేపంగా స్థిరపడే ప్రక్రియనే స్కందనం అంటారు.
iii) టిండాల్ ఫలితం :
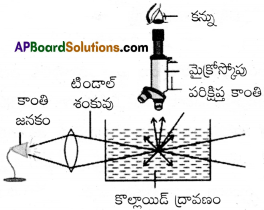
కొల్లాయిడ్ ద్రావణంలోని ద్రావిత కణాలు కాంతి కిరణాలను పరిక్షేపణం చెందించి కాంతి మార్గమును కనిపించేటట్లు చేయు ప్రక్రియను టిండాల్ ప్రభావం అంటారు. సినిమా గదిలోని ధూళి, పొగ కణాల ద్వారా ప్రొజెక్షన్ గదినుంచి ప్రయాణించే కాంతి కిరణం పరిక్షిప్తం చెందడం కారణంగా సినిమా గదిలో కూడా టిండాల్ ఫలితాన్ని మనం చూడగలుగుతున్నాం. ఈ క్రింది నియమాలను పాటించినప్పుడే టిండాల్ ఫలితాన్ని మనం చూడగలుగుతాం.
a) కొల్లాయిడ్ కణాల వ్యాసం ఉపయోగించిన కాంతి కిరణం తరంగదైర్ఘ్యం కంటే చాలా తక్కువగా ఉండకూడదు.
b) విక్షిప్త ప్రావస్థ, విక్షేపణ యానకం వంటి వక్రీభవన గుణకం విలువల మధ్య భేదం అధికంగా ఉండాలి. టిండాల్ ఫలితాన్ని నిజద్రావణాన్ని, కొల్లాయిడ్ ద్రావణాన్ని గుర్తించడానికి ఉపయోగిస్తారు.
iv) రంగు :
కొల్లాయిడ్ ద్రావణంలోని విక్షిప్త ప్రావస్థ కణాలు పరిక్షేపించిన కాంతి తరంగదైర్ఘ్యంపై కొల్లాయిడ్ ద్రావణం రంగు ఆధారపడి ఉంటుంది. ఈ కణాల పరిమాణం, ఆకారం వీటిమీద పరిక్షేపించిన కాంతి తరంగదైర్ఘ్యం ఆధారపడి ఉంటుంది. అతి సూక్ష్మగోల్డ్ కణాలు గల గోల్డ్సెల్ ఎరుపు రంగును ప్రదర్శిస్తుంది. గోల్డ్ కణం పరిమాణం పెరిగినకొద్దీ కొల్లాయిడ్ ద్రావణం రంగు ఊదా నుంచి నీలం, నీలం నుంచి చివరగా బంగారు రంగులో కనిపిస్తుంది.
v) బ్రౌనియన్ చలనం :

శక్తివంతమైన అతి సూక్ష్మదర్శిని సహాయంతో కొల్లాయిడ్ ద్రావణాలను పరిశీలిస్తే కణాలు నిరంతరంగా జిగ్-జాగ్ చలనంలో ఉన్నట్లు మన దృష్టిపరిధిలో కనిపిస్తాయి. ఈ చలనాన్ని తొలిసారిగా బ్రిటీష్ వృక్షశాస్త్రవేత్త రాబర్ట్ బ్రౌన్ కనుక్కొన్నాడు. కాబట్టి ఈచలనాన్ని బ్రౌనియన్ చలనం అంటారు. బ్రౌనియన్ చలనం కొల్లాయిడ్ కణాలు, విక్షిప్తయానయ కణాలతో జరిపే సంతులనం కాని గాధనాల కారణంగా ప్రాప్తిస్తున్నది అని వివరించాడు. బ్రౌనియన్ చలనానికి గిలకరించే స్వభావం ఫలితంగా కొల్లాయిడ్ కణాలు పాత్ర అడుగు భాగానికి చేరలేవు. దీని కారణంగా కొల్లాయిడ్ ద్రావణానికి స్థిరత్వం ప్రాప్తిస్తుంది.
vi) కొల్లాయిడ్ కణాలపై ఉండే విద్యుదావేశం:
కొల్లాయిడ్ కణాలకు విద్యుదావేశం ఉంటుంది. ఒక కొల్లాయిడ్ ద్రావణంలో ఉండే అన్ని కొల్లాయిడ్ కణాలకు ఒకేరకమైన ఆవేశం ఉంటుంది. ఈ ఆవేశం ధనావేశం లేదా ఋణావేశం కావచ్చు. కొల్లాయిడ్ కణాలు ఆవేశాన్ని సంతరించుకొవడానికి కారణం ఒకటి లేదా అంతకంటే ఎక్కువ కావచ్చు. లోహాలు ఎలక్ట్రోడ్ పై నిక్షిప్తమైనప్పుడు ఆ లోహాలు ఎలక్ట్రాన్లను బంధించి ఉండటం కారణం కావచ్చు. ద్రావణంలో ఉండే ఇతర అయాన్లను కొల్లాయిడ్ కణం అధిశోషించుకోవడం వేరొక కారణం కావచ్చు లేదా విద్యుత్ పటల ద్వయం ద్రావణంలో ఏర్పడటం మరో కారణం కావచ్చు.
vii) విద్యుదావేశిత కణచలనం (ఎలక్ట్రోఫోరెసిస్) :

కొల్లాయిడ్ కణానికి విద్యుదావేశం ఉంది అనే వాస్తవాన్ని విద్యుదావేశిత కణచలనం ప్రయోగం నిర్ధారించింది. కొల్లాయిడ్ ద్రావణంలో రెండు ప్లాటినమ్ ఎలక్ట్రోడ్లను ముంచి ఉంచి వాటి మధ్య విద్యుత్ పొటెన్షియల్ను ఆవర్తనం చేసినట్లైతే కొల్లాయిడ్ కణాలు రెండు ఎలక్ట్రోడ్లలో ఏదో ఆరంభ మట్టం – ఒక దానివైపుగా ప్రయాణిస్తాయి. కాబట్టి అనువర్తిత emf ప్రభావంతో కొల్లాయిడ్ కణం చలనం చెందే ప్రక్రియను విద్యుదావేశిత కణచలనం లేదా ఎలక్ట్రోఫోరెసిస్ అంటారు.
కొల్లాయిడ్ కణాల చలనాన్ని అనువైన పద్ధతిలో ఆపగలిగితే విక్షేపణ యానకం వ్యతిరేక దిశలో ప్రయాణిస్తుంది. దీనిని విద్యుత్ ద్రవాభిసరణం లేదా ఎలక్ట్రోఆస్మాసిస్ అంటారు.
![]()
ప్రశ్న 14.
ఎమల్షన్లు అంటే ఏమిటి? వీటిని ఎలా వర్గీకరిస్తారు? ఎమల్షన్ల అనువర్తనాలను తెలపండి. [AP 17,19][ TS-16,18]
జవాబు:
ఎమల్షన్లు :
విక్షేపక యానకము మరియు విక్షేపక ప్రావస్థ రెండు ద్రవాలుగా కల ద్రావణాలను ఎమల్షన్లు అంటారు. పాలలో, ద్రవస్థితిలో ఉండే కొవ్వు, నీటిలో విక్షేపనం చెందుతుంది. రెండవ రకం ఎమల్షన్ వ్యవస్థలో తైలం విక్షేపణ యానకం, నీరు విక్షిప్త ప్రావస్థ.
ఎమల్షన్లను రెండు రకాలుగా వర్గీకరిస్తారు.
a) నీటిలో విక్షిప్తం చెందిన తైలం (O/W) రకం:
ఈ రకం నందు విక్షిప్త ప్రావస్థ తైలము మరియు విక్షేపక యానకము నీరు. ఉదా : పాలు (ద్రవకొవ్వునీటిలో), వానిషింగ్ క్రీము.
b) తైలంలో విక్షిప్తం చెందిన నీరు (W/O) రకం:
ఈ రకము నందు విక్షిప్త ప్రావస్థ నీరు మరియు విక్షేపక యానకము తైలము. ఉదా : కాడ లివర్ ఆయిల్, స్టిఫ్ గ్రీజులు.
ఎమల్షన్ల అనువర్తనాలు:
- లోహ సంగ్రహణ శాస్త్రంలో ధాతువు నుండి లోహాన్ని సంగ్రహించు విధానంలో ముఖ్యంగా నురుగు ప్లవన ప్రక్రియలో (సల్ఫైడ్ ధాతువు) ను చూర్ణంగా చేయుటకు తైల ఎమల్షన్ వాడుతారు. దీని వలన మలినాలు నురుగు రూపంలో ఉపరితలం పై తేలటం వలన తేలికగా తొలగించవచ్చు.
- మన నిత్య జీవితంలో ప్రధాన ద్రవ ఆహారం పాలు. ఇది నీటిలో విక్షిప్తం చెందిన తైలం (O/W).
- మనం ఉపయోగించే మందులలో అధిక శాతం తైల విక్షిప్త ఎమల్షన్ రూపంలో ఉండును.
- కల్మషహరులలో (డిటర్జెంట్ల లో – బట్టలు ఉతికే సబ్బు) తయారీలో నీటిలో విక్షిప్తం చెందిన తైలములనే వాడుతున్నాం.
- ఎమలీకరణ పద్ధతిలో క్రొవ్వులను కరిగిస్తారు. అల్పమోతాదులో క్రొవ్వును తీసుకొని, క్షార ద్రావణంతో చర్య చెందించుట ద్వారా సోడియం సబ్బు (RCOONa) ఏర్పడును. మెటబాలిక్ పద్ధతిలో క్రొవ్వులను ఎమలీకరణం చెందించుటలో ఎంజైములు తేలికగా క్రొవ్వులను కరిగించగలవు.