Students get through AP Inter 1st Year Chemistry Important Questions 5th Lesson స్టాయికియోమెట్రీ which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 5th Lesson స్టాయికియోమెట్రీ
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
540 gm ల గ్లూకోజ్లో ఎన్ని మోల్ల గ్లూకోజ్ ఉంది? [AP 17] [IPE ’14][Imp.Q]
జవాబు:
గ్లూకోజ్ భారం = 540 g
గ్రా.అ.భా (C6H12O6) = 180
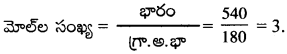
ప్రశ్న 2.
0.1 మోల్ సోడియం కార్బోనేట్ భారాన్ని లెక్కగట్టండి. [TS 16,19,20]
జవాబు:
Na2CO3 మోల్ల సంఖ్య (n) = 0.1, 1 మోల్ Na2CO3 భారం = 106
Na2CO3 భారం = n × GMW = 0.1 × 106 = 10.6 g
ప్రశ్న 3.
5.23 g ల గ్లూకోజ్లో ఎన్ని అణువులుంటాయి? (గ్లూకోజ్ అణుభారం 180 g) [Imp.Q]
జవాబు:
గ్లూకోజ్ భారం (W) = 5. 23 g
గ్లూకోజ్ గ్రా.అ.భా = 180 g
అవగాడ్రో సంఖ్య (N) = 6.023 × 1023
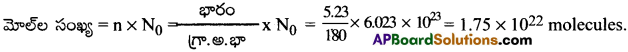
ప్రశ్న 4.
STP వద్ద 1.12 × 10-7 c. c ల వాయువులో ఉండే అణువుల సంఖ్యను లెక్కకట్టండి. (c.c – cubic centimeter = cm³)
జవాబు:
వాయువు ఘనపరిమాణం (V) = 1.12 × 10-7 cc
అవగాడ్రో సంఖ్య (N0) = 6.023 × 1023
![]()
ప్రశ్న 5.
ఒక సమ్మేళనం అనుభావిక ఫార్ములా CH2O. దాని అణుభారం 90. ఆ సమ్మేళనం అణుఫార్ములాను కనుక్కోండి. [Imp.Q][AP 16][TS 22]
జవాబు:
(CH2O) అణుభావిక భారం = 12 +2 + 16 = 30
అణుభారం = 90
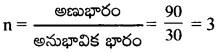
అణుఫార్ములా = (అనుభావిక ఫార్ములా)n = (CH2O)3 = C3H6O3
![]()
ప్రశ్న 6.
కింది సమీకరణాన్ని ఆక్సిడేషన్ సంఖ్య పద్ధతిలో తుల్యం చేయండి.
Cr(s) + Pb(NO3)2(aq) → Cr(NO3)3(aq) + Pb(s)
జవాబు:
1) సంక్షిప్త అయానిక సమీకరణం
Cr + Pb(NO3)2 → Cr(NO3)3 + Pb
2) ప్రతి పరమాణువు ఆక్సీకరణ సంఖ్యలను వ్రాయగా
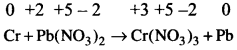
3) ఒక పరమాణువుకు ఆక్సీడేషన్ సంఖ్యలో పెరుగుదలను లేదా తగ్గుదలను లెక్కించగా.
ప్రతి అణువు యొక్క ఆక్సీకరణ సంఖ్య
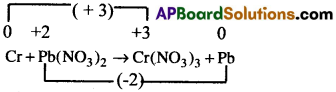
4) ఆక్సీకరణ సంఖ్యలను పరస్పరం మార్చగా
2Cr + 3Pb(NO3)2 → Cr(NO3)3 + Pb
5) ‘O’ & ‘H’ లు కాకుండా మిగిలిన మూలకాలను తుల్యం చేయుట
2Cr + 3Pb(NO3)2 → 2Cr(NO3)3 + Pb
ఇది తుల్య సమీకరణం.
ప్రశ్న 7.
0.795 g ల CuO ని Cu, H2O లుగా క్షయకరణం చేయడానికి STP వద్ద ఎంత ఘనపరిమాణం H2 అవసరమవుతుంది. [Imp.Q]
జవాబు:
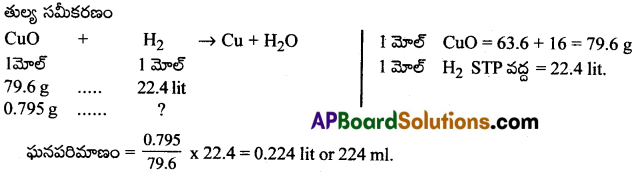
∴ 0.795 గ్రా.ల CuO ని క్షయకరణం చేయటానికి STP వద్ద H2 ఘనపరిమాణం 224ml.
ప్రశ్న 8.
100ml ల ఎసిటిలీన్ని పూర్తిగా దహనం చేయడానికి కావలసిన O2 ఘనపరిమాణాన్ని STP వద్ద లెక్కకట్టండి.
జవాబు:
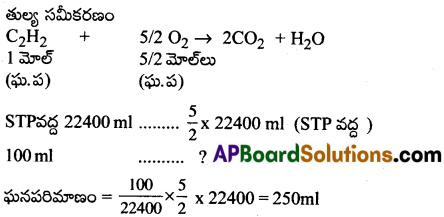
∴ STP వద్ద 100ml. ల ఎసిటిలీన్ ను దహనం చేయడానికి కావలసిన O2 ఘనపరిమాణం 250ml.
ప్రశ్న 9.
ప్రస్తుత కాలంలో ఎలక్ట్రాన్ సాంద్రత తగ్గుదల ఆక్సీకరణం అనీ, ఎలక్ట్రాన్ సాంద్రత పెరగడాన్ని క్షయకరణం అనీ అంటారు. దీన్ని మీరు సమర్థించండి.
జవాబు:
అవును. ఇది సత్యం.
వివరణ:
a) ఆక్సీకరణంలో పరమాణువు ఎలక్ట్రాన్లను కోల్పోవును. అనగా ఎలక్ట్రాన్ల సంఖ్య తగ్గును.
∴ ఎలక్ట్రాన్ సాంద్రత తగ్గును.
b) క్షయకరణంలో పరమాణువు ఎలక్ట్రాన్లను గ్రహించును. అనగా ఎలక్ట్రాన్ల సంఖ్య పెరుగును.
∴ ఎలక్ట్రాన్ సాంద్రత పెరుగును.
ప్రశ్న 10.
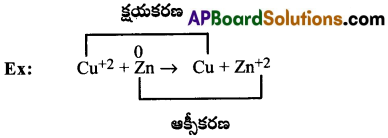
ఆక్సీకరణ. క్షయకరణ భావన అంటే ఏమిటి? ఉదాహరణ ఇవ్వండి. [Imp.Q]
జవాబు:
రిడాక్స్ భావన :
ఎలక్ట్రాన్లను కోల్పోయే ప్రక్రియను ఆక్సీకరణ చర్య అని, ఎలక్ట్రాన్లను గ్రహించే ప్రక్రియను క్షయకరణ చర్య అని అంటారు. ఈ రెండింటి మొత్తం చర్యను “ఆక్సీకరణ -క్షయకరణ” లేదా కుదింపగా ‘రిడాక్స్ చర్య’ అని పిలుస్తారు.
ప్రశ్న 11.
సోడియం సల్ఫేట్ (Na2SO4) లోని వివిధ మూలకాల ద్రవ్యరాశి శాతాలను గణించండి.
జవాబు:
ఇవ్వబడిన సమ్మేళనం (Na2SO4).
అణుభారం = 2 (23) + 1 (32) + 4 (16) = 46 + 32 + 64 = 142

∴ Na, S, O ల ద్రవ్యరాశి శాతాలు 32.39, 22.53, 45.07.
![]()
ప్రశ్న 12.
సార్థక అంకెలు అంటే మీరు ఏమి చెబుతారు? [Imp.Q]
జవాబు:
ప్రాయోగికంగా (లేదా) సిద్ధాంతరీత్యా రాబట్టిన విలువలలో అనిశ్చితత్వం ఉంటుంది. దానిని సార్థక అంకెలలో సూచిస్తారు. కచ్చితంగా తెలిసిన అర్థవంతమైన అంకెలను సార్థక అంకెలు అంటారు.
ప్రశ్న 13.
కాంతి వేగం 3.0 × 108 ms-1, అయితే 2 నానో సెకన్లలో అది ప్రయాణించే దూరాన్ని లెక్క కట్టండి.
జవాబు:
కాంతి వేగం = 3.0 × 108 ms-1
∴ ఒక సెకనులో కాంతి ప్రయాణించే దూరం= 3.0 × 108 m
2.00 నానో . సెకనులలో కాంతి ప్రయాణించే దూరం i.e., 2.00 × 10-9s
= 2.00 × 10-9 × 3.0 × 108 = 0.6 m
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
కర్బన సమ్మేళనంలోని మూలకాల రసాయన విశ్లేషణ చేశారు. భారాత్మకంగా వాటి సంఘటన శాతాలు కింది విధంగా ఉన్నాయి. కార్బన్ = 10.06%, హైడ్రోజన్ = 0.84%., క్లోరిన్ = 89.10% సమ్మేళనం అనుభావిక ఫార్ములాను కనుక్కోండి. [TS 20]
జవాబు:
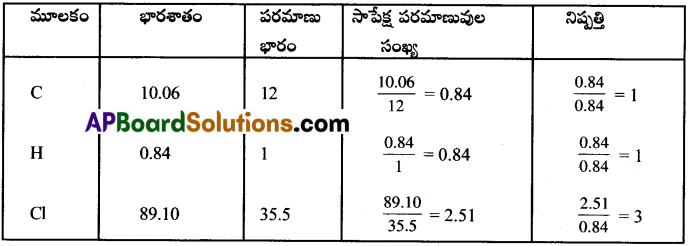
అనుభావిక ఫార్ముల = C1H1Cl3 = CHCl3.
ప్రశ్న 2.
కింది సంఘటన శాతం ఉన్న సమ్మేళనపు అనుభావిక ఫార్ములాను కనుక్కోండి. పొటాషియమ్ (K) = 26.57, క్రోమియం (Cr) = 35.36, ఆక్సిజన్ (0) = 38.07.
(K, Cr O ల పరమాణు భారాలు వరుసగా 39, 52,16 ఉంటాయి)
జవాబు:
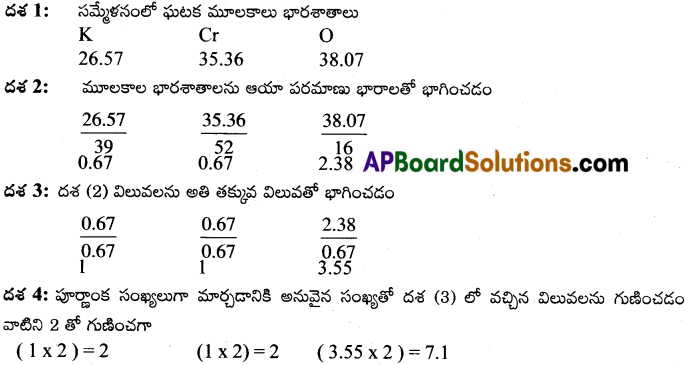
∴ సమ్మేళనం అనుభావిక ఫార్ములా K2Cr2O7
ప్రశ్న 3.
ఒక కర్బన పదార్థంలో 12.8% కార్బన్, 2.1% హైడ్రోజన్, 85.1% బ్రోమిన్లు కలవు. ఆ పదార్థం యొక్క అణుభారము 187.9 అయితే దాని అణు ఫార్ములాను కనుగొనుము. [AP 17, 19,22] [TS 17]
జవాబు:
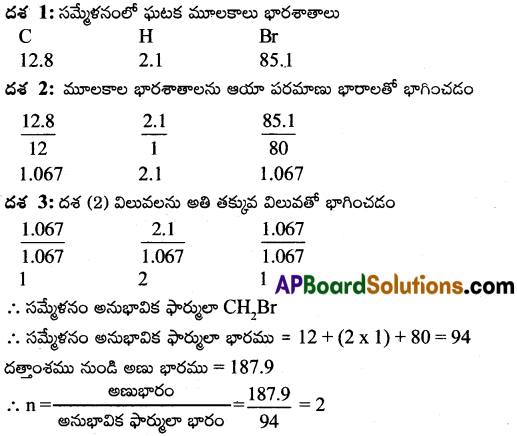
అణు ఫార్ములా = (అనుభావిక ఫార్ములా)n = (CH2Br)2 = C2H4Br2
![]()
ప్రశ్న 4.
ఒక కార్బనిక సమ్మేళనం అనుభావిక ఫార్ములా CH2 Br, 0.188 g ల సమ్మేళనం 14°C ఉష్ణోగ్రత వద్ద, 752 mm ల పీడనం వద్ద 24.2 cc ల గాలిని స్థానభ్రంశం చేసింది. అయితే సమ్మేళనం అణుఫార్ములాను కనుక్కోండి. (జలబాష్పపీడనం 14°C వద్ద 12 mm)
జవాబు:
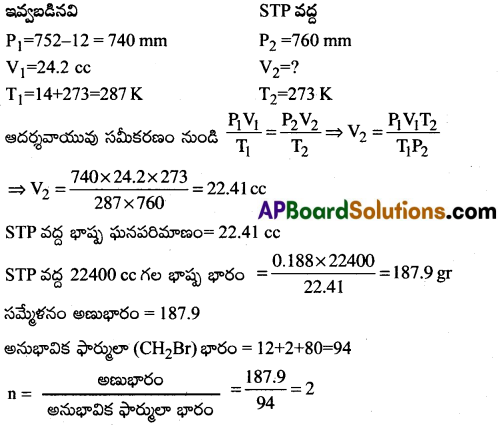
∴ అణుఫార్ములా = (అనుభావిక ఫార్ములా)n = (CH2Br)2 = C2H4Br2
ప్రశ్న 5.
క్షార యానకంలో పర్మాంగనేట్ అయాన్, అయొడైడ్ (I–) అయానన్ను ఆక్సీకరణం చేసి, అయొడిన్ (I2) మాంగనీస్ డైఆక్సైడ్ ఇచ్చే చర్యకు తల్య అయానిక సమీకరణాన్ని రాయండి. [AP 19][IPE ’14]
జవాబు:

ప్రశ్న 6.
MnO–4 + SO-33 → Mn+2 + SO-24 సమీకరణాన్ని ఆమ్ల యానకంలో తుల్యం చేయండి.
(OR)
ఆమ్ల యానకంలో పర్మాంగనేట్ అయాన్, సల్ఫైట్ అయాన్లను, సల్ఫేట్ అయాన్లుగా ఆక్సీకరణం చేసే చర్యకు తుల్య సమీకరణాన్ని రాయండి.
జవాబు:

ప్రశ్న 7.
ఆమ్ల యానకంలో ఆక్జాలిక్ ఆమ్లం, పర్మాంగనేట్ అయాన్తో Mn+2 గా ఆక్సీకరించబడుతుంది. అయాన్ -ఎలక్ట్రాన్ పద్ధతిలో చర్యను తుల్యం చేయండి. [Board Paper]
జవాబు:

ప్రశ్న 8.
C2O-27 + NO–2 → Cr+3 + NO–3 సమీకరణాన్ని ఆమ్ల యానకంలో తుల్యం చేయండి. [IPE 04, 05,14]
జవాబు:


5. పై రెండు అర్ధ చర్యలను సరియైన గుణకాలను ఉపయోగించి ఎలక్ట్రానులను రద్దు అయ్యేలా చేయాలి.
(NO–2 + H2O → NO–3 + 2H+ + 2e–) x 3
(Cr2O-27 + 14H+ + 6e– → 2Cr+3 + 7H2O) x 1 రెండు అర్ధ చర్యలను కలుపగా
Cr2O-27 + 8H+ + 3NO–2 → 2Cr+3 + 3NO–3 + 4H2O
![]()
ప్రశ్న 9.
కింది సమీకరణాన్ని తుల్యం చేయండి.
![]()
జవాబు:

Practice Questions
ఈ క్రింది సమీకరణములను అయాన్ ఎలక్ట్రాన్ పద్ధతిలో తుల్యం చేయండి.
ప్రశ్న 1.
MnO–4 + I– → MnO2 + I2 (క్షారయానకం)
జవాబు:
2MnO–4 + 4H2O + 6I– → 2MnO2 + 8OH– + 3I2
ప్రశ్న 2.
N2H4 + ClO–3 → NO + Cl– (క్షారయానకం)
జవాబు:
3N2H4 +4ClO–3 → 6NO + 4Cl– + 6H2O
ప్రశ్న 3.
H2SO4 + HBr → SO2 + Br2 (ఆమ్ల యానకం)
జవాబు:
2Br– + SO2-4 + 4H+ → Br2 + SO2 + 2H2O
ప్రశ్న 4.
MnO–4 + SO2 → Mn2+ + HSO–4 (ఆమ్ల యానకం) [TS 22]
జవాబు:
2MnO–4 + 5SO2 + 2H2O + H+ → 2Mn2+ + 5HSO–4
Textual Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
గ్లూకోజ్ (C6H12O6) అణువుకు అణుద్రవ్యరాశిని లెక్కించండి.
సాధన:
గ్లూకోజ్ (C6H12O6) అణు ద్రవ్యరాశి = 6(12.011 u) +12 ( 1.008 u) + 6 (16.00 u)
= (72.066 u) + (12.096 u) + (96.00 u) = 180.162 u
ప్రశ్న 2.
ఒక సమ్మేళనంలో 4.07 % హైడ్రోజన్, 24.27% కార్బన్ 71.65% క్లోరిన్ ఉన్నాయి. దాని మోలార్ ద్రవ్యరాశి 98.96 g అయితే దాని అనుభావిక ఫార్ములాను, అణుఫార్ములాను కనుక్కోండి. [TS 17,19]
సాధన:
1వ దశ:
ద్రవ్యరాశి శాతాన్ని గ్రాముల్లోకి మార్చుకోవడం
మనకు ద్రవ్యరాశి శాతం తెలుసు కాబట్టి 100 g సమ్మేళనాన్ని ఆరంభ ద్రవ్యరాశిగా అనుకోవడం వీలుగా ఉంటుంది. అప్పుడు 100 g ల పై సమ్మేళనంలో 4.07g హైడ్రోజన్; 24.27 g కార్బన్; 71.65 g క్లోరిన్ ఉంటాయి.
2వ దశ :
ప్రతి మూలకపు ద్రవ్యరాశిని మోల్లల సంఖ్యలుగా మార్చుకోవడం
పైన వచ్చిన ద్రవ్యరాశులను వాటి మూలకాల పరమాణు ద్రవ్యరాశులతో భాగించడం.
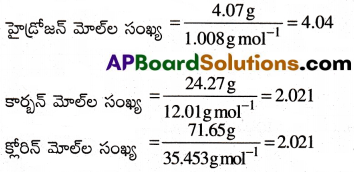
3వ దశ:
పైన వచ్చిన మోల్ల సంఖ్యలని వాటిలో అతి తక్కువ దానితో భాగించడం.
2.021 అన్నింటికన్నా తక్కువ విలువ. కాబట్టి దానితో భాగిస్తే H : C : Cl నిష్పత్తి 2:1:1 అని వస్తుంది.
ఒక వేళ సరళ నిష్పత్తి పూర్ణాంకాలది కాకపోతే అప్పుడు ఆ నిష్పత్తిని అనువైన గుణకంతో గుణించి పూర్ణాంకాల నిష్పత్తిగా మార్చవచ్చు.
4వ దశ:
ఇలా వచ్చిన సంఖ్యలు మూలకాల పరమాణువుల సాపేక్ష సంఖ్యలను తెలుపుతాయి. ఈ సంఖ్యలను ఆయా మూలకాల సంకేతాలు రాసిన తరువాత పాదాంకాలుగా చూపించి అనుభావిక ఫార్ములాను రాయాలి.
ఆ విధంగా పైన చెప్పిన సమ్మేళనానికి అనుభావిక ఫార్ములా CH2Cl అవుతుంది.
5వ దశ:
అణు ఫార్ములాని రాయడం
(a) అనుభావిక ఫార్ములా ద్రవ్యరాశిని నిర్ణయించండి. దీనికోసం అనుభావిక ఫార్ములాలో ఉన్న వివిధ మూలకాల మొత్తం పరమాణువుల ద్రవ్యరాశులను కలపాలి.
CH2Cl కి అనుభావిక ఫార్ములా ద్రవ్యరాశి 12.01 + 2 × 1.008 + 35.453 = 49.48 g.
(b) అణు ద్రవ్యరాశిని అనుభావిక ఫార్ములా ద్రవ్యరాశితో భాగిస్తే
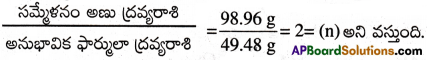
(c) అనుభావిక ఫార్ములాను పైనవచ్చిన తో గణిస్తే అణుఫార్ములా వస్తుంది.
అణుభావిక ఫార్ములా = CH2Cl, n = 2. కాబట్టి అణుఫార్ములా C2H4Cl2.
ప్రశ్న 3.
16 g ల మీథేన్ని మండిస్తే తయారయ్యే నీటి పరిమాణాన్ని (గ్రాములలో) గణించండి.
సాధన:
మీథేన్ దహనచర్యకు సమతుల సమీకరణం
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
(i) 16 g ల మిథేన్ అంటే 1 మోల్కి సమానం.
(ii) పై సమీకరణం నుంచి 1 మోల్ మీథేన్ వాయువు CH4 (వా) 2మోల్ల నీరు H2O(వా) ని ఇస్తుంది.
2 మోల్ల నీరు (H2O) = 2 × (2 + 16) = 2 × 18 = 36 g
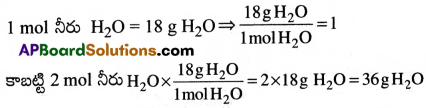
ప్రశ్న 4.
దహన చర్యలో 22g ల CO2 (వా) ని ఏర్పరచడానికి ఎన్ని మోల్ల మీథేన్ కావాలి?
సాధన:
కింది రసాయన చర్య ప్రకారం CH4(g) + 2O2 (g) → CO2(g) + 2H2O(g)
44 g CO2 (వా) ని 16 g CH4(వా) ఇస్తుంది. [∵ 1 mol CO2(వా) 1 mole CH4(వా) నుంచి తయారవుతుంది]
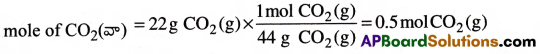
కాబట్టి 0.5 mol ల CH4(వా) నుంచి 0.5 mol CO2 (వా) ఏర్పడుతుంది. లేదా 0.5 mol ల CH4(వా) 22 g CO2 (వా). ని తయారుచేయడానికి అవసరమవుతుంది.
![]()
ప్రశ్న 5.
2ge Aని 18 g ల నీటిలో కలిపి ఒక ద్రావణాన్ని తయారు చేశారు. ద్రావితం ద్రవ్యరాశి శాతాన్ని లెక్క చేయండి. [TS 19]
సాధన:
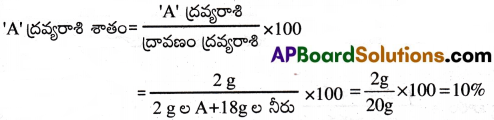
ప్రశ్న 6.
4 g ల NaOH ని తగినంత నీటిలో కరిగించి 250 ml ద్రావణం చేయగా దాని మొలారిటీని లెక్కగట్టండి. [AP 18][TS 16]
సాధన:
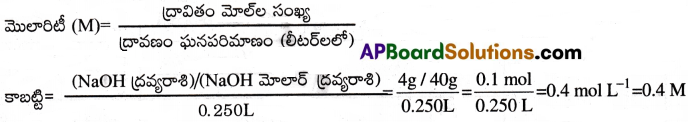
ప్రశ్న 7.
3 M NaCl ద్రావణం సాంద్రత 1.25 g mL-1, ద్రావణం మొలాలిటీని లెక్క చేయండి.
సాధన:
M = 3 mol L-1. NaCI ద్రవ్యరాశి 1L ద్రావణంలో ఉంది = 3 × 58.5 = 175.5 g
1 లీటర్ ద్రావణం ద్రవ్యరాశి = 1000 × 1.25 = 1250 g (సాంద్రత = 1.25 g mL-1 కాబట్టి)
ద్రావణంలో ఉన్న నీటి ద్రవ్యరాశి = 1250 – 175.5 = 1074.5 g = 1.0745 kg.
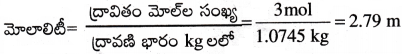
ప్రశ్న 8.
500 ml ల ద్రావణంలో 6.3 gల H2C2O4. 2H2O ఉంటే దాని నార్మాలిటీని గణించండి.
సాధన:
ద్రావితం భారం = 6.3g

ప్రశ్న 9.
250 ml ల 0.5 N ద్రావణాన్ని తయారుచేయడానికి కావలసిన Na2CO3 ద్రవ్యరాశిని కనుక్కోండి.
సాధన:
కావలసిన ద్రావణపు నార్మాలిటీ = 0.5 N
ద్రావణపు ఘనపరిమాణం = 250 ml
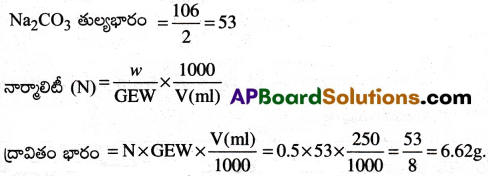
ప్రశ్న 10.
(i) HCl (ii) H2SO4 (iii) H3PO4 అనే ఆమ్లాల తుల్యాంక భారములను కనుగొనుము.
సాధన:
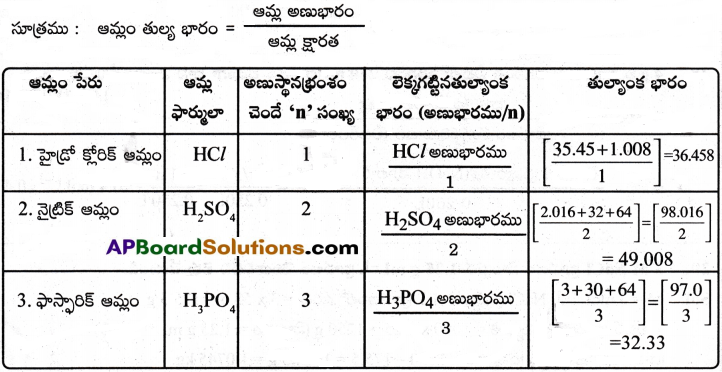
ప్రశ్న 11.
ద్రవ్య నిత్యత్వ నియమాన్ని తెలిపి, వివరించండి?
జవాబు:
ద్రవ్య నిత్యత్వ నియమం :
ఒక రసాయన చర్యలో పదార్థాన్ని కొత్తగా ఏర్పరచడం గానీ నాశనం చేయడం గానీ జరుగదు. అందుచేత, ఒక రసాయన చర్యలో ఏర్పడిన క్రియాజన్యాల లేదా ఉత్పన్నాల మొత్తం ద్రవ్యరాశి ఆ చర్యలో పాల్గొన్న క్రియాజనకాల మొత్తం ద్రవ్యరాశికి సమానం.
ప్రశ్న 12.
స్థిరానుపాత నియమాన్ని తెలిపి, వివరించండి?
జవాబు:
స్థిరానుపాత నియమం:
ఒక నిర్ధిష్ట రసాయన సంయోగ పదార్ధంలో ఒకే మూలకాలు స్థిర భార నిష్పత్తిలో కలిసి వుంటాయి. ఆవిధంగా, ఇవ్వబడిన సమ్మేళనం ఎల్లప్పుడూ ఒకే రకమైన మూలకాలను స్థిర భారాలతో కలిపినపుడు, వేడిచేసినపుడు తయారుచేయవచ్చు.
ఉదా: CO2 ను i) C మరియు ఆక్సిజన్ను కలిపినపుడు ii) సున్నపురాయిని వేడిచేసినపుడు తయారుచేయవచ్చు. కాని, ఏ విధానంలోనైనా, CO2 లో C మరియు ఆక్సిజన్ల ద్రవ్యరాశి నిష్పత్తులు 12 : 32 = 3:8
![]()
ప్రశ్న 13.
అననుపాత చర్యలు అనగానేమి? ఉదాహరణనివ్వండి? [Mar’10][TS 16,22]
జవాబు:
ఒకే మూలకం ఆక్సీకరణం మరియు క్షయకరణం రెండూ చెందే చర్యను అననుపాత చర్య అంటారు.
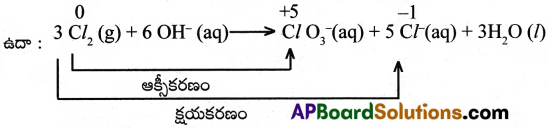
ప్రశ్న 14.
సహానుపాత చర్యలు అనగానేమి? ఉదాహరణనివ్వండి?
జవాబు:
సహానుపాత చర్యలు :
అననుపాత చర్యలకు వ్యతిరేక చర్యలే సహానుపాత చర్యలు. ఈ చర్యల్లో రెండు వేరు వేరు ఆక్సీకరణ స్థితుల్లో వున్న ఒక మూలకం క్రియాజనకాలుగా చర్య జరిపి మధ్యస్థ ఆక్సీకరణ స్థితి వున్న క్రియాజన్యాన్నిస్తుంది.
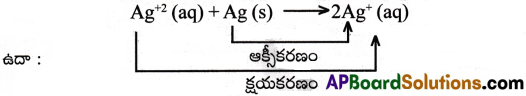
ప్రశ్న 15.
రిడాక్స్ చర్య అనగానేమి? ఉదాహరణనివ్వండి?
జవాబు:
రిడాక్స్ చర్య :
ఎలక్ట్రాన్లను కోల్పోయే చర్యలను ఆక్సీకరణ చర్యలు అని, ఎలక్ట్రానులను గ్రహించే చర్యలను క్షయకరణ చర్యలు అని అంటారు. ఈ మొత్తం చర్యలను కలిపి “ఆక్సీకరణ క్షయకరణ చర్యలు” (లేదా) “రిడాక్స్ ఎలక్ట్రానులను గ్రహించుట క్షయకరణం చర్యలు” అని అంటారు.
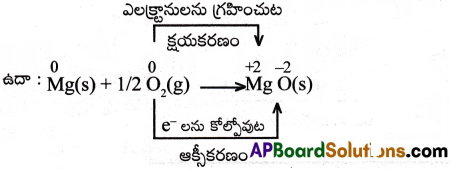
ప్రశ్న 16.
మోలారీటిని నిర్వచించుము.
4 g ల NaOH ని తగినంత నీటిలో కరిగించి 250 ml ద్రావణం చేయగా దాని మొలారిటీని లెక్కగట్టండి.
సాధన:
మోలారీటి :
ఒక లీటర్ ద్రావణంలో కరిగి ఉన్న ద్రావిత మోల్ల సంఖ్యను మోలారీటి అంటారు.
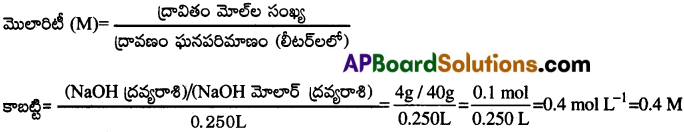
ప్రశ్న 17.
నార్మాలిటీని నిర్వచించుము.
500 ml ల ద్రావణంలో 6.3 g ల H2C2O4. 2H2O ఉంటే దాని నార్మాలిటీని గణించండి. [AP 19,20,22]
సాధన:
నార్మాలిటీ:
ఒక లీటర్ ద్రావణంలో కరిగి ఉన్న ద్రావిత గ్రామ్ తుల్యభారాల సంఖ్యను ఆ ద్రావణపు నార్మాలిటీ అంటారు.

ప్రశ్న 18.
మోలాలిటీని నిర్వచించుము.
3 M NaCl ద్రావణం సాంద్రత 1.25 g mL-1. ద్రావణం మొలాలిటీని లెక్క చేయండి.
సాధన:
మోలాలిటీ:
ఒక కేజీ ద్రావణిలో కరిగి ఉండే ద్రావిత మోల్ల సంఖ్యను మోలాలిటీ అంటారు.
M = 3 mol L-1. NaCl ద్రవ్యరాశి 1L ద్రావణంలో ఉంది = 3 × 58.5 = 175.5 g
1 లీటర్ ద్రావణం ద్రవ్యరాశి = 1000 x 1.25 = 1250 g (సాంద్రత = 1.25 g mL-1 కాబట్టి)
ద్రావణంలో ఉన్న నీటి ద్రవ్యరాశి = 1250 – 175.5= 1074.5 g = 1.0745 kg.
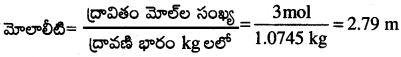
ప్రశ్న 19.
మోల్ భాగంను నిర్వచించుము.
సాధన:
మోల్ భాగం :
ఒక ద్రావణంలో నిర్దిష్ట అనుఘటక పదార్థాల మోల్లల సంఖ్యకు మొత్తం మోల్ల సంఖ్యకు గల నిష్పత్తిని మోల్భాగం అంటారు.
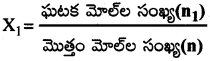
ఆక్సీకరణ సంఖ్యను కనుగొనుట పై సమస్యలు
ప్రశ్న 20.
KMnO4 లోని Mn యొక్క ఆక్సీకరణ సంఖ్యను లెక్కించండి? [AP 15]
జవాబు:
Mn ఆక్సీకరణ సంఖ్య = X అనుకొనుము.
K ఆక్సీకరణ సంఖ్య = +1; O ఆక్సీకరణ సంఖ్య = -2 .
∴ (+1) + x + 4(−2) = 0 + 1 + x – 8 = 0 x = 7
∴ Mn ఆక్సీకరణ సంఖ్య = +7
ప్రశ్న 21.
K2Cr2O7లో Cr ఆక్సీకరణ సంఖ్య ఎంత? [AP 17]
జవాబు:
Cr ఆక్సీకరణ సంఖ్య = x అనుకొనుము.
K ఆక్సీకరణ సంఖ్య = +1; O ఆక్సీకరణ సంఖ్య = −2
∴ 2(+1) + 2x + 7(-2) = 0 ⇒ 2 + 2x – 14 = 0 ⇒ 2x = 12 ⇒ x = 6
∴ K2Cr2O7లో Cr ఆక్సీకరణ సంఖ్య = 6
![]()
ప్రశ్న 22.
H2S2O8 (మార్షల్ వాయువు)లో సల్ఫర్ ఆక్సీకరణ సంఖ్యను కనుగొనండి?
జవాబు:
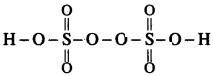
సల్ఫర్ ఆక్సీకరణ సంఖ్య = x అనుకొనుము
రెండు ఆక్సిజన్ పరమాణువులు “పెరాక్సీ బంధాన్ని” చూపుతాయి.
∴ 2(+1) + 2x + 6(−2) + 2(−1) = 0 ⇒ x = +6
∴ సల్ఫర్ ఆక్సీకరణ సంఖ్య = +6
ప్రశ్న 23.
K4Fe (CN)6లో Fe ఆక్సీకరణ సంఖ్యను కనుగొనండి?
జవాబు:
Fe ఆక్సీకరణ సంఖ్య = X అనుకొనుము.
K ఆక్సీకరణ సంఖ్య = +1; CN ఆక్సీకరణ సంఖ్య = −1
⇒ 4(+1) + x + 6(-1) = 0 ⇒ x = +2
∴ K4Fe (CN)6 లో Fe ఆక్సీకరణ సంఖ్య = +2
ప్రశ్న 24.
అమ్మోనియం నైట్రైట్ (NH4NO2)లో నైట్రోజన్ ఆక్సీకరణ సంఖ్యను లెక్కించండి?
జవాబు:
NH4NO2 అయానిక సమ్మేళనం. ఇది NH+4 మరియు NO–2 అయాన్లను కలిగి వుంటుంది.
i) NH+4 అయాన్లోని నైట్రోజన్ ఆక్సీకరణ సంఖ్య కనుగొనుట
x + (4)(+1) = +1 ⇒ x + 4 = +1 ⇒ x = -4 + 1 = −3
ii) NO–2 అయాన్లో నైట్రోజన్ ఆక్సీకరణ సంఖ్య కనుగొనుట
x + 2(-2) =-1 ⇒ x – 4 = -1 ⇒ x = +4 – 1 = +3
∴ NH4NO2 లో నైట్రోజన్ ఆక్సీకరణ సంఖ్యలు -3 మరియు +3.
ప్రశ్న 25.
H2SO5 (కారోస్ ఆమ్లం)లో సల్ఫర్ ఆక్సీకరణ సంఖ్య ఎంత?
జవాబు:
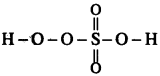
సల్ఫర్ ఆక్సీకరణ సంఖ్య = x అనుకొనుము
రెండు ఆక్సిజన్ పరమాణువులు పెరాక్సీ బంధాన్ని చూపుతాయి.
∴ 2(+1) + x + 3(−2) + 2(−1) = 0 ⇒ 2x + x – 6 – 2 = 0 ⇒ x = +6
ప్రశ్న 26.
CrO5 లో Cr ఆక్సీకరణ సంఖ్యను లెక్కించండి?
జవాబు:
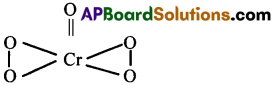
Cr ఆక్సీకరణ సంఖ్య = x అనుకొనుము
నాలుగు ఆక్సిజన్ పరమాణువులు పెరాక్సీ బంధాన్ని చూపుతాయి. …2(x)+4(-1)+1(−2) = 0 →x=+6
∴ Cr ఆక్సీకరణ సంఖ్య = +6
ప్రశ్న 27.
MnO2-4 అయాన్లో Mn ఆక్సీకరణ సంఖ్యను లెక్కించండి? [Mar’ 11][AP 15]
జవాబు:
Mn ఆక్సీకరణ సంఖ్య = x అనుకొనుము
O ఆక్సీకరణ సంఖ్య = -2
⇒ x + 4 × (−2) = -2 ⇒ x – 8 = -2 ⇒ x = -2 + 8 = +6
∴ మాంగనేట్ అయాన్లో Mn ఆక్సీకరణ సంఖ్య = +6
ప్రశ్న 28.
పర్మాంగనేట్ (MnO–4) అయాన్లో Mn ఆక్సీకరణ సంఖ్య ఎంత? [Mar’ 11]
జవాబు:
Mn ఆక్సీకరణ సంఖ్య = 1 అనుకొనుము
O ఆక్సీకరణ సంఖ్య = -2
⇒ x + 4 × (−2) = -1 ⇒ x – 8 = -1 ⇒ x = -1 + 8 = +7
∴ పర్మాంగనేట్ అయాన్లో Mn ఆక్సీకరణ సంఖ్య = +7
ప్రశ్న 28.
(a) C12H22O11 మరియు CO2 లో కార్బన్ ఆక్సీకరణ సంఖ్యను కనుగొనుము. [Mar’ 11]
(b) H2O2 మరియు O2F2 లో ఆక్సిజన్ యొక్క ఆక్సీకరణ సంఖ్యను కనుగొనుము. [TS 15,16]
జవాబు:
(a) C12H22O11 :
C యొక్క ఆక్సీకరణ సంఖ్య = x
H యొక్క ఆక్సీకరణ సంఖ్య = +1
O యొక్క ఆక్సీకరణ సంఖ్య = -2
⇒ 12x + 22(+1) + 11(-2) = 0
⇒ 12x = 0 ∴ x = 0
∴ C12H22O11 లో C యొక్క ఆక్సీకరణ సంఖ్య = 0
CO2:
C యొక్క ఆక్సీకరణ సంఖ్య = x
O యొక్క ఆక్సీకరణ సంఖ్య = -2
⇒ x + 2(−2) = 0 ⇒ x = +4
∴ CO2 లో C యొక్క ఆక్సీకరణ సంఖ్య =+4
(b) H2O2
O యొక్క ఆక్సీకరణ సంఖ్య = x
H యొక్క ఆక్సీకరణ సంఖ్య = +1
⇒ 2(1) + 2(x) = 0
2 + 2x = 0 ⇒ 2x = -2 ∴ x = -1
∴ H2O2 లో O యొక్క ఆక్సీకరణ సంఖ్య =-1
O2F2:
O యొక్క ఆక్సీకరణ సంఖ్య = x
F యొక్క ఆక్సీకరణ సంఖ్య = -1
⇒ 2(x) + 2(−1) = 0 ⇒ 2x – 2 = 0 ⇒ 2x = 2
∴ x = 1
∴ O2F2 లో O యొక్క ఆక్సీకరణ సంఖ్య +1
![]()
ప్రశ్న 29.
కింది సమ్మేళనపు అణువులలో కింద గీతలో చూపించిన మూలకాల ఆక్సీకరణ సంఖ్యలను తెలపండి: [TS 17,18]
a) NaH2PO4
b) NaHSO4
c) H4P2O7
d) K2MnO4
e) CaO2
f) NaBH4
g) H2S2O7
h) KAl(SO4)2.12H2O
జవాబు:
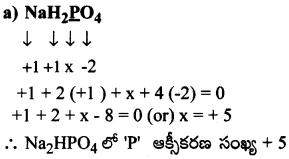


ప్రశ్న 30.
కింది వాటిలో కింద గీత చూపించిన మూలకాల ఆక్సీకరణ సంఖ్యలు లెక్కకట్టండి. మీరు ఆ ఫలితాలను ఎలా సమర్థించుకొంటారు?
a) H2S4O6
b) Fe3O4
c) CH3CH2OH
d) CH3COOH
జవాబు:

ప్రశ్న 31.
కింది ఆక్సీకరణ -క్షయకరణ (redox )చర్యలను వివరించండి.
a) CuO(s) + H2(g) → Cu(s) + H2O(g)
b) Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
c) 2K(s) + F2(g) →2K+F–(s)
జవాబు:
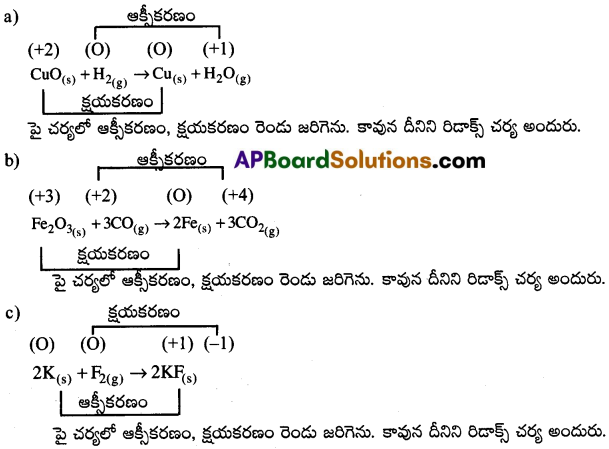
ప్రశ్న 32.
50ml 0.1N సోడియం కార్బోనేట్ ద్రావణానికి 150ml నీటిని కలిపితే వచ్చిన ద్రావణం నార్మాలిటీని గణించండి.
జవాబు:

ఫలిత ద్రావణ నార్మాలిటి = 0.025N
ప్రశ్న 33.
200ml 0.2N సోడియం హైడ్రాక్సైడ్ ద్రావణాన్ని తటస్థీకరించడానికి కావలసిన 0.1N సల్ఫ్యూరిక్ ఆమ్లం ఘనపరిమాణాన్ని గణించండి. (ఇది ఆమ్ల క్షార తటస్థీకరణ చర్య కాబట్టి తటస్థీకరణ స్థానం వద్ద, ఆమ్ల తుల్యతలు = క్షార తుల్యతలు)
జవాబు:

![]()
ప్రశ్న 34.
250ml ల 0.1N Ba(OH)2 ద్రావణాన్ని తటస్థీకరించడానికి 50ml ల H2SO4 ఆమ్లాన్ని ఉపయోగిస్తే H2SO4 నార్మాలిటీని గణించండి.
జవాబు:

H2SO4 ద్రావణం నార్మాలిటీ = 0.5N.
ప్రశ్న 35.
100ml ల 0.1M H2C2O4.2H2O ద్రావణంతో సల్ఫ్యూరిక్ ఆమ్లం సమక్షంలో చర్య జరపడానికి కావలసిన 0.1M KMnO4 ద్రావణం ఘనపరిమాణాన్ని గణించండి.
జవాబు:

KMnO4 ఘనపరిమాణం = 40ml.
ప్రశ్న 36.
20°C 770 mmHg పీడనం వద్ద 10cc మిథేన్ ను పూర్తిగా దహనం చేయడానికి STP పరిస్థితిలో కావలసిన ఆక్సిజన్ ఘనపరిమాణాన్ని లెక్కించండి.
జవాబు:

ప్రశ్న 37.
27°C 760 mm Hg పీడనం వద్ద 0.6g మెగ్నీషియం పై అధిక సజల HCl సమక్షంలో వెలువడే H2 ఘనపరిమాణం గణించండి.
జవాబు:

ప్రశ్న 38.
10 గ్రా||ల CaCO3 ను వేడిచేస్తే వచ్చే CO2 ఘనపరిమాణం విలువ STP వద్ద ఎంత? [May’09]
జవాబు:
CaCO3 → CaO + CO2
100 గ్రా॥ల CaCO3, 44 గ్రా॥లు లేదా. 1 మోల్ లేదా 22.4 లీటర్ల (STP వద్ద) CO2 ను ఇస్తుంది.
10 గ్రా॥ల CaCO3 → \(\frac{10g}{100.0g}\) × 22.4L = 2.24 లీ CO2ను ఇస్తుంది.
ప్రశ్న 39.
STP వద్ద 2.12 గ్రాములు Na2CO3 అధిక విలీన HCl తో చర్య నొందినపుడు వెలువడు CO2 ఘనపరిమాణంను
జవాబు:
106 గ్రాములు Na2CO3 STPవద్ద 44 గ్రాముల (లేదా) 22.4 CO2 ను ఇస్తుంది.
2.12 గ్రాములNa2CO3 ఎంత ఘనపరిమాణంలCO2 ను ఇస్తుంది. = \(\frac{22.4\times2.12}{106}\) = 0.448 lit
ప్రశ్న 40.
16 గ్రాముల డై ఆక్సిజన్లో ఒక మోల్ కార్బన్ మండించినపుడు వెలువడే కార్బన్ డై ఆక్సైడ్ భారంను లెక్కగట్టండి.
జవాబు:
![]()
12 గ్రా (1 మోల్) కార్బన్ ను మండించుటకు 32 గ్రా డైఆక్సిజన్ అవసరం అవుతుంది.
16 గ్రా డైఆక్సిజన్ మాత్రమే ఉన్నందున సగం కార్బన్ అనగా 6 గ్రా కార్బన్ దహనం చెంది సగం మోల్ CO2 ఏర్పడుతుంది. కావున 22 గ్రా. CO2 ఏర్పడుతుంది.
ప్రశ్న 41.
ఆమ్ల యానకంలో KMnO4 యొక్క తుల్యభారాన్ని లెక్కించండి.
జవాబు:
ఆమ్లయానకంలో KMnO4 బలమైన ఆక్సీకరణ కారకం.
KMnO4 + 8H+ + 5e– → K+ + Mn+2 + 4H2O
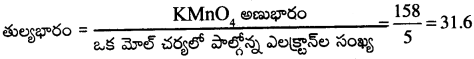
ప్రశ్న 42.
ఆమ్ల-యానకంలో K2Cr2O7 యొక్క తుల్యభారాన్ని లెక్కించండి.
జవాబు:
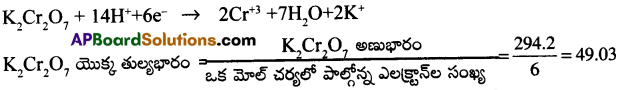
ప్రశ్న 43.
ఈ కింది వాటిలో ఎన్ని సార్థక అంకెలు ఉన్నాయో తెలపండి.
(i) 0.0025, (ii) 208, (iii) 5005, (iv) 126, 000 (v) 500.0, (vi) 2.0034
జవాబు:
i) 0.0025 కు 2 సార్థక అంకెలు కలవు.
ii) 208 కు 3 సార్థక అంకెలు కలవు.
iii)5005 కు 4 సార్థక అంకెలు కలవు.
iv) 126,000 కు 3 సార్థక అంకెలు కలవు.
v) 500.0 కు 4 సార్థక అంకెలు కలవు.
vi) 2.0034కు 5 సార్థక అంకెలు కలవు.
![]()
ప్రశ్న 44.
ఈ కింది వాటిని మూడు సార్థక అంకెల వరకు సరిదిద్దండి.
(i) 34.216, (ii) 10.4107, (iii) 0.04597 (iv) 2808
జవాబు:
i) 34.216 ను 34.2 గా మార్చవచ్చు
ii) 10.4107 ను 10.4గా మార్చవచ్చు
iii) 0.04597 ను 0.0460గా మార్చవచ్చు
iv) 2808 ను 2810 గా మార్చవచ్చు