Students get through AP Inter 1st Year Chemistry Important Questions 7th Lesson రసాయనిక సమతాస్థితి, అమ్లాలు – క్షారాలు which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 7th Lesson రసాయనిక సమతాస్థితి, అమ్లాలు – క్షారాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
రసాయన సమతా స్థితి నియమం తెలపండి. [Imp.Q]
జవాబు:
రసాయన సమతా స్థితి నియమం:
నిర్దిష్ట ఉష్ణోగ్రత వద్ద, సమతుల్యం చేయబడిన రసాయన సమీకరణంలోని, క్రియాజన్యాల గాఢతలను సూచించే పదాలకు, వాటి సంబంధిత స్థాయికోమెట్రిక్ గుణకాలను ఘాతాలుగా రాసి ఏర్పడిన గాఢత పదాల అంకగణిత లబ్దాల విలువను సమీకరణంలోని క్రియాజనకాల గాఢతలను సూచించే పదాలకు, విలువతో భాగిస్తే, వాటి స్టాయికోమెట్రిక్ గుణకాలను ఘాతాలుగా రాసి, ఏర్పడిన గాఢత పదాల అంకగణిత స్థిర విలువ లభిస్తుంది. దీనినే సమతాస్థితి నియమం లేదా రసాయన సమతాస్థితి నియమం అంటాం.
ప్రశ్న 2.
తెరచిన పాత్రలో నీరు, దాని బాష్పం మధ్య సమతాస్థితిని పొందగలమా? వివరించండి. [Imp.Q]
జవాబు:
తెరచి ఉంచిన పాత్రలో నీటికి నీటి భాష్పానికి మధ్య సమతాస్థితిని పొందలేము. దీనికి కారణం నీటి భాష్పాలు వాతావరణంలోకి ప్రవేశించును. అప్పుడు భాష్పశీలత రేటు సంఘనన రేటు కన్నా ఎక్కువగా ఉండును.
ప్రశ్న 3.
సమతాస్థితి స్థిరాంకాల సమాసాలలో శుద్ధ ద్రవాల, శుద్ధ ఘన పదార్థాల గాఢతను ఎందుకు విస్మరిస్తాం.
జవాబు:
శుద్ధ ద్రవాలు, శుద్ధ ఘన పదార్థాల గాఢత ఒకటికి సమానం. అందువలన సమతాస్థితి స్థిరాంకాల సమాసాలలో శుద్ధ ద్రవాల, శుద్ధ ఘన పదార్థాల గాఢతను విస్మరిస్తారు.
ప్రశ్న 4.
సమజాతి సమతాస్థితి అంటే ఏమి? సమజాతి సమతాస్థితి, చర్యలకు రెండు ఉదాహరణలు రాయండి. [Imp.Q][IPE ’14][AP 17]
జవాబు:
క్రియాజనకాలు మరియు క్రియాజన్యాల భౌతికస్థితులు ఒకే విధంగా ఉంటే, ఆ సమతాస్థితిని సజాతి సమతాస్థితి అంటారు.
ఉదా : N2(g) + 3H2(g) ⇌ 2NH3(g)
H2(g) + I2(g) ⇌ 2HI(g)
ప్రశ్న 5.
విజాతి సమతాస్థితి అంటే ఏమిటి? విజాతి సమతాస్థితి చర్యలకు రెండు ఉదాహరణలు ఇవ్వండి. [Imp.Q][AP 17,18]
జవాబు:
క్రియాజనకాలు మరియు క్రియాజన్యాల భౌతిక స్థితులు కొన్ని లేదా అన్ని వేరువేరుగా ఉంటే, ఆ సమతాస్థితిని విజాతి సమతాస్థితి అంటారు.

![]()
ప్రశ్న 6.
కింది చర్యలకు, చర్యా భాగఫలం Q విలువను రాయండి. [Imp.Q]
a) 3O2(g) ⇌ 2O3(g)
b) 4NH3(g) + 7O2(g) ⇌ 4NO2(g) +6H2O(g)
జవాబు:

ప్రశ్న 7.
సమతాస్థితి స్థిరాంకం నిర్వచించండి. [Imp.Q]
జవాబు:
సమతాస్థితి స్థిరాంకం:
“ఇచ్చిన ఉష్ణోగ్రత వద్ద, క్రియాజన్యాల సమతాస్థితి గాఢతల లబ్ధం మరియు క్రియాజనకాల సమతాస్థితి గాఢతల లబ్ధము నకు గల నిష్పత్తిని ‘సమతాస్థితి స్థిరాంకము’ అంటారు.”
ప్రశ్న 8.
ఒక వాయు స్థితి చర్యకు, సమతాస్థితి స్థిరాంక సమాసం కింది విధంగా ఉంది. Kc = \(\frac{\left[\mathrm{NH}_3\right]^4\left[\mathrm{O}_2\right]^5}{[\mathrm{NO}]^4\left[\mathrm{H}_2 \mathrm{O}\right]^6}\)
దీనిని సంబంధించిన సమతుల్యం చేయబడిన రసాయన సమీకరణం రాయండి.
జవాబు:
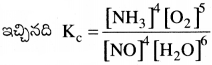
సమతుల్య రసాయన సమీకరణం 4NO + 6H2O ⇌ 4NH3 + 5O2
ప్రశ్న 9.
Kp, Kc ల మధ్య సంబంధం రాయండి. [Imp.Q]
జవాబు:
kp = kc (RT)∆n.
kp = పాక్షిక పీడన సమతాస్థితి స్థిరాంకం
kc = మోలార్ గాఢత సమతాస్థితి స్థిరాంకం
R = వాయు స్థిరాంకం
T = కెల్విన్లో ఉష్ణోగ్రత
∆n = (వాయు క్రియాజన్యాల అణువుల సంఖ్య) – (వాయు క్రియాజనకాల అణువుల సంఖ్య)
ప్రశ్న 10.
ఏ పరిస్థితులలో ఒక చర్యకు KP, KCలు సంఖ్యపరంగా సమానం. [Imp.Q]
జవాబు:
∆n = 0 అయినప్పుడు వాయుస్థితిలో ఉన్న క్రియజన్యాల సంఖ్య = వాయు స్థితిలో ఉన్న క్రియజనకాల సంఖ్య.
Kp = Kc (RT)∆n
Kp = Kc (RT)0
Kp = Kc
ప్రశ్న 11.
Kp = Kc అయినటువంటి రెండు రసాయనిక సమతాస్థితి చర్యలను తెలపండి. [Imp.Q]
జవాబు:
1) H2(g) + I2(g) ⇌ 2HI(g)
2) N2(g) + O2(g) ⇌ 2NO(g)
![]()
ప్రశ్న 12.
Kp > Kc అయినటువంటి రెండు రసాయనిక సమతాస్థితి చర్యలను తెలపండి. [AP 20][Imp.Q]
జవాబు:
1) PCl5(g) ⇌ PCl3(g) + Cl2(g)
2) N2O4(g) ⇌ 2NO2(g)
ప్రశ్న 13.
Kp < Kc అయినటువంటి రెండు రసాయనిక సమతాస్థితి చర్యలను తెలపండి. [Imp.Q]
జవాబు:
1) N2(g) + 3H2(g) ⇌ 2NH3(g)
2) 2SO2(g) + O2(g) ⇌ 2SO3(g)
ప్రశ్న 14.
Kc ను Kp గా మార్చే సమీకరణాలను కింది చర్యలక రాయండి.
a) CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
b) C3H8(g) + 5O2(g) ⇌ 3CO2(g) + 4H2O(g)
జవాబు:

ప్రశ్న 15.
రసాయనిక సమతాస్థితిని ప్రభావితం చేసే కారణాంకాలు ఏవి? [Imp.Q]
జవాబు:
రసాయన సమతాస్థితిని ప్రభావితం చేసే అంశాలు:
- క్రియాజనకాల, క్రియాజన్యాల గాఢతలు.
- చర్య ఉష్ణోగ్రత
- చర్య పీడనం
- జడవాయు సంకలనం
ప్రశ్న 16.
వాయు స్థితి రసాయన సమతాస్థితిపై పీడనం ప్రభావం ఏమిటి ? [AP 19][Imp.Q]
జవాబు:
రసాయన సమతా స్థితిపై పీడనాన్ని పెంచినప్పుడు మోల్ల సంఖ్య తక్కువగా ఉన్న దిశగా రసాయన చర్య జరుగును.రసాయన తుల్య సమీకరణంలో ఎటు వైపు మోల్ల సంఖ్యల తక్కువగా ఉండునో అటు వైపుకి చర్య జరుగను.క్రియజనకాల, క్రియ జన్యాల మోల్ల సంఖ్య సమానమైనప్పుడు (∆n = 0). రసాయన సమతాస్థితిపై పీడన ప్రభావం ఉండదు.
ప్రశ్న 17.
సమతాస్థితి వద్ద ఉండే రసాయన చర్యలో క్రియాజనకాల గాఢతల మార్పు ప్రభావం ఏమిటి? [Imp.Q]
జవాబు:
క్రియాజనకాలు గాఢతను పెంచినా, ఉత్పన్నాల గాఢతలను తగ్గించినా పురోగామి చర్య ప్రోత్సాహించబడుతుంది.
ప్రశ్న 18.
సమతాస్థితిని ఉత్ప్రేరకం ప్రభావితం చేస్తుందా? [Imp.Q]
జవాబు:
సమతాస్థితిని ఉత్ప్రేరకం ప్రభావితం చేయదు. కేవలం సమతాస్థితి త్వరితగతిన ఏర్పడేట్లు చేయును.
ప్రశ్న 19.
సమతాస్థితి స్థిరాంకం విలువ ఏ కారణాంశం మీద ఆధారపడి ఉంటుంది.?
జవాబు:
ఉష్ణోగ్రత. ఉష్ణగ్రాహక చర్యలకు అధిక ఉష్ణోగ్రత అనుకూలం. ఉష్ణమోచక చర్యలకు అల్ప ఉష్ణోగ్రత అనుకూలం.
![]()
ప్రశ్న 20.
ఒక చర్య సమతాస్థితి స్థిరాంకాలు వరుసగా 27°C, 127°C ల వద్ద 1.6 × 10-3, 7.6 × 10-2 ఈ చర్య ఉష్ణగ్రాహచర్యా లేదా ఉష్ణమోచక చర్యా?
జవాబు:
ఇక్కడ 7.6 × 10-3 > 1.6 × 10-3 పై విలువలను బట్టి ఉష్ణోగ్రత పెరిగినప్పుడు సమతాస్థితి స్థిరాంకం (Kc) విలువ పెరిగినది కావున ఈ చర్య ఉష్ణగ్రాహక చర్య.
ప్రశ్న 21.
సమతాస్థితి వద్ద ఉండే వ్యవస్థపై ఉష్ణోగ్రత ప్రభావం ఏమి?
జవాబు:
ఉష్ణమోచక చర్యలలో ఉష్ణోగ్రత పెరిగితే తిరోగామి చర్య ప్రభావితం అవుతుంది. ఉష్ణగ్రాహక చర్యలలో ఉష్ణోగ్రతను పెంచితే పురోగామి చర్య ప్రభావితం అవుతుంది.
ప్రశ్న 22.
ఒక ఉష్ణమోచక చర్య ఉష్ణోగ్రతను పెంచితే, ఆ చర్య సమతాస్థితి స్థిరాంకం ఏ మార్పుకు గురవుతుంది. [Imp.Q]
జవాబు:
ఉష్ణమోచక చర్యలలో ఉష్ణోగ్రత పెరిగితే, సమతాస్థితి స్థిరాంకం విలువ తగ్గుతుంది.
ప్రశ్న 23.
వాయువులు మాత్రమే పాల్గొనే చర్యకు ∆G° ద్వారా ఏ రకపు సమతాస్థిరాంకాన్ని లెక్కించవచ్చు?
జవాబు:
ఉష్ణగతిక శాస్త్ర ఆధారంగా ∆G = ∆G° + RTlnQ
సమతాస్థితి వద్ద, ∆G = 0 and Q = K
∴ ∆G = ∆G° + RTlnK = 0
∆G° = -RTlnK
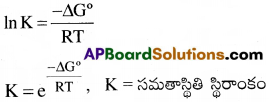
వాయువులు పాల్గోనే చర్యలకు సమతాస్థితి స్థిరాంకం (Kp) ని లెక్కించవచ్చు.
ప్రశ్న 24.
బ్రాన్ స్టెడ్ క్షారం అంటే ఏమిటి? ఒక ఉదాహరణ తెలపండి. [AP 16][TS 19]
జవాబు:
దాత నుండి ప్రోటాన్(ల)ను గ్రహించే ప్రవృత్తి ఉన్న రసాయన పదార్థాన్ని బ్రాన్ స్టెడ్ క్షారం అంటారు.
ఉదా: NH3, H2O
ప్రశ్న 25.
లూయీ ఆమ్లం అంటే ఏమిటి? ఒక ఉదాహరణ తెలపండి. [AP 15,16,22][TS 17,18,19]
జవాబు:
‘ఒక దాత నుంచి ఎలక్ట్రాన్ జంటను స్వీకరించి, దానిలో సమన్వయ సమయోజనీయ బంధాన్ని ఏర్పరచగలిగే పదార్థం (లేదా) రసాయన జాతిని ‘లూయీ ఆమ్లం’ అంటారు.
ఉదా: H+, BF3
ప్రశ్న 26.
నీటి అయానిక అంటే ఏమిటి? [TS 16,18][AP 17]
జవాబు:
స్థిర ఉష్ణోగ్రత వద్ద శుద్ధజలంలో లేదా జలద్రావణాలలో హైడ్రోజన్ (H+), హైడ్రాక్సిల్ OH– అయాన్ల గాఢతల లబ్ధాన్ని నీటి అయానిక అంటారు.
నీటి అయానిక లబ్ధం Kw = [H+][OH–]
![]()
ప్రశ్న 27.
Kw, విలువ ఏమి? దీని పరామితులు ఏమి?
జవాబు:
25°C వద్ద నీటి అయానిక విలువ Kw = 1 × 10-14 mol²/lit²
ప్రమాణములు: mol²/lit²
ప్రశ్న 28.
నీటి అయానిక లబ్దం విలువపై ఉష్ణోగ్రత ప్రభావం తెలపండి.? [Imp.Q]
జవాబు:
ఉష్ణోగ్రత పెరిగే నీటి అయనీకరణ పెరుగుతుంది. కాబట్టి Kw, విలువ పెరుగుతుంది.
ప్రశ్న 29.
H2O+ H2O ⇌ H3O+ + OH–
25°C, 40°C ఉష్ణోగ్రతల వద్ద వరసగా నీటి అయానిక లబ్దం విలువలు 1 × 10-14, 3 × 10-14 పై చర్య ఉష్ణమోచక చర్యా? లేదా ఉష్ణగ్రహక చర్యా?
జవాబు:
ఇవ్వబడినది H2O + H2O ⇌ H3O+ + OH–
25°C వద్ద Kw = 1 × 10-14 mol²/lit²
40°C వద్ద Kw = 3 × 10-14 mol²/lit²
ఉష్ణోగ్రత పెరుగుదలతో Kw విలువ పెరిగినది కావున ఇది ఉష్ణగ్రాహక చర్య.
ప్రశ్న 30.
‘బ్రాన్ ష్టెడ్ క్షారాలు అన్నీ లూయీ క్షారాలే’ వివరించండి. [Imp.Q]
జవాబు:
ప్రోటాన్ గ్రహీతని బ్రాన్ డ్ క్షారమని మరియు ఎలక్ట్రాన్ జంట దాతను లూయీ క్షారం అని అంటారు.

ఇక్కడ బ్రోమైడ్ ఎలక్ట్రాన్ జంటను దానం చేసినది కావున ఇది లూయీ క్షారం.
ప్రశ్న 31.
‘లూయీ ఆమ్లాలు అన్నీ బ్రాన్ ష్టెడ్ ఆమ్లాలు కావు’. ఎందువల్ల? [Imp.Q]
జవాబు:
ఎలక్ట్రాన్ జంట స్వీకర్తను లూయీ ఆమ్లం అని మరియు ప్రోటాన్ దాతను బ్రాన్డెడ్ ఆమ్లం అంటారు.
BF3 అనునది లూయీ ఆమ్లం కాని ప్రోటాన్లను దానం చేయలేదు కావున అది బ్రాన్టెడ్ ఆమ్లం కాదు.
కావున లూయీ ఆమ్లాలన్నీ బ్రాన్స్టెడ్ ఆమ్లాలు కావు.
![]()
![]()
ప్రశ్న 32.
అయనీకరణం అవధి అంటే ఏమిటి?
జవాబు:
అయనీకరణం అవధి (α):
అయనీకరణం చెందిన పదార్థపు మోలుల సంఖ్య, పదార్థపు మొత్తం మోలుల సంఖ్యల నిష్పత్తిని అయనీకరణ అవధి (α) అంటారు.
ప్రశ్న 33.
ఒక ఆమ్లం లేదా క్షారం బలాన్ని వ్యక్తం చేసే రాశి ఏది?
జవాబు:
ఆమ్ల, క్షారబలాలను pH విలువ ఆధారంగా తెలుసుకొనవచ్చును.
ఆమ్ల బలాన్ని వ్యక్తం చేసే రాశి ఆమ్ల వియోజన స్థిరాంకం (Ka)
క్షార బలాన్ని వ్యక్తం చేసే రాశి క్షార వియోజన స్థిరాంకం (Kb)
ప్రశ్న 34.
వాటి జలద్రావణాలలో, క్షార స్వభావం చూపే రెండు లవణాలను తెలపండి.
జవాబు:
బలహీన ఆమ్ల మరియు బలమైన క్షారాల వల్ల ఏర్పడిన లవణజల ద్రావణాలు క్షార స్వభావాన్ని కలిగి ఉండును.
ఉదా: సోడియం ఏసిటేట్ CH3COONa, సోడియం కార్బోనేట్ Na2CO3
ప్రశ్న 35.
వాటి జలద్రావణాలలో, ఆమ్ల స్వభావం చూపే రెండు లవణాలను తెలపండి.
జవాబు:
బలమైన ఆమ్ల మరియు బలహీన క్షారాల వల్ల ఏర్పడిన లవణ జల ద్రావణాలు ఆమ్ల స్వభావాన్ని కలిగి ఉండును.
ఉదా: NH4Cl, Al2(SO4)3, CuSO4 మొదలైనవి.
ప్రశ్న 36.
ఆమ్ల బఫర్ ద్రావణం pH ను లెక్కించడానికి ఏ సమీకరణాన్ని ఉపయోగిస్తారు?
జవాబు:
ఆమ్ల బఫర్ యొక్క pH ఈ క్రింది సమీకరణం ద్వారా లెక్కిస్తాము.
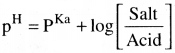
ప్రశ్న 37.
ఫాస్ఫారిక్ ఆమ్లం (H3PO4) కు మూడు అయనీకరణ స్థిరాంకాలు ఉన్నాయి. ఇవి Ka1, Ka2, Ka3. వీటిలో దేనికి కనిష్ఠ విలువ ఉంటుంది? కారణాలు తెలపండి.
జవాబు:
ఫాస్ఫారిక్ అమ్లం (H3PO4) యొక్క అయనీకరణ స్థిరాంకాలు.
Ka1 = 7.5 × 10-3
Ka2 = 6.2 × 10-8
Ka3 = 4.2 × 10-13
వీటిలో Ka3కి తక్కువ విలువ కలదు.
కారణం:
HPO-24 ఋణాత్మక అయాన్ నుండి ప్రోటాన్ ను తొలగించుట కష్టము.
![]()
ప్రశ్న 38.
ఎత్తు ప్రదేశాలలో ఐస్ నెమ్మదిగా కరుగుతుంది. దీనికి కారణం వివరించండి. [Imp.Q]
జవాబు:
ఎత్తైన ప్రదేశాలలో వాతావరణ పీడనం తక్కువగా ఉండటం వలన మంచు నెమ్మదిగా కరుగును. పీడనం పెరిగిన కొలది మంచు కరుగుట పెరిగి పురోగామి చర్య జరుగును. మంచు(s) → నీరు
ప్రశ్న 39.
ఆమ్లపు ‘క్షారత’ మరియు క్షారం ‘ఆమ్లత’ లను నిర్వచించండి. [TS 18]
జవాబు:
ఆమ్లపు అణువులోని లోహ అయాన్ చేత స్థానభ్రంశం చెందించిన హైడ్రోజన్ (H) పరమాణువుల సంఖ్యను ఆ ఆమ్లం యొక్క క్షారత అంటారు.
క్షార అణువులోని లోహ అయాన్ చేత స్థానభ్రంశం చెందించిన హైడ్రాక్సిల్ సమూహంల (OH) సంఖ్యను క్షారం యొక్క ఆమ్లత అంటారు.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
కింది సమతాస్థితి చర్యలకు Kp, Kc ల మధ్య గల సంబంధాన్ని ఉత్పాదించండి. [May’13, Mar’13][AP 15,19][TS 19,22]
(a) N2(g) + 3H2(g) ⇌ 2NH3(g)
(b) 2SO2(g) + O2(g) ⇌ 2SO3(g)
జవాబు:
(a) Kp, Kc ల మధ్య సంబంధం Kp = Kc(RT)∆n.
దత్త సమీకరణం N2(g) + 3H2(g) ⇌ 2NH3(g)
∆n = np – nr = 2 – 4 = -2
⇒ Kp = Kp (RT)-2 ∴ Kp < Kc.
(b) Kp, Kc ల మధ్య సంబంధం Kp = Kc(RT)∆n
దత్త సమీకరణం 2SO2(g) + O2(g) ⇌ 2SO3(g)
∆n = np – nr = 2 – 3 = -1
⇒ Kp = Kp (RT)-1 ∴ Kp < Kc.
ప్రశ్న 2.
ఒక చర్య విస్తృతిని, సమతాస్థితి స్థిరాంకం ఏ విధంగా ఊహిస్తుంది.?
జవాబు:
చర్య జరిగే విస్తృతిని ఊహించడం: ఒక చర్య సమతాస్థితి స్థిరాంకం సంఖ్యాత్మక విలువ, ఆ చర్య విస్తృతిని తెలుపుతుంది. అయితే సమతాస్థితి స్థిరాంకం ఎంత వేగం (రేటు) తో చర్య సమతాస్థితిని చేరుకుంది అనే విషయాన్ని మాత్రం సమతాస్థితి స్థిరాంకం తెలియజేయదు.
సమతాస్థితి మిశ్రమాలను గురించిన సాధారణీకరణములు:
i) Kc > 10³, అయితే క్రియజనకాల కంటే క్రియాజన్యాలు అధికంగా ఉంటాయి. అంటే Kc విలువ అత్యధికంగా ఉన్నట్లయితే చర్య సుమారుగా పూర్తిగా జరుగుతుందని ఊహించవచ్చు.
ఉదా: H2(g) + Cl2(g) ⇌ 2HCl(g), 300K వద్ద Kc = 4.0 × 1031
ii) Kc < 103, అయితే క్రియజనకాలు క్రియాజన్యాల కంటే అధికంగా ఉంటాయి. అంటే Kc విలువ అతి తక్కువ అయితే ఆ చర్య అరుదుగా జరుగుతుంది..
ఉదా: N2(g) + O2(g) ⇌ 2NO(g), 298K వద్ద Kc = 4.8 × 10-31
iii) Kcవిలువ 103 మరియు 10³,మధ్యగా ఉండినట్లైతే చర్యలో గమనించదగిన గాఢతలో క్రియజన్యాలు, క్రియాజనకాలు కూడా ఉంటాయి.
ఉదా: H2(g) + I2(g) ⇌ 2HI(g), 700K వద్ద Kc = 57.0
ప్రశ్న 3.
Q, K లను సరిపోల్చడం ఎందుకు ఉపయోగపడుతుంది? కింది వాటిలో పరిస్థితులు ఏమి?
(a) Q = K (b) Q < K (c) Q > K?
జవాబు:
Q మరియు K లు చర్య దిశను కనుగొనుటకు ఉపయోగిస్తారు.
(a) Q = K అనగా చర్య సమతాస్థితిలో ఉండును.
(b) Q < K అనగా చర్య పురోగామి దిశలో జరుగును. (అనగా క్రియజన్యాల వైపు)
(c) Q > K అనగా చర్య తిరోగామి దిశలో జరుగును. (అనగా క్రియజనకాల వైపు)
ప్రశ్న 4.
ఆర్హీనియస్ ఆమ్లాల, క్షారాల భావనలను వివరించండి. [TS 22]
జవాబు:
ఆర్హీనియస్ ఆమ్లాల, క్షారాల భావన:
ఆమ్లం :
తనలో H ఉండి జలద్రావణాల్లో H+ లేదా H3O+ అయాన్లను ఇచ్చే పదార్థాన్ని ఆర్హీనియస్ ఆమ్లం అంటారు.
ఉదా: HCl, HBr, HClO4, HNO3 మొదలైనవి.
క్షారం:
తనలో OH ఉండి జలద్రావణాల్లో OH– అయాన్లను ఇచ్చే పదార్థాన్ని ఆర్హీనియస్ క్షారం అంటారు.
ఉదా: NaOH, KOH, NH4OH మొదలైనవి.
తటస్థీకరణం:
ఆమ్లం నుండి H+ అయాన్లు క్షారం నుండి OH – అయాన్లు కలిసి నీరును ఏర్పరచుటను తటస్థీకరణం అంటారు.
HCl + NaOH → NaCl + H2O
క్షార తటస్థీకరణ చర్యలకు H+(aq) + OH–(aq) → H2O(l)
పరిమితులు:
- ఇది జలద్రావణాలకు మాత్రమే పరిమితం.
- CO2, SO2, ఆమ్ల స్వభావాన్ని NH3, CaO ల క్షార స్వభావాన్ని వివరించలేదు.
![]()
ప్రశ్న 5.
ఉభయసామాన్య అయాన్ ప్రభావం అనగా నేమి? వివరించండి.
జవాబు:
ఉమ్మడి అయాన్ ప్రభావం :
ఒక విద్యుత్ విశ్లేష్యకం (లవణం, ఆమ్లం, క్షారం) నీటిలో ద్రావణీయత, దానికి విద్యుత్ విశ్లేష్యకంలోని కాటయాన్ లేదా యానయాన్ ఉభయ సామాన్యంగా ఉండే వేరొక విద్యుత్ విశ్లేష్యకం (లవణం, ఆమ్లం, క్షారం)చేర్చినపుడు మొదటి విద్యుత్ విశ్లేష్యకం ద్రావణీయత తగ్గుతుంది. దీనిని ఉమ్మడి అయాన్ ప్రభావం అంటారు.
ఉదా : CH3COOH జలద్రావణంలో CH2COOH ⇌ CH2COO– + H+ అయాన్ల సమతాస్థితి ఉంటుంది. సోడియం ఎసిటేట్ రూపంలో
దీనికి ఎసిటేట్ ఉభయసామాన్య అయాన్ ను చేర్చితే, ఎసిటిక్ ఆమ్లం అయనీకరణం తగ్గిపోతుంది. మరియు సమతాస్థితి ఎడమవైపుకు జరుగుతుంది.
CH2COOH ⇌ CH2COO– + H+ (బలహీన విద్యుత్ విశ్లేష్యకం)
CH2COONa → CH2COO– + Na+ (బలమైన విద్యుత్ విశ్లేష్యకం)
కావున జలద్రావణంలో ఎసిటేట్ అయాన్ల గాఢత పెరిగిన కొలది, ఎసిటికామ్లం అయనీకరణం తగ్గుతుంది. దీనికి కారణం ఉభయ సామాన్య అయాన్ ప్రభావం.
ప్రాముఖ్యత :
- ఉభయ సామాన్య అయాన్ ప్రభావం గుణాత్మక విశ్లేషణలో ముఖ్యమైన దృగ్విషయం.
- బఫర్ ద్రావణంలో H+ అయాన్ గాఢతను నియంత్రించడానికి కూడా ఉభయ సామాన్య అయాన్ సూత్రం వర్తిస్తుంది.
ప్రశ్న 6.
రసాయన సమతాస్థితి యొక్క అభిలక్షణాలను తెలపండి. [Mar’ 2010]
జవాబు:
- పురోగామి మరియు తిరోగామి చర్యలు రెండూ అవిచ్ఛిన్నంగా జరుగుతూనే ఉంటాయి.
- పురోగామి చర్యారేటు, తిరోగామి చర్యారేటుకు సమానంగా ఉంటుంది.
- పీడనం, గాఢత, సాంద్రత, రంగు మొదలైన ధర్మాలు, కాలంతోపాటు మార్పుచెందక, స్థిరంగా నిలిచి ఉంటాయి.
- రసాయనచర్యకు ఏదైనా ఉత్ప్రేరకాన్ని చేర్చినా, సమతాస్థితి స్థానం మారదు. అయితే, అది సమతాస్థితి త్వరగా చేరుకోవడానికి సహాయపడుతుంది.
- సమతాస్థితి అనునది, క్రియాజనకాల వైపు నుండి గాని లేక క్రియాజన్యాల వైపు నుండి గాని, అనగా, ఎటువైపు నుండిగాని ఏర్పడవచ్చు.
- క్రియాజనకాల లేదా క్రియాజన్యాల పీడనాలను లేదా గాఢతలను మార్చినట్లయితే, సమతాస్థితి స్థానం మారవచ్చు.
ప్రశ్న 7.
బ్రాన్టెస్టెడ్ – లౌరీ సిద్ధాంతమును ఉదాహరణలతో వివరించండి. [Mar’2010][TS 17,20]
జవాబు:
బ్రాన్టెస్టెడ్ – లౌరీ సిద్దాంతం [ప్రోటాన్ సిద్దాంతం] :
ఆమ్లం :
“ప్రోటాన్లను దానం చేసే ప్రవృత్తి ఉన్న పదార్ధాలను ఆమ్లాలు అంటారు”.
ఉదా : HCl, H2SO4, CH3COOH etc ——–
క్షారం :
“ప్రోటాన్లను స్వీకరించే ప్రవృత్తి ఉన్న పదార్థాలను క్షారాలు అంటారు”.
ఉదా : NH3, H2O, OH etc ——–
కావున “ప్రోటాన్ దాతను ఆమ్లం అనీ, ప్రోటాన్ స్వీకర్తను క్షారం” అని అంటారు.
ఆంఫోటెరిక్ పదార్ధం:
ప్రోటాన్ దాతగాను మరియు ప్రోటాన్ స్వీకర్తగాను పనిచేసే పదార్థాలను ఆంఫోటెరిక్ పదార్ధాలు అంటారు.
ఉదా : నీరు
తటస్థీకరణం:
ఆమ్ల – క్షార రసాయన చర్యలలో ఆమ్లం నుండి క్షారానికి ప్రోటాన్ మార్పిడి జరిగే విధానాన్ని తటస్థీకరణం అంటారు.
ఉదా: HCl + H2O ⇌ H2O+ + Cl–;
ఇక్కడ, HCl ప్రోటాన్ దానం చేస్తుంది, కావున ఇది బ్రాన్డ్ ఆమ్లం
H2O ప్రోటాన్ ను స్వీకరిస్తుంది, కావున ఇది బ్రాన్టెడ్ క్షారం
కాంజుగేట్ ఆమ్ల క్షారజంట :
సమతాస్థితిలో ఉన్న ఆమ్ల క్షార ద్విగత చర్యలలో రెండు ఆమ్లాలు మరియు రెండు క్షారాలు ఇమిడి ఉంటాయి. ఆమ్లం దాని క్షారం గాను మరియు క్షారం దాని ఆమ్లంగాను మారుతుంది.
ఒక ప్రోటాన్ భేదం మాత్రమే కలిగిన ఆమ్ల క్షారజంటను కాంజుగేట్ (సంయుగ్మం) ఆమ్ల క్షార జంట అంటారు.
ప్రశ్న 8.
లూయీ ఆమ్ల-క్షార సిద్ధాంతమును ఉదాహరణలతో వివరించండి. [TS 18]
జవాబు:
లూయీ ఆమ్ల క్షార సిద్ధాంతం :
లూయీ సిద్ధాంతంలో ఆమ్ల లేదా క్షార స్వభావాన్ని ఎలక్ట్రాన్ పరంగా వివరిస్తారు. ఈ సిద్ధాంతం ప్రకారం ఎలక్ట్రాన్ జంట స్వీకర్తను ఆమ్లం అనీ, మరియు ఎలక్ట్రాన్ జంట దాతను క్షారం అని అంటారు. లూయీ ఆమ్ల మరియు క్షారాల తటస్థీకరణం సమన్వయ సమయోజనీయబంధం ఏర్పడుట వలన జరుగుతుంది. లూయీ ఆమ్లాల రకాలు: లూయీ ఆమ్లాలు 5 రకాలు : అవి
a) అన్ని రకాల కాటయాన్ లు
ఉదా : Ag+, CO+3, Cu+2, Fe+3 etc.
b) కేంద్రక పరమాణువులో అసంపూర్ణ అష్టకం మరియు ఖాళీ ఆర్బిటాళ్ళు ఉన్న అణువులు
ఉదా : BF3, BCl3, AlCl3, FeCl3.
c) కేంద్రక పరమాణువులో ఖాళీ d-ఆర్బిటాళ్ళు ఉండి, దాని అష్టక నియమాన్ని విసృత్తిచేయగలిగిన సమ్మేళనాలు.
ఉదా: SiF4, SnCl4, SF4, TeF4.
d) వేరు వేరు ఋణ విద్యుదాత్మకత విలువలు కలిగిన పరమాణువుల మధ్య బహుబంధాలున్న అణువులు.
ఉదా : CO2, SO2, SO3, NO2
e) ఎలక్ట్రాన్ షష్టకం గల మూలకాలు
ఉదా : S, O.
లూయీ క్షారాలు :
లూయీ క్షారాలను 3 రకాలుగా విభజిస్తారు. అవి
a) అన్ని యానయాన్ లు ఉదా : Cl–, OH–, CN–, NH–2, F–, SCN–
b) కేంద్రక పరమాణువులో ఒకటి లేదా రెండు ఒంటరి ఎలక్ట్రాన్ జంటలున్న అణువులు.
![]()
c) బహుబంధాలున్న అణువులు CO, NO, HC ≡ CH, H2C = CH2.
తటస్థీకరణం : ఆమ్లం మరియు క్షారాల మధ్య సమన్వయ సమయోజనీయ బంధం ఏర్పడటం.
ప్రశ్న 9.
బఫర్ ద్రావణం అనగానేమి? ఆమ్ల బఫర్ పని చేయు విధానాన్ని తెలపండి.
జవాబు:
బఫర్ ద్రావణాలు :
స్థిరమైన pH విలువను కలిగి ఉండే ద్రావణాలను బఫర్ ద్రావణాలు అంటారు.
సరియైన విధి నిర్వహణకు రక్తానికి pH విలువ 7.35 ఉండాలి.
ద్రావణాన్ని విలీనం చేసినపుడు, లేదా కొద్దిగా బలమైన ఆమ్లాన్ని లేదా బలమైన క్షారాన్ని కలిపినపుడు pH లో మార్పును నిరోధించే ద్రావణాలను బఫర్ ద్రావణాలు అంటారు.
బఫర్ ద్రావణాల రకాలు :
- ఆమ్ల బఫర్ ద్రావణాలు
- క్షార బఫర్ ద్రావణాలు
1) ఆమ్ల బఫర్ ద్రావణాలు:
ఆమ్ల బఫర్లో ఒక బలహీన ఆమ్లం, బలమైన క్షారంతో దాని లవణం ఉంటాయి.
Ex: CH3COOH + CH3COONa, HCOOH + HCOOK, C6H5COOH + C6H5COONa.
ఆమ్ల బఫర్ పని చేయు విధానం:
a) బఫర్ ద్రావణం ఎసిటికామ్లం, సోడియం ఎసిటేట్లు కలది అనుకొందాం. దానికి కొన్ని చుక్కలు విలీన, బలమైన ఆమ్లం HCl కలిపినట్లయితే, HCl నుంచి వచ్చిన H+ అయాన్లు CH3COO– తో కలిపి విఘటితం కాని CH3COOH కింది చర్య ద్వారా ఏర్పడుతుంది.
CH3COO– + H– → CH3COOH
b) ఇప్పుడు కొన్ని చుక్కల విలీన, బలమైన క్షారం NaOH కలిపినట్లయితే, క్షారం నుంచి విడుదలయిన OH– అయాన్లు స్వేచ్ఛాస్థితిలో వున్న CH3COOH అయాన్లు ఏర్పడతాయి.
CH3COOH + OH– → CH3COO– + H2O.
కావున కొద్దిపాటి ఆమ్లం లేదా క్షారం కలిపితే బఫర్ ద్రావణం PH లో మార్పురాదు. ఆమ్లబఫర్ ద్రావణాలు PH ను హెండర్సన్ సమీకరణం ద్వారా లెక్కిస్తారు.
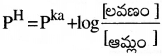
![]()
ప్రశ్న 10.
బఫర్ ద్రావణం అనగా నేమి? క్షార బఫర్ పనిచేయు విధానాన్ని తెలపండి.
జవాబు:
బఫర్ ద్రావణాలు:
స్థిరమైన pH విలువను కలిగి ఉండే ద్రావణాలను బఫర్ ద్రావణాలు అంటారు.
సరియైన విధి నిర్వహణకు రక్తానికి pH విలువ 7.35 ఉండాలి.
ద్రావణాన్ని విలీనం చేసినపుడు, లేదా కొద్దిగా బలమైన ఆమ్లాన్ని లేదా బలమైన క్షారాన్ని కలిపినపుడు pH లో మార్పును నిరోధించే ద్రావణాలను బఫర్ ద్రావణాలు అంటారు.
క్షారబఫర్ పనిచేయు విధానం :
a) బఫర్ ద్రావణం అమోనియం హైడ్రాక్సైడ్ మరియు అమోనియం క్లోరైడ్లు కలది అనుకుందాం. దానికి కొన్ని చుక్కలు విలీన, బలమైన ఆమ్లం HCl కలిపినట్లయితే, HCl నుండి వచ్చిన H+ అయాన్లు NH4OH తో కలిసి విఘటితం కాని నీరు ఏర్పడుతుంది.
NH4OH + H+ → NH+4 + H2O
b) ఇప్పుడు కొన్ని చుక్కల విలీన, బలమైన క్షారం NaOH కలిపినట్లయితే, క్షారం నుండి విడుదలయిన OH– అయాన్లు NH+4 తో చర్యజరిపి, విఘటితం కాని NH4OH ను ఏర్పరుస్తాయి.
NH+4 + OH– → NH4OH.
కావున కొద్దిపాటి ఆమ్లం లేదా క్షారం కలిపినపుడు బఫర్ ద్రావణం PH లో మార్పురాదు.
క్షారం ద్రావణం PH ను హెండర్సన్ సమీకరణం ద్వారా లెక్కిస్తారు.
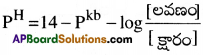
ప్రశ్న 11.
ద్రవ్యరాశి క్రియానియమమును వివరించండి. [TS 16]
జవాబు:
“ఒక స్థిర ఉష్ణోగ్రత వద్ద, ఏ క్షణం వద్ద అయినా, ఒక చర్యారేటు, ఆ క్షణం వద్ద ఉన్న క్రియాజనకాల మరియు క్రియాశీల ద్రవ్యరాశుల లబ్ధానికి అనులోమానుపాతంలో ఉంటుంది”.
వివరణ : xA + yB ⇌ mC + n అనే ద్విగత చర్యను తీసుకొందాం
పురోగామి చర్యారేటు rf α[A]x[B]y.
rf = kf[A]x[B]y ; kf = పురోగామిచర్యలో రేటు స్థిరాంకం
తిరోగామి చర్యారేటు rf α[C]m[D]

ప్రశ్న 12.
లవణ జలవిశ్లేషణ నిర్వచించి, ఈ క్రింది జలద్రావణాల స్వభావాలను వివరించుము. [TS 16][AP 17]
(a) NH4Cl [May’10] (b) CH3COONa (c) CH3COONH4
జవాబు:
లవణ జల విశ్లేషణ :
లవణం ఆనయాన్ లేదా కాటయాన్ లేదా రెండూ జల ద్రావణంలో నీటితో చర్య జరిపి OH– అయాన్లను లేదా H+అయాన్లను లేదా రెండింటిని అదనంగా ఏర్పరిచే దృగ్విషయాన్ని లవణ జల విశ్లేషణ అంటారు.
(a) NH4Cl:
బలమైన ఆమ్లం HCl బలహీన క్షారం NH4OH ల లవణం NH4Cl. ఇది అయనీకరణం చెంది NH4+ మరియు Cl– అయాన్లను ఏర్పరుచును.
NH4Cl → NH4+ + Cl–
బలహీన క్షారం యొక్క బలమైన కాంజుగేట్ ఆమ్లం NH4+. కావున ఇది నీటి అణువులతో చర్య చెంది H+ అయాన్లను ఏర్పరచును.
NH4+ + H2O ⇌ NH4OH + H+
NH4Cl జల ద్రావణం ఆమ్ల స్వభావం కలది కావున pH <7 ఇది కాటయాన్ జలవిశ్లేషణ.
(b) CH3COONa:
బలమైన క్షారం NaOH, బలహీన ఆమ్లం CH3COOH ల లవణమే CH3COONa CH3COONa అయనీకరణం చెంది CH3COO– మరియు Na+ అయాన్లను ఏర్పరుచును.
CH3COONa ⇌ CH3COO– + Na+
బలహీన ఆమ్లం CH, COOH యొక్క కాంజుగేట్ క్షారం CH3COO– కావున, ఇది నీటితో చర్య చెంది OH– అయాన్లను ఏర్పరుచును.
CH3COO– + H2O ⇌ CH3COOH + OH–
కావున సోడియం ఎసిటేట్ జలద్రావణం క్షార స్వభావం కల్గి ఉండును. దీని p” విలువ 7 కంటే ఎక్కువ. pH>7 ఇది యానయాన్ జలవిశ్లేషణ.
(c) CH3COONH4:
బలహీన ఆమ్లం CH3COOH మరియు బలహీన క్షారము NH4OH ల లవణమే CH3COONH4.
ఇది CH3COO– మరియు NH4+ అయానులుగా పూర్తిగా అయనీకరణం చెందును.
CH3COONH4 → CH3COO– + NH4+.
CH3COOH బలహీన ఆమ్లపు యొక్క కాంజుగేట్ క్షారం CH3COO బలహీన క్షారము NH3 యొక్క కాంజుగేట్ ఆమ్లంNH4+. కావున CH3COO– మరియు NH4+ అయానులు నీటితో చర్య చెంది క్రమముగా OH– మరియు H+ అయానులను ఏర్పరుచును.
CH3COO– + H2O ⇌ CH3COOH + OH–
NH4+ +H2O ⇌ NH4OH + H+
H+ + OH– → H2O
లవణం యొక్క కాటయాన్ మరియు ఆనయాన్ జలవిశ్లేషణ చెందును. కావున అమ్మోనియం ఎసిటేట్ జలద్రావణపు స్వభావం తటస్థం (pH = 7)
ప్రశ్న 13.
నీటి అయానిక అనగానేమి?రసాయన చర్యలలోను మరియు గుణాత్మక విశ్లేషణలోనూ దాని ప్రాముఖ్యత ఏమిటి?
జవాబు:
నీటి అయానిక లబ్దం:
శుద్ధ నీరు లేదా జలద్రావణంలో [H*] మరియు [OH] అయాన్ల గాఢతల లబ్ధాన్ని నీటి అయానిక లబ్దం అంటారు.దీనిని ‘Kw‘ తో సూచిస్తారు.
1. శుద్ధ నీరు కొంత మేరకు H+ మరియు OH– లుగా అయనీకరణం చెందుతుంది. H2O ⇌ H+ + OH–
2. ద్రవ్యరాశి చర్యతా నియమం నుండి, సమతాస్థితి స్థిరాంకం
![]()
H2O యొక్క అయనీకరణం పరిగణించదగినంత పెద్దది కాదు, కావున [H2O] ను స్థిరాంకంగా తీసుకుంటాము.
కావున, Kw = [H+][OH–]. ఈ స్థిరాంకం ‘Kw‘ ని నీటి అయానిక లబ్దం అంటారు.
3. 25°C ఉష్ణోగ్రత వద్ద Kw విలువ 1.0 × 10-14 మోల్²/లీటర్².
4. ఉష్ణోగ్రత పెరిగిన కొలది నీటి అయనీకరణం పెరుగును. కావున Kw పెరుగును.
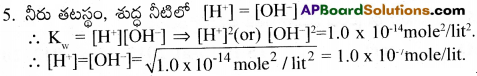
ప్రాముఖ్యత :
H+ మరియు OH ల గాఢతలు లెక్కించుటకు Kw ఉపయోగపడుతుంది.
జల విశ్లేషణ స్థిరాంకం, Kh విలువలను లెక్కించుటకు ఉపయోగపడుతుంది.
ద్రావణాలు మరియు బఫర్ ద్రావణాల pH ను లెక్కించుటకు ఉపయోగపడుతుంది.
![]()
ప్రశ్న 14.
లీచాట్లెయర్ సూత్రంను వివరించి దానిని ఈ క్రింది సమతాస్థితికి అనువర్తించండి. [AP 16, 18,19,22] [TS 15,1167]
N2(g) + 3H2(g) ⇌ 2NH3(g)
(or)
లీచాట్లెయర్ సూత్రమును వివరించి, దానిని హెబర్ పద్ధతిలో అమ్మోనియం పారిశ్రామిక సంశ్లేషణకు ఎలా ఉపయోగిస్తారో తెలుపుము.
జవాబు:
లీచాట్ లియర్ సూత్రము :
సమతాస్థితి వద్ద ఉండే ఒక ద్విగత రసాయన చర్యయొక్క సమతా స్థితిని ప్రభావితం చేసే ఉష్ణోగ్రత, పీడనం లేదా గాఢతలను మార్పులకు గురి చేస్తే, ఈ మార్పు ప్రభావాన్ని తగ్గించే లేదా రద్దు చేసే వైపుకు, సమతాస్థితి మారుతుంది.
సమతాస్థితిని ప్రభావితం చేసే అంశాలు:
ఉష్ణోగ్రత ప్రభావం :
ఏదైనా ద్విగత చర్యలో
- పురోగామి చర్య అనేది ఉష్ణమోచక చర్య అయితే తిరోగామి చర్య ఉష్ణగ్రాహక చర్య అగును.
- పురోగామి చర్య అనేది ఉష్ణగ్రాహక చర్య అయితే తిరోగామి చర్య ఉష్ణమోచక చర్య అగును.
- ఉష్ణోగ్రత లోని పెరుగుదల, ఉష్ణగ్రాహక చర్యలకు అనుకూలంగా ఉంటాయి.
- ఉష్ణోగ్రత లోని తగ్గుదల, ఉష్ణమోచక చర్యలకు అనుకూలంగా ఉంటాయి.
పీడనం ప్రభావం :
సమతాస్థితి వద్ద ఉండే వ్యవస్థపై పీడనాన్ని పెంచితే, చర్యలో అణువుల సంఖ్య తగ్గే దిశ వైపుకు (ఘనపరిమాణం తగ్గే దిశవైపుకు లేదా పెరుగుదల ప్రభావం రద్దు అయ్యే దిశవైపుకు) సమతాస్థితి స్థానం జరుగుతుంది.
క్రియాజనకాల లేదా క్రియాజన్యాల గాఢతల ప్రభావం:
క్రియాజనకాల గాఢతను పెంచితే, చర్య యొక్క సమతాస్థితి స్థానం, క్రియాజన్యాల వైపుగా జరుగుతుంది. (క్రియాజనకాలు → క్రియాజన్యాలు)
క్రియాజన్యాల గాఢతను పెంచితే, చర్య యొక్క సమతాస్థితి స్థానం, క్రియాజనకాల వైపుగా జరుగుతుంది. (క్రియాజన్యాలు → క్రియాజనకాలు)
ఉత్ప్రేరకాల ప్రభావం :
ద్విగతచర్యలో, ఉత్ప్రేరకం, పురోగామి మరియు తిరోగామి చర్యల వేగాన్ని ఒకే రీతిలో పెంచుతుంది.
హేబర్ పద్ధతిలో అమోనియా పారిశ్రామిక సంశ్లేషణం :
నైట్రోజన్ మరియు హైడ్రోజన్లు కలిసి, అమోనియాను ఏర్పరుచును. ఈ చర్య, ద్విగత మరియు ఉష్ణమోచక చర్య.
N2(g) + 3H2(g) ⇌ 2NH3(g) ∆H = -92.3 KJ.
ఉష్ణోగ్రతా ప్రభావం:
అమోనియా తయారి ఒక ఉష్ణమోచక చర్య. అందువలన లీచాట్లెయర్ సూత్రం ప్రకారం అల్ప ఉష్ణోగ్రతలు, NH3 మరింతగా ఏర్పడే చర్యను ప్రోత్సహిస్తాయి. కాని అల్ప ఉష్ణోగ్రతలు N2 మరియు H2ల మధ్య చర్యావేగాన్ని బాగా తగ్గించును. కావున అందుకు తగిన ఉష్ణోగ్రత (725-775 K )ను ఎంచుకొంటారు. చర్యావేగాన్ని పెంచుటకు ఐరను ఉత్ప్రేరకంగాను మాలిబ్దినంను ప్రవర్ధకముగా ఉపయోగిస్తారు.
పీడనం యొక్క ప్రభావం: N2(g) + 3H2(g) ⇌ 2NH3(g)
ఇందులో క్రియాజనకాలలోని అణువుల సంఖ్య = 4,
క్రియాజన్యాలలోని అణువుల సంఖ్య = 2
లీచాట్లెయర్ సూత్రం ప్రకారం, అణువుల సంఖ్య తగ్గే దిశవైపు అమోనియా ఏర్పడును. కావున అధిక పీడనాలు, NH3 మరింత ఎక్కువగా ఏర్పడే చర్యను ప్రోత్సహించును. కావున 200-300 అట్మాస్పియర్ల, అనువైన పీడనాన్ని ఉపయోగిస్తారు.
అనువైన పరిస్థితులు :
గాఢత : అధిక గాఢతతో కూడిన స్వచ్ఛమైన N2 మరియు H2 ల మిశ్రమం.
ఉష్ణోగ్రత : 725-775 K
పీడనం: 200-300 అట్మాస్పియర్
ఉత్ప్రేరకం : సన్నని ఇనుపరజను
ప్రవర్ధకం : Mo
ప్రశ్న 15.
లీచాట్లెయర్ సూత్రంను వివరించి దానిని ఈ క్రింది సమతాస్థితికి అనువర్తించండి. [TS 18][Mar 2012, May 2012, 2010]
2SO2(g) + O2(g) ⇌ 2SO3(g) (or)
లీచాట్లెయర్ సూత్రమును వివరించి, దానిని కాంటాక్టు పద్ధతిలో ఎలా ఉపయోగిస్తారో వివరించుము.
జవాబు:
లీచాట్ లియర్ సూత్రము :
సమతాస్థితి వద్ద ఉండే ఒక ద్విగత రసాయన చర్యయొక్క సమతా స్థితిని ప్రభావితం చేసే ఉష్ణోగ్రత, పీడనం లేదా గాఢతలను మార్పులకు గురి చేస్తే, ఈ మార్పు ప్రభావాన్ని తగ్గించే లేదా రద్దు చేసే వైపుకు, సమతాస్థితి మారుతుంది.
సమతాస్థితిని ప్రభావితం చేసే అంశాలు :
ఉష్ణోగ్రత ప్రభావం : ఏదైనా ద్విగత చర్యలో
- పురోగామి చర్య అనేది ఉష్ణమోచక చర్య అయితే తిరోగామి చర్య ఉష్ణగ్రాహక చర్య అగును.
- పురోగామి చర్య అనేది ఉష్ణగ్రాహక చర్య అయితే తిరోగామి చర్య ఉష్ణమోచక చర్య అగును.
- ఉష్ణోగ్రత లోని పెరుగుదల, ఉష్ణగ్రాహక చర్యలకు అనుకూలంగా ఉంటాయి.
- ఉష్ణోగ్రత లోని తగ్గుదల, ఉష్ణమోచక చర్యలకు అనుకూలంగా ఉంటాయి.
పీడనం ప్రభావం :
సమతాస్థితి వద్ద ఉండే వ్యవస్థపై పీడనాన్ని పెంచితే, చర్యలో అణువుల సంఖ్య తగ్గే దిశ వైపుకు (ఘనపరిమాణం తగ్గే దిశవైపుకు లేదా పెరుగుదల ప్రభావం రద్దు అయ్యే దిశవైపుకు) సమతాస్థితి స్థానం జరుగుతుంది.
క్రియాజనకాల లేదా క్రియాజన్యాల గాఢతల ప్రభావం:
క్రియాజనకాల గాఢతను పెంచితే, చర్య యొక్క సమతాస్థితి స్థానం, క్రియాజన్యాల వైపుగా జరుగుతుంది. (క్రియాజనకాలు → క్రియాజన్యాలు)
క్రియాజన్యాల గాఢతను పెంచితే, చర్య యొక్క సమతాస్థితి స్థానం, క్రియాజనకాల వైపుగా జరుగుతుంది. (క్రియాజన్యాలు → క్రియాజనకాలు)
ఉత్ప్రేరకాల ప్రభావం :
ద్విగత చర్యలో, ఉత్ప్రేరకం, పురోగామి మరియు తిరోగామి చర్యల వేగాన్ని ఒకే రీతిలో పెంచుతుంది.
కాంటాక్టు పద్ధతిలో SO3 సంశ్లేషణం :
సల్ఫర్ డై ఆక్సైడ్ మరియు ఆక్సిజన్లు కలిసి SO3 ఏర్పరచును ఈ చర్య ద్విగత మరియు ఉష్ణమోచక చర్య.
2SO2(g) + O2(g) ⇌ 2SO3(g), ΔΗ = -189.0KJ
ఉష్ణోగ్రతా ప్రభావం:
SO3 తయారి ఒక ఉష్ణమోచక చర్య. అందువలన లీచాట్లెయర్ సూత్రం ప్రకారం అల్ప ఉష్ణోగ్రతలు, SO3 మరింతగా ఏర్పడే చర్యను ప్రోత్సహిస్తాయి. కాని అల్ప ఉష్ణోగ్రతలు SO2 మరియు O2ల మధ్య చర్యావేగాన్ని బాగా తగ్గించును. కావున అందుకు తగిన ఉష్ణోగ్రత(673 K )ను ఎంచుకొంటారు. చర్యావేగాన్ని పెంచుటకు V2O5 ప్రవర్ధకంగా లేదా ప్లాటినైజెడ్ ఎజెస్టాజ్ ను ఉత్ప్రేరకంగా ఉపయోగిస్తారు.
పీడనం యొక్క ప్రభావం: 2SO2(g) + O2(g) ⇌ 2SO3(g)
క్రియాజనకాలలోని అణువుల సంఖ్య = 2 + 1 = 3, క్రియాజన్యాలలోని అణువుల సంఖ్య = 2
కావున లీచాట్లెయర్ సూత్రం ప్రకారం, అణువుల సంఖ్య తగ్గే దిశవైపు SO, ఏర్పడును. కావున అధిక పీడనాలు, SO3 మరింత ఎక్కువగా ఏర్పడే చర్యను ప్రోత్సహించును. కావున 1.5 నుండి 1.7 అట్మాస్పియర్ల పీడనాన్ని ఉపయోగిస్తారు.
అనువైన పరిస్థితులు :
గాఢత : అధిక గాఢతతో కూడిన స్వచ్ఛమైన SO2 మరియు O2 ల మిశ్రమం.
ఉష్ణోగ్రత : 673 K
పీడనం : 1.5-1.7 అట్మాస్పియర్
ఉత్ప్రేరకం : ప్లాటినైజెడ్ ఎజ్బెస్టాజ్
ప్రవర్ధకం : V2O5
Textual Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
కింది చర్యలు ప్రతీదానికి సమతాస్థితి స్థిరాంకం Kcకు సమీకరణాలు రాయండి.
జవాబు:

ప్రశ్న 2.
HI విఘటనం చర్య పై అనువర్తిత పీడనం ఎటువంటి ప్రభావం చూపదు. అయితే PCl5 విఘటనం పై ప్రభావం చూపుతుంది? వివరించండి.
జవాబు:
HI విఘటనం చర్య : 2HI(g) ⇌ H2(g) + I2(g)
np = nR.
∴ కావున పీడన ప్రభావం లేదు.
PCl5 : PCl5(g) ⇌ PCl3(g) + Cl2(g)
np ≠ nR.
∴ కావున పీడన ప్రభావం కలదు.
![]()
ప్రశ్న 3.
తగిన సమీకరణాలతో కింది వాటిలో ప్రతీ జాతి బ్రాన్టెస్టెడ్ క్షారంగా ప్రవర్తిస్తుంది అని తెలపండి?
(a) H2O (b) OH– (c) C2H5OH (d) HPO4-2
జవాబు:
(a) H2O + H+ → H3O+
ప్రోటాన్ గ్రహీత కావున బ్రాన్డ్ క్షారము.
(b) OH– + H+ → H2O
ప్రోటాన్ గ్రహీత కావున బ్రాన్డ్ క్షారము.
(c) C2H5OH ఇది ప్రోటాన్ దాత
కావున బ్రాన్డెడ్ ఆమ్లమే కానీ క్షారము కాదు.
(d) HPO4-2 + H+ → H2PO4
ప్రోటాన్ గ్రహీత కావున బ్రాన్డ్ క్షారము.
ప్రశ్న 4.
AlCl3, NH3, Mg+2, H2O లను లూయీ ఆమ్లాల, లూయీ క్షారాలుగా వర్గీకరించండి. జవాబును సమర్థించండి.
జవాబు:
AlCl3:
దీనిలో ఖాళీ 3p ఆర్బిటాల్ ఉండుటచే ఎలక్ట్రాన్ జంటను స్వీకరించును. కావున ఇది లూయీ ఆమ్లం.
NH3:
దీనిలో నైట్రోజన్ పై ఒక ఒంటరి ఎలక్ట్రాన్ జంట కలిగి ఉన్న కారణంగా ఎలక్ట్రాన్ జంటను దానం చేయును. కావున ఇది లూయీ క్షారం.
Mg+2:
దీనిలో ఖాళీ ఆర్బిటాల్ ఉండుటచే ఎలక్ట్రాన్ జంటను స్వీకరించును. కావున ఇది లూయీ ఆమ్లం.
H2O :
దీనిలో ఆక్సిజన్ పై రెండు ఒంటరి ఎలక్ట్రాన్ జంటలు కలిగి ఉన్న కారణంగా ఎలక్ట్రాన్ జంటలను దానం చేయును. కావున ఇది లూయీ క్షారం.
ప్రశ్న 5.
“ద్రావణీయతా లబ్దం” దీనిని నిర్వచించండి. కింది వాటికి ద్రావణీయతా సమీకరణాలను రాయండి.
(i) Ag2Cr2O7 (ii) Zr3(PO4)4.
జవాబు:
“గది ఉష్ణోగ్రత వద్ద ఒక లవణం సంతృప్త ద్రావణంలో కాటయాన్ల గాఢతకు మరియు ఆనయాన్ గాఢతకు మధ్యగల లబ్దమును ఆ లవణం యొక్క ద్రావణీయతా లబ్దం (Ksp). అంటారు.
(i) Ag2Cr2O7, యొక్క ద్రావణీయతా లబ్దం Ksp = [Ag+][Cr2O7]
(ii) Zr3(PO4)4 యొక్క ద్రావణీయతా లబ్దం Ksp = [Zr+4]³[PO-34]4
ప్రశ్న 6.
సమతాస్థితి స్థిరాంకం అనగానేమి? దాని అభిలక్షణాలు తెల్పండి.
జవాబు:
సమతాస్థితి స్థిరాంకం :
“ఇచ్చిన ఉష్ణోగ్రత వద్ద, క్రియాజన్యాల సమతాస్థితి గాఢతల లబ్ధం మరియు క్రియాజనకాల సమతాస్థితి గాఢతల లబ్ధము నకు గల నిష్పత్తిని ‘సమతాస్థితి స్థిరాంకము’ అంటారు.”
అభిలక్షణాలు :
- ఇచ్చిన ఉష్ణోగ్రత వద్ద సమతాస్థితి స్థిరాంకము విలువ స్థిరంగా ఉండును.,
- స్థిర ఉష్ణోగ్రత వద్ద సమతాస్థితి స్థిరాంకము విలువ క్రియాజనకాల, క్రియాజన్యాల గాఢతల మీద ఆధారపడదు.
- సమతాస్థితి స్థిరాంకము విలువ, ఉష్ణోగ్రతలతో పాటు మారును.
- సమతాస్థితి స్థిరాంకము విలువ, ఉత్ప్రేరకాల వలన మార్పు చెందదు.
ప్రశ్న 7.
రసాయన విశ్లేషణలో ద్రావణీయతా లబ్ధం యొక్క అనువర్తనాలు తెలుపండి.
జవాబు:
1. [Cu+2][S-2] ల లబ్ధం, రసాయన విశ్లేషణలో, II గ్రూపులో, (ఆమ్ల సమక్షంలో)CuS ద్రావణీయతా లబ్ధం విలువను అధిగమిస్తుంది. కావున CuS అవక్షేపణం చెందుతుంది. ఇదే సూత్రం, గ్రూపులో మిగిలిన అయాన్లు Cd2+, Bi3+, Hg2+, Sb2+ లకు వర్తిస్తుంది.
2. గ్రూపు IV రసాయన విశ్లేషణలో, అమోనికల్ యానకం సమక్షంలో [Zn2+][S2-]ల లబ్ధం ZnS యొక్క Kspవిలువను అధిగమిస్తుంది. కాబట్టి ZnS అవక్షేపణం చెందుతుంది. ఇదే సూత్రం Mn2+, Ni2+ లకు కూడా వర్తిస్తుంది.
ప్రశ్న 8.
భౌతిక ప్రక్రియలలోని సమతాస్థితుల సాధారణ అభిలాక్షణిక ధర్మాలను తెలపండి.?
జవాబు:
భౌతిక ప్రక్రియలలోని సమతాస్థితుల సాధారణ అభిలాక్షణిక ధర్మాలు:
- నిర్దిష్ట ఉష్ణోగ్రత వద్ద సంవృత(మూసి ఉన్న) వ్యవస్థలలో మాత్రమే సమతాస్థితి ఏర్పడుతుంది.
- పరస్పరం వ్యతిరేకించే రెండు చర్యలు (పురోగామి, తిరోగామి చర్యలు) ఒకే వేగంతో జరుగుతాయి. కాబట్టి గతిక సమతాస్థితి చోటు చేసుకొంటుంది. అయితే స్థిర పరిస్థితి కొనసాగుతుంది.
- వ్యవస్థ కొలవడానికి వీలుండే అన్ని ధర్మాలు స్థిరంగా ఉంటాయి.
- ఒక భౌతిక ప్రక్రియ సమతాస్థితిని చేరుకొన్న సందర్భంలో స్థిర ఉష్ణోగ్రత వద్ద దాని పరామితులలో ఒకదాని విలువ స్థిరంగా ఉండే అభిలాక్షణిక స్వభావం ఈ ప్రక్రియ కలిగి ఉంటుంది.
- సమతాస్థితిని చేరుకొనకముందుగా భౌతిక ప్రక్రియ ఎంత విస్తృతికి జరిగింది అనే విషయాన్ని ఈ పరామితుల పరిమాణాలు సూచిస్తాయి.
![]()
ప్రశ్న 9.
2H2(g) + CO(g) ⇌ CH3OH(g) చర్య సమతాస్థితిపై కింది వాటి ప్రభావాన్ని తెలపండి.
(a) H2 సంకలనం (b) CH3OH సంకలనం (c) CO తొలగింపు (d) CH3OH తొలగింపు
జవాబు:
- క్రియా జనకాల (H2) గాఢతను పెంచినపుడు పురోగామి చర్య జరుగును.
- క్రియా జన్యాల (CH3OH) గాఢతను పెంచినపుడు తిరోగామి చర్య జరుగును.
- క్రియా జనకాలు గాఢతను తగ్గించినపుడు లేదా CO ను తొలగించినపుడు తిరోగామి చర్య జరుగును.
- క్రియా జన్యాల గాఢతను తగ్గించినపుడు లేదా CH3OH ను తొలగించినపుడు పురోగామి చర్య జరుగును.
ప్రశ్న 10.
దుర్భల ఆమ్లాలు, క్షారాలకు సంబంధించిన అయనీకరణ అవధిని గురించి తెలుపండి. అయనీకరణ అవధి(α), HX అయనీకరణ స్థిరాంకం (Ka) వీటి మధ్య గల సంబంధాన్ని ఉత్పాదించండి.
జవాబు:
అయనీకరణ అవధి(α):
అయనీకరణం చెందిన పదార్థపు మోలుల సంఖ్య, పదార్థపు మొత్తం మోలుల సంఖ్యల నిష్పత్తిని అయనీకరణ అవధి (α) అంటారు.

ప్రశ్న 11.
ద్రావణీయత లబ్దం అనగా నేమి? అయానిక లవణాల ద్రావణీయతపై ఉభయ సామాన్య అయాన్ ప్రభావం వివరించండి.
జవాబు:
ద్రావణీయతా లబ్దం (S) :
గది ఉష్ణోగ్రత వద్ద, ఒక లవణం సంతృప్త ద్రావణంలో కాటయాన్ల గాఢతకు, ఆనయాన్ల గాఢతకు మధ్యగల లబ్ధాన్ని, లవణం ద్రావణీయతా లబ్దం అంటారు.

ప్రాముఖ్యత :
ఏ లవణంలోనైనా [Mn+], [An-] అయాన్ల లబ్దం, లవణం ద్రావణీయతాలబ్దం విలువ(Ksp) కంటే అధికంగా ఉంటే, ఆ ద్రావణంలో లవణం అవక్షేపం చెందుతుంది.
ప్రశ్న 12.
లవణ విశ్లేషణను నిర్వచించి, వివరించండి.
జవాబు:
లవణ విశ్లేషణం :
ఆమ్లం మరియు క్షారాల చర్యలను తటస్థీకరణ చర్యలు అంటారు. ఈ చర్యలో లవణాలు ఏర్పడతాయి. తటస్థీకరణకు వ్యతిరేక చర్యయే లవణ జలవిశ్లేషణ.
“జలద్రావణాలలో ఆనయాన్ లేదా కాటయాన్ లేదా రెండూ నీటితో చర్య జరిపి, OH– అయాన్లు (క్షార స్వభావం) లేదా H+ అయాన్లను (ఆమ్ల స్వభావం) ఏర్పరిచే ప్రక్రియను లవణ జలవిశ్లేషణ అంటారు.
కాటయాన్ నీటితో చర్య జరిపినపుడు ద్రావణంలో H+ అయాన్లు ఉంటాయి. కావున ద్రావణం ఆమ్ల స్వభావాన్ని కలిగి ఉంటుంది. దీనిని కాటయాన్ జలవిశ్లేషణ అంటారు. ఈ ద్రావణం pH విలువ 7 కన్నా తక్కువ.
![]()
వివరణ :
1) కాటయాన్ నీటితో చర్య జరిపినపుడు, H+ అయాన్లు ఏర్పడతాయి. కావున ద్రావణం ఆమ్ల స్వభావంలో ఉంటుంది. దీనిని కాటయాన్ జలవిశ్లేషణ అంటారు. ఈ ద్రావణం pH < 7.
M+ + H2O → MOH + H+
ఉదా : NH4Cl, CuSO4 etc. (బలమైన ఆమ్లం – బలహీన క్షారాల లవణం)
2) ఆనయాన్ నీటితో చర్య జరిపినపుడు, OH– అయాన్లు ఏర్పడతాయి. దీనిని ఆనయాన్ జలవిశ్లేషణ అంటారు. ఈ ద్రావణం క్షార స్వభావంలో ఉంటుంది. దీని PH > 7.
A– + H2O → HA + OH–.
ఉదా : CH3COONa, Na2CO3 etc. (బలమైన క్షారం – బలమైన ఆమ్లాల లవణాలు)
3) కాటయాన్ మరియు ఆనయాన్ రెండూ నీటితో చర్య జరిపినపుడు, బలహీన ఆమ్లం మరియు బలహీన క్షారం ఏర్పడతాయి. ఇది తటస్థ జలవిశ్లేషణ మరియు pH = 7.
ఉదా : CH3COONH4, (NH4)4CO3 etc. (బలహీన క్షారం – బలహీన ఆమ్లాల లవణాలు)
ప్రశ్న 13.
PH ను నిర్వచించి దాని ప్రాముఖ్యతను తెలపండి. [IPE ‘09,14]
జవాబు:
pH :
ఒక ద్రావణంలో ఉన్న హైడ్రోజన్ అయాన్ [H+] గాఢత సంవర్గమానం ఋణాత్మక విలువను ఆ ద్రావణం PH అంటారు.
ప్రాముఖ్యత :
- ఆమ్ల, క్షార మరియు తటస్థ ద్రావణాలను విభజించడానికి PH ఉపయోగపడుతుంది.
- కొన్ని జీవ మరియు కాస్మోటిక్ అనువర్తనాలలో, ద్రావణాల PH ను నిర్ధారించుట ఆవశ్యకం.
- జలద్రావణంలో ముఖ్యమైన ప్రమాణం pka (=pH +pOH). ఇది హైడ్రోజన్ అయాన్ మరియు హైడ్రాక్సిల్ అయాన్ల సాపేక్ష గాఢతలను నియంత్రిస్తుంది.
![]()
ప్రశ్న 14.
లీచాట్లెయర్ సూత్రాన్ని తెలపండి.
జవాబు:
లీచాట్ లియర్ సూత్రము :
సమతాస్థితి వద్ద ఉండే ఒక ద్విగత రసాయన చర్యయొక్క సమతా స్థితిని ప్రభావితం చేసే ఉష్ణోగ్రత, పీడనం లేదా గాఢతలను మార్పులకు గురి చేస్తే, ఈ మార్పు ప్రభావాన్ని తగ్గించే లేదా రద్దు చేసే వైపుకు, సమతాస్థితి మారుతుంది.
ప్రశ్న 15.
ద్రవ్యరాశి క్రియానియమం తెలపండి.
జవాబు:
ద్రవ్యరాశి క్రియానియమం :
“ఒక స్థిర ఉష్ణోగ్రత వద్ద, ఏ క్షణం వద్ద అయినా, ఒక చర్యారేటు, ఆ క్షణం వద్ద ఉన్న క్రియాజనకాల మరియు క్రియాశీల ద్రవ్యరాశుల లబ్దానికి అనులోమానుపాతంలో ఉంటుంది”.
ప్రశ్న 16.
గతిక సమతాస్థితి స్వభావం గురించి వివరించండి.
జవాబు:
- సమతాస్థితి వద్ద కూడా రసాయన చర్యలు ఆగిపోవు.
- పురోగామి మరియు తిరోగామి చర్యలు రెండూ కొనసాగుతూనే ఉంటాయి.
- క్రియాజనకాలు మరియు క్రియాజన్యాల గాఢతలు, కాలంతో పాటు మారకుండా ఉంటాయి.
- రంగు, సాంద్రత వంటి భౌతికరాశులలో ఎటువంటి మార్పు ఉండదు. పురోగామి చర్య మరియు తిరోగామి చర్య, రెండూ ఒకే రేటుతో కొనసాగును. కావున ఈ సమతాస్థితిని గతిక సమతాస్థితి అంటారు.
ప్రశ్న 17.
సంయుగ్మ ఆమ్ల క్షార జంట అనగా నేమి? ఉదాహరణ తెలపండి. [IPE ’14][AP 16]
జవాబు:
ఒక ప్రోటాన్ మాత్రమే తేడాగల బ్రాన్ స్టెడ్ ఆమ్ల క్షార జంటను కాంజుగేట్ ఆమ్ల క్షార జంట అంటారు.
ఉదా : NH3 +H2O ⇌ NH+4 + OH–
పై చర్యలో NH3 మరియు NH+4 లు కాంజుగేట్ ఆమ్ల క్షార జంట మరియు H2O మరియు OH– మరియొక జంట.
ప్రశ్న 18.
నీటి అయానిక లబ్దాన్ని నిర్వచించండి. [TS 17]
జవాబు:
స్థిర ఉష్ణోగ్రత వద్ద శుద్ధజలంలో లేదా జలద్రావణాలలో హైడ్రోజన్ [H+], హైడ్రాక్సిల్ OH– అయాన్ల గాఢతల లబ్ధాన్ని నీటి అయానిక
అంటారు.
25°C వద్ద Kw విలువ Kw = 1.0 × 10-14 mole²/lit².
ఉష్ణోగ్రత పెరుగుదలతో పాటు Kw విలువ కూడా పెరుగుతుంది.
ప్రశ్న 19.
లవణ జలవిశ్లేషణ అనగా నేమి? NH4Cl జలద్రావణం యొక్క స్వభావం ఏమిటి? [May ’10]
జవాబు:
ఆమ్లం మరియు క్షారాల చర్యలను తటస్థీకరణ చర్యలు అంటారు. ఈ చర్యలో లవణాలు ఏర్పడతాయి. తటస్థీకరణకు వ్యతిరేక చర్యయే లవణ జలవిశ్లేషణ.
NH4Cl ఒక బలమైన ఆమ్లం బలహీనక్షారంల లవణం ఇది కాటయాన్ జలవిశ్లేషణలో పాల్గొనటం వలన ద్రావణంలో అధిక H+ అయాన్లు ఏర్పడతాయి.
NH+4 + H2O → NH4OH + H+.
కావున NH4Cl లవణ జలద్రావణం ఆమ్ల స్వభావం కలిగి ఉంటుంది. దీని PH < 7.
ప్రశ్న 20.
500K వద్ద సమతా స్థితి ఉన్న N2, H2 ల ద్వారా NH3 ను ఏర్పరిచే చర్యకు కింద సూచించిన గాఢతలున్నాయి. [N2] = 1.5 × 10-2M. [H2] = 3.0 × 10-2M [NH3] = 1.2 × 10-2M. దీని సమతాస్థితి స్థిరాంకాన్ని లెక్కించండి.
సాధన:
N2(g) + 3H2(g) ⇌ 2NH3(g) చర్యకు, సమతాస్థితి స్థిరాంకాన్ని కింద చూపిన విధంగా రాస్తాం.
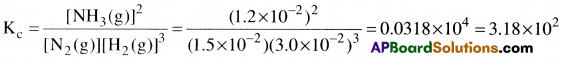
ప్రశ్న 21.
800K వద్ద సీలు చేసిన పాత్రలో సమతాస్థితి వద్ద గాఢతలు కింది విధంగా ఉన్నాయి. N2 = 3.0 × 10-3M. O2 = 4.2 × 10-3M, NO 2.8 × 10-3M కింది చర్యకు Kc విలువ ఎంత?
N2(g) + O2(g) ⇌ 2NO(g)
సాధన:
చర్యకు సమతాస్థితి స్థిరాంకాన్ని కింద చూపిన విధంగా రాయవచ్చు.
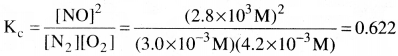
ప్రశ్న 22.
500 K వద్ద PCl5, PCl3, Cl2 లు సమతాస్థితిలో ఉన్నాయి. వీటి గాఢతలు వరసగా 1.59M PCl3, 1.59 M Cl2 , 1.41 M PCl5. చర్య PCl5 ⇌ PCl3 + Cl2 Kc ను లెక్కించండి.
సాధన:
చర్యకు సమతాస్థితి స్థిరాంకం Kcను కింది విధంగా రాస్తాం.
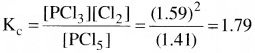
ప్రశ్న 23.
2NOCl(g) ⇌ 2NO(g) + Cl2(g) సమతాస్థితి చర్యకు, సమతాస్థితి స్థిరాంకం Kc విలువ 1069 K వద్ద 3.75 × 10-6 అయిన ఈ ఉష్ణోగ్రత వద్ద ఈ చర్యకు Kp విలువ లెక్కించండి.
సాధన:
Kp = Kc (RT)∆n అని మనకు తెలుసు.
∆n = (2 + 1) − 2 = 1
Kp = 3.75 × 10-6 (0.0831 × 1069) = 0.033
![]()
ప్రశ్న 24.
CO2(g) + C(s) ⇌ 2CO(g) Kp విలువ 1000 K వద్ద 3.0. ఆరంభంలో PCO2 = 0.48 bar PCO = 0 bar శుద్ధ గ్రాఫైటు ఉన్నట్లైతే సమతాస్థితి CO, CO2 ల పాక్షిక పీడనాలను లెక్కించండి.
సాధన:
ఈ చర్యకు CO2 పీడనంలో మార్పు ‘x’ అనుకొందాం. అపుడు

వర్గ సమీకరణమును సాధించగా x = 0.33
సమతాస్థితి పాక్షిక పీడనాలు, pCO = 2x = 2 × 0.33 = 0.66 బార్
ప్రశ్న 25.
2A ⇌ B + C చర్యకు K విలువ 2 × 10-3. ఒక నిర్దేశిత కాలం వద్ద చర్యా మిశ్రమంలో [A]=[B]=[C]= 3 × 10-4 M, ఏ దిశలో చర్య పురోగమిస్తుంది?
సాధన:

అంటే Qc > Kc కాబట్టి చర్య తిరోగామి దిశగా ప్రయాణిస్తుంది.
ప్రశ్న 26.
1L ఘనపరిమాణం గల మూసిన చర్యా పాత్రలో 3.00 మోల్ల PCl5ను 380 K వద్ద ఉంచి, అది సమతాస్థితిని చేరుకొనేటట్లు చేయబడింది. సమతాస్థితి వద్ద చర్యా మిశ్రమం సంఘటనాన్ని లెక్కించండి. Kc = 1.80.
సాధన:

ప్రశ్న 27.
గ్లైకోలిసిస్ చర్యలో గ్లూకోజ్ ఫాస్ఫారిలేషన్ చర్యకు ∆G0 విలువ 13.8 KJ/mol. 298K వద్ద దీని Kc విలువ ఎంత.
సాధన:
∆G0 = 13.8 KJ/mol = 13.8 × 10³ J/mol
Also ∆G0 – RT In Kc
కాబట్టి In Kc = 13.8 × 10³ J/mol (8.314 J/mol-1 K-1 × 298 K)
In Kc = -5.569 Kc = e-5.569 Kc = 3.81 × 10-3
ప్రశ్న 28.
సుక్రోజ్ జలవిశ్లేషణాన్ని కింది సమీకరణం సూచిస్తుంది. సుక్రోజ్+H2O ⇌ గ్లూకోజ్ + ఫ్రక్టోస్ చర్యకు సమతాస్థితి స్థిరాంకం Kc విలువ 300K వద్ద 2 × 1013 300 K వద్ద ∆G0 విలువ ఎంత?
సాధన:
∆G0 = – RT In Kc
∆G0 = 8.314 J/mol-1 K-1 × 300 K-1 × ln (2 × 1013)
∆G0 = -7.64 × 104 J/mol-1
ప్రశ్న 29.
బ్రాన్ ష్టెడ్ ఆమ్లాలు: HF, H2SO4, HCO–3 లకు కాంజుగేటు క్షారాలను రాయండి?
సాధన:
కాంజుగేటు క్షారాలు ఒక ప్రోటాను తక్కువగా కలిగి ఉండాలి. కాబట్టి ఈ ఆమ్లాల కాంజుగేటు క్షారాలు వరసగా: F–, HSO–4, CO2-3లు.
ప్రశ్న 30.
బ్రాన్ ష్టెడ్ క్షారాలు: NH–2, NH3 and HCOO– కాంజుగేటు ఆమ్లాలను రాయండి.
సాధన:
కాంజుగేటు ఆమ్లంలో ఒక ప్రోటాన్ అధికంగా ఉండాలి. కాబట్టి కాంజుగేటు ఆమ్లాలు వరసగా:
NH3, NH+4 HCOOH లు.
ప్రశ్న 31.
H2O, HCO–3, HSO–4, NH3 లు బ్రాన్డెడ్ ఆమ్లాలు, బ్రాన్స్టెడ్ క్షారాలుగా ప్రవర్తిస్తాయి. వాటికి సంబంధించిన కాంజుగేటు ఆమ్లం, క్షారం రాయండి. [AP 18,22]
సాధన:
కింది పట్టికలో జవాబు చూడండి. :
| జాతి | కాంజుగేటు ఆమ్లం | కాంజుగేటు క్షారం |
| H2O | H3O+ | OH– |
| HCO–3 | H2CO3 | CO2-3 |
| HSO–4 | H2SO4 | SO2-4 |
| NH3 | NH+4 | NH–2 |
![]()
ప్రశ్న 32.
తగిన ఉదాహరణలతో లూయీ ఆమ్ల క్షార సిద్ధాంతం వివరించండి. కింది జాతులను లూయీ ఆమ్లాలు, లూయీక్షారాలుగా వర్గీకరించండి. ఇవి లూయీ ఆమ్లం/క్షారంగా ఏ విధంగా పనిచేస్తాయి.?
(a) HO– (b) F– (c) H+ (d) BCl3
సాధన:
(a) హైడ్రాక్సిల్ అయాన్, తాను ఒక ఎలక్ట్రాన్ జంటను దానం చేయగలగడం చేత లూయీ క్షారంగా పనిచేస్తుంది.
(b) F–, దానిపై ఉండే నాలుగు ఒంటరి ఎలక్ట్రాన్ జంటలలో ఒక దానిని దానం చేసి లూయీ క్షారంగా ప్రవర్తిస్తుంది.
(c) హైడ్రాక్సిల్ అయాన్, ఫ్లోరైడ్ అయాన్ వంటి క్షారాలు నుంచి, ఒక ఒంటరి ఎలక్ట్రాన్ జంటను స్వీకరించగలిగి ఉండటం కారణంగా, ప్రోటాన్ ఒక లూయీ ఆమ్లంగా పనిచేస్తుంది.
(d) అమ్మోనియా, లేదా ఏమీన్ అణువులు నుంచి ఒక జంట ఒంటరి ఎలక్ట్రాన్లను BCl3 స్వీకరించి లూయీ ఆమ్లంగా పనిచేస్తుంది.
ప్రశ్న 33.
ఒక మృదు పానీయం నమూనా ద్రావణంలో హైడ్రోజన్ అయాన్ గాఢత 3.8 × 10-3 M. దీని pH విలువలు ఎంత? [May’ 13]
సాధన:
pH = -log[3.8 × 10-3] = – {log [3.8] + log [10-3]}
= – {(0.58) + (−3.0)} = {-2.42} = 2.42
కాబట్టి మృదు పానీయం విలువ pH 2.42. దీనిని అనుసరించి ఇది ఆమ్ల గుణం కలిగి ఉంది అని తెలుస్తుంది..
ప్రశ్న 34.
1.0 × 10-8 M HCI ద్రావణం pH విలువను లెక్కించండి.
సాధన:
2H2O(l) ⇌ H3O+(aq) + OH–(aq)
Kw = [OH–][H3O+] = 10-14
నీటిలో x = [OH–] = [H3O+] అనుకొందాం. H3O+ అయాన్ల గాఢత (i) ద్రావణం స్థితిలో ఉండే HCl అయనీకరణం ప్రక్రియ మీద అంటే HCl (aq) + H2O(l) ⇌ H3O+(aq) + Cl–(aq),
(ii) H2O అయనీకరణం ప్రక్రియ మీద ఆధారపడి ఉంటుంది. అతి విలీన ద్రావణాలలో H3O+ కు సంబంధించిన రెండు ఉత్పత్తి స్థానాలను పరిగణనలోకి తీసుకోవాలి.
[H3O+] = 10-8 + x
Kw = (10-8 + x)(x) = 10-14 (Or) x² + 10-8 x – 10-14 = 0
[OH–] = x = 9.5 × 10-8
So, pOH = 7.02 and pH = 6.98
ప్రశ్న 35.
ఎసిటిక్ ఆమ్లం pKa అమ్మోనియా హైడ్రాక్సైడ్ pKb విలువ వరసగా 4.76,4.75. అమ్మోనియం ఎసిటేట్ జలద్రావణం pH కనుక్కోండి.
సాధన:
![]()
Exercise Problems
ప్రశ్న 36.
1 లీటరు ఘనపరిమాణం గల మూసిన పాత్రలో 1 మోల్ PCl5 ను వేడిచేస్తే సమతాస్థితి వద్ద 0.4 మోల్లు క్లోరిన్ ఏర్పడింది. సమతాస్థితి స్థిరాంకాన్ని లెక్కించండి.
సాధన:
PCl5 ‘x’ మోల్లు విఘటనం చెందినది అనుకొనుము.

ప్రశ్న 37.
5.0 × 10-3 mol L-1, 4. 0 × 10-3 mol L-1, 2.0 × 10-3 mol L-1 గాఢతలలో వరసగా H2, N2, NH3 గల మిశ్రమాన్ని తయారుచేసి, 500K. ఉష్ణోగ్రతకు వేడిచేస్తారు. 3H2(g) + N2(g) ⇌ 2NH3(g) చర్యకు ఈ ఉష్ణోగ్రత వద్ద సమతాస్థితి స్థిరాంకం 60. ఈ గాఢత వద్ద అమ్మోనియా ఏర్పడుతుందా? లేదా? ఏర్పడిన అమ్మోనియా విఘటనం చెందుతుందా? ఊహించండి.
సాధన:
[NH3] = 2.0 × 10-3 mol L-1
[N2] = 4. 0 × 10-3 mol L-1
[H2] = 5.0 × 10-3 mol L-1
N2(g) + 3H2(g) ⇌ 2NH3(g) చర్యకు చర్యభాగ ఫలం స్థిరాంకం Qc
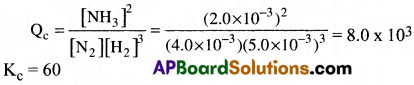
Qc > Kc, కాబట్టి చర్య ఎడమ వైపుకు జరిగి అమోనియా విఘటనం చెందును.
![]()
ప్రశ్న 38.
27°C, వద్ద PCl5(g) ⇌ PCl3(g) + Cl2(g) ద్విగత చర్యకు Kp విలువ 0.65. Kcను లెక్కించండి.
సాధన:
Kp = 0.65; R = 0.0821 lit. atm. mol-1. K-1; T = 27 + 273 = 300K
PCl5(g) ⇌ PCl3(g) + Cl2(g)
∆n = nP – nR = 2 – 1 = 1
Kp = Kp(RT)∆n
![]()
ప్రశ్న 39.
N2(g) + 3H2(g) ⇌ NH3(g) కు 400K వద్ద Kc విలువ 0.5 అయిన Kp విలువ ఎంత?
సాధన:
N2(g) + 3H2(g) ⇌ NH3(g)
ఇక్కడ kc = 0.5, T = 400K, ∆n =-2
Kp = kc(RT)∆n
Kp = 0.5 × (0.0821 × 400)-2;
![]()
ప్రశ్న 40.
PCl5(g) ⇌ PCl3(g) + Cl2(g) 0.4 మోల్లు PCl3, 0.6 మోల్ Cl2 తీసుకున్నాం. K విలువ 0.2 అయితే చర్య ఏ దిశలో జరుగుతుంది. ఊహించండి.
సాధన:
Qc > Kc, కాబట్టి తిరోగామి దిశలో చర్య జరుగును.
ప్రశ్న 41.
100 K వద్ద ఒక పాత్రలో CO2 వాయువు 0.5 atm. పీడనం వద్ద ఉంది. గ్రాఫైటును కలిపినప్పుడు CO2 లో కొంత భాగం CO గా మారింది. సమతా స్థితి పీడనం 0.8 atm. అయితే K విలువ లెక్కించండి.
సాధన:

ప్రశ్న 42.
400°C వద్ద N2(g) + 3H2(g) ⇌ 2NH3(g) చర్యకు Kp విలువ 1.64 × 10-4.
a) Kc ను లెక్కించండి.
b) Kc విలువ ఉపయోగించి ∆G0 విలువ లెక్కించండి.
సాధన:
a) N2(g) + 3H2(g) ⇌ 2NH3(g)
∆n = nP – nR = 2 – 4 = -2
R = 0.0821 lit. atm. mol-1.K-1
T = 400 + 273 = 673 K
Kp = 1.64 × 10-4.
Kp = Kc (RT)∆n
1.64 × 10-4 = Kc (0.0821 × 673)-2
∴ Kc = 1.64 × 10-4 (0.0821 × 673)² = 0.5006
b) ∆G0 = – 2.303 RT log Kc
= -2.303 × 8.314 – 673 log (0.5006) = 3872.25 J
ప్రశ్న 43.
కింది ద్రావణాల pH విలువలను లెక్కించండి. (a) 10-3 M HCl (b) 0.05 M H2SO4 [TS 15] [AP 17]
సాధన:
a) HCl ఒక బలమైన మరియు ఏకక్షారత ఆమ్లం.
∴ [H+] = మోలారిటీ × క్షారత = 10-3 × 1 = 10-3
pH = – log10[H+] = -log1010-3 = -(-3) log1010 = 3
b) H2SO4 ఒక బలమైన మరియు ద్విక్షారత ఆమ్లం.
∴ [H+] = మోలారిటీ × క్షారత = 0.05 × 2 = 0.1 = 10-1
pH = -log[H+] = -log(10-1) = -(-1)log10 = 1× log10 = 1 × 1 = 1 pH = 1
![]()
ప్రశ్న 44.
0.05M Ba(OH)2 ద్రావణం pH విలువను లెక్కకట్టండి.
సాధన:
Ba(OH)2 బలమైన మరియు ద్విఆమ్లత క్షారం.
∴ [OH–] = ‘మోలారిటీ × ఆమ్లత = 0.05 × 2 = 0.1 = 10-1
pOH = -log10[OH–] = -log1010-1 = 1
pH + pOH = 14
∴ pH = 14 – pOH = 14 – 1 = 13
ప్రశ్న 45.
కింది ద్రావణాల pH విలువలు లెక్కించండి (a) 0.001 M NaOH (b) 0.0008 M Ba(OH)2
సాధన:
a) NaOH బలమైన మరియు ఏక ఆమ్లత క్షారం.
∴ [OH–] = మోలారిటీ × ఆమ్లత
= 0.001 x 1 = 10-3
pOH = -log10[OH–]
= -log1010-3 = − (−3) log1010 = 3
కాని pH + pOH = 14
∴ pH = 14 – pOH = 14 – 3 = 11
b) Ba(OH)2 బలమైన మరియు ద్విఆమ్లత క్షారం.
∴ [OH–] = మోలారిటీ × ఆమ్లత
= 0.0008 × 2 = 16 × 10-4
pOH = -log10[OH–]
= – log10(16 × 10-4) = -log1016 – log1010-4
= -1.2041 – (-4) log 10 = 4 – 1.2041 = 2.7959
But pH + pOH = 14
∴ pH = 14 – pOH = 14 – 2.7959 = 11.2041
ప్రశ్న 46.
ఒక ద్రావణం pH 3.6. దీని H3O+ అయాన్ గాఢత లెక్కించండి.
సాధన:
pH = 3.6
∴ [H3O+] or [H+] = 10-pH = 10-3.6 = 10-4+0.4 = 100.4 × 10-4
= Anti log 0.4 × 10-4 = 2.512 × 10-4
ప్రశ్న 47.
ఒక ద్రావణం pH విలువలు గల ద్రావణాలలో OH– గాఢత ఎంత?
సాధన:
pH = 8.6
∴ POH = 14 – pH = 14 – 8.6 = 5.4
[OH–] = 10-pOH = 10-5.4 = 100.6 × 10-6
= Anti log (0.6) × 10-6 = 3.981 × 10-6 moles/litre.
ప్రశ్న 48.
100P.10-8 M HCI ద్రావణం pH విలువను లెక్కించండి.
సాధన:
p = -log[H+]
ఇక్కడ మొత్తం [H+] = ఆమ్లం నుండి వచ్చిన [H+] + నీటి నుండి వచ్చిన [H+]
దత్తాంశం నుండి [H+] = 10-8
[H+] = 10-8 + 10-7 = 1.1 × 10-7 M
∴ pH = -log[1.1 × 10-7] (0.0414-7) = 6.9586.
ప్రశ్న 49.
150 ml 0.5 M HCl, 100 ml 0.2 M HCl ద్రావణాలను కలిపి మిశ్రమం చేశారు. ఫలిత ద్రావణం pHను లెక్కించండి.
సాధన:
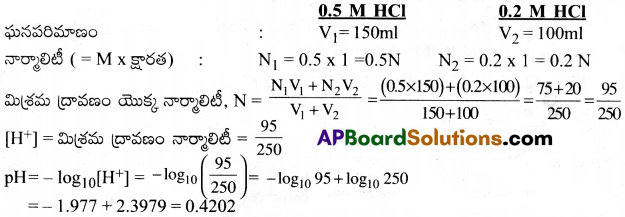
ప్రశ్న 50.
0.5 M NaOH ద్రావణాన్ని, 0.3M KOH ద్రావణాన్ని సమఘనపరిమాణాలలో కలిపారు. ఫలిత ద్రావణం pOH, pH విలువలను లెక్కించండి.
సాధన:

![]()
ప్రశ్న 51.
0.2 M HCl ద్రావణం 50 ml 0.1 M KOH ద్రావణం 30 ml కలిపి తయారు చేసిన మిశ్రమ ద్రావణం pH విలువ.
సాధన:

ప్రశ్న 52.
ఒక మోల్ క్షారిత ఆమ్ల 0.005 M ద్రావణం pH = 5. దీని అయనీకరణ అవధి ఎంత?
సాధన:
pH = 5
[H+] = 10-pH = 10-5
C = 0.005 M = 5 × 10-3M
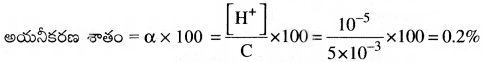
ప్రశ్న 53.
Cl2(g) +F2(g) ⇌ 2ClF(g), Kc = 19.9
పై చర్యలోని పదార్థాల గాఢతలు కింది విధంగా ఉంటే చర్య ఏ విధంగా జరుగుతుంది? [Cl2] = 0.4 mol L-1; [F2] = 0.2 mol L-1 and [ClF]= 7.3 molL-1?
సాధన:

Kc = 19.9 Qc > Kc, కాబట్టి తిరోగామి దిశలో చర్య జరుగును.
ప్రశ్న 54.
50 ml 0.1M NH4OH, 25ml 2M NH4Cl లను కలిపి బఫర్ ద్రావణం తయారుచేశారు. దీని pH ఎంత? pka = 4.8.
సాధన:
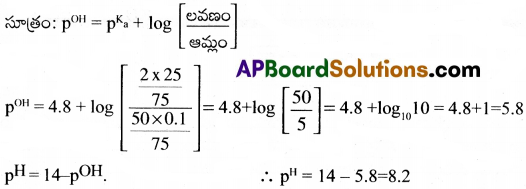
ప్రశ్న 55.
50ml 0.1 సోడియం ఎసిటేట్ను 25ml of 0.1m సోడియం ఎసిటేట్ను 25ml of 0.2m ఎసిటిక్ ఆమ్లాన్ని కలిపి బఫర్ ద్రావణం చేశారు. CH3COOH, pka విలువ 4.8. బఫర్ ద్రావణం pH విలువ ఎంత?
సాధన:

ప్రశ్న 56.
1 లీటరు బఫర్ ద్రావణంలో 0.1 మోల్ ఎసిటిక్ ఆమ్లం, 1 మోల్ సోడియం ఎసిటేట్ ఉన్నాయి.. CH3COOH, pka విలువ 4.8. అయిన బఫర్ ద్రావణం pH ఎంత?
సాధన:
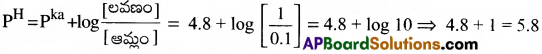
ప్రశ్న 57.
AgCl ద్రావణీయతా లబ్దం విలువ 1.6 × 10-10 moles²/lit².దీని ద్రావణీయత ఎంత?
సాధన:

![]()
ప్రశ్న 58.
A2B = 2 × 10-3 moles/lit. దీని ద్రావణీయతా లబ్ధం విలువ ఎంత?
సాధన:
A2B ⇌ 2A+ + B-2
Ksp = [A+]²[B-2] = (2S)².(S) = 4S³ (ద్రావణీయతా S = 2 × 10-3 mole/lit)
Ksp = 4S³
= 4 × (2 × 10-3)³
= 4 × 8 × 10-9
= 32 × 10-9 moles³/lit³.