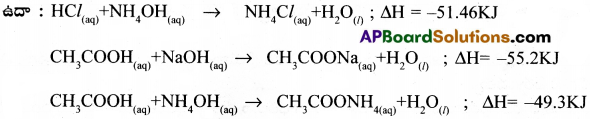Students get through AP Inter 1st Year Chemistry Important Questions 6th Lesson ఉష్ణగతిక శాస్త్రం which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 6th Lesson ఉష్ణగతిక శాస్త్రం
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
ఉష్ణగతిక శాస్త్రం అనే పదం ఏమి తెలియజేస్తుంది.?
జవాబు:
ఉష్ణగతిక శాస్త్రం రసాయన చర్యలో శక్తి మార్పులను గురించి తెలియజేస్తుంది.
ఉష్ణగతికశాస్త్ర నియమాలు పెద్ద పెద్ద వ్యవస్థల (ఎక్కువ సంఖ్యలో అణువులు గలవి) లోని శక్తి మార్పుల గురించి తెలియజేస్తుంది.
ప్రశ్న 2.
ఉష్ణగతికశాస్త్రం నియమాలకు, సమతాస్థితికి మధ్య సంబంధమేమిటి?
జవాబు:
ఉష్ణగతికశాస్త్ర నియమాలు వ్యవస్థ సమతాస్థితిలో ఉన్నపుడు మాత్రమే అనువర్తనం చెందుతాయి.
సమతాస్థితి వద్ద పీడనం మరియు ఉష్ణోగ్రత వంటి ధర్మాలు కాలంతో పాటు మార్పు చెందవు.
ప్రశ్న 3.
ఒక ఆదర్శ వాయువు స్వేచ్ఛా వ్యాకోచంలో (free expansion) ఉత్ర్కమణీయ, అనుత్రమణీయ ప్రక్రియల్లో వాయువు చేసే పని ఏమిటి? [Imp.Q]
జవాబు:
ఒక ఆదర్శ వాయువు స్వేచ్ఛా వ్యాకోచం (Pex = 0) లో పీడనం సున్నా అగును.
అందువలన ఆదర్శ వాయువు వలన ఉత్రమణీయ లేదా అనుత్రమణీయ చర్యలలో స్వేచ్ఛా వ్యాకోచ స్థితిలో ఎటువంటి పని జరుగదు.
ప్రశ్న 4.
సమోష్ణ స్వేచ్ఛా వ్యాకోచం ప్రక్రియలో ఒక ఆదర్శ వాయువు q, ∆U విలువలు ఎంత? [Imp.Q]
జవాబు:
∆U= q + w. సమోష్ణ స్వేచ్ఛా వ్యాకోచ ప్రక్రియలో w = 0, q = 0
∴ ∆U = 0
ప్రశ్న 5.
సమోష్ణ అనుత్రమణీయ ప్రక్రియ మార్పులో ఆదర్శ వాయువుకు q విలువ ఎంత?
జవాబు:
సమోష్ణ అనుత్ప్ర్కమణీయ ప్రక్రియలో ‘q’ విలువ
q = -w = Pex (Vf – Vi)
![]()
ప్రశ్న 6.
సమోష్ణ ఉత్రమణీయ ప్రక్రియ మార్పులో ఆదర్శ వాయువుకు q విలువ ఎంత?
జవాబు:
సమోష్ణ ఉత్ర్కమణీయ ప్రక్రియలో ‘q’ విలువ
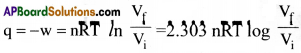
ప్రశ్న 7.
ఆదర్శ వాయువు స్థిరోష్ణక మార్పులో ∆U, W (adiabatic) ల సంబంధమేమిటి? [Imp.Q]
జవాబు:
స్థిరోష్ణక పద్ధతిలో q = 0
∆U = q + W
∆U = 0 + W
∆U = W
అంతరిక శక్తి మార్పు = స్థిరోష్ణక పద్ధతిలో జరిగిన పని.
ప్రశ్న 8.
ఉష్ణగతికశాస్త్రం మొదటి నియమం తెలపండి. [TS 16,18,22]
జవాబు:
ఉష్ణగతికశాస్త్ర మొదటి నియమం: శక్తి నిత్యత్వ నియమాన్ని ఉష్ణగతికశాస్త్ర మొదటి నియమంగా పరిగణిస్తారు. ఈ నియమాన్ని భిన్న రకాలుగా నిర్వచిస్తారు.
నిర్వచనాలు:
- శక్తిని ఒక రూపము నుండి వేరొక రూపములోనికి పరివర్తనము చెందించవచ్చు. కాని శక్తిని సృష్టించుటగాని పూర్తిగా నాశనం చేయుట గాని వీలుపడదు.
- ఏదైనా ఒక ప్రక్రియలో, ఒక రూపములోని శక్తి అదృశ్యమైతే అంతే పరిమాణము గల వేరొక శక్తి రూపము ఏర్పడును.
- ఈ నియమము ప్రకారము వ్యవస్థ మరియు పరిసరాల మొత్తం శక్తి ఎల్లప్పుడు స్థిరము.
ప్రశ్న 9.
వ్యవస్థ చేసిన పనికి, వ్యవస్థ పై జరిగిన పనికి సంప్రదాయ గుర్తులు ఏమిటి?
జవాబు:
వ్యవస్థ పై జరిగిన పనికి గుర్తు ధనాత్మకం.
వ్యవస్థ చేసిన పనికి గుర్తు ఋణాత్మకం.
ప్రశ్న 10.
ఘనపరిమాణం (V), పీడనం (P) ఉష్ణోగ్రత (T) లు స్థితి ప్రమేయాలు. ఇలా చెప్పడం సరైందా?
జవాబు:
ఘనపరిమాణం(V), పీడనం (P), ఉష్ణోగ్రత(T) లు స్థితి ప్రమేయాలు. ఇవి చర్య మార్గంపై ఆధారపడవు. కేవలం స్థితిపై ఆధారపరడతాయి.
ప్రశ్న 11.
ఉష్ణపరిసరాల నుంచి వ్యవస్థకు, వ్యవస్థ నుంచి పరిసరాలకు మారినప్పుడు దాని సంప్రదాయక గుర్తులు ఏమిటి?
జవాబు:
q = ధనాత్మకం. → పరిసరాల నుండి ఉష్ణం వ్యవస్థకు మార్పిడి.
q= ఋణాత్మకం. → వ్యవస్థ నుండి ఉష్ణం పరిసరాలకు మార్పిడి.
![]()
ప్రశ్న 12.
పరిసరాల నుంచి వ్యవస్థ ఎలాంటి ఉష్ణం గ్రహించలేదు. అయితే వ్యవస్థ మీద పని జరిగింది. వ్యవస్థకు ఎలాంటి సరిహద్దు గోడ ఉంది? [Imp.Q]
జవాబు:
పరిసరాల నుండి వ్యవస్థకు ఉష్ణమార్పిడి జరుగలేదు. కాని పని వ్యవస్థ పై జరిగినది. ఇది స్థిరోష్ణక మార్పు. కావున ఇది స్థిరోష్ణక గోడ.
ప్రశ్న 13.
ఉష్ణమోచక మరియు ఉష్ణగ్రాహక చర్యలు అనగా ఏవి? ఉదాహరణనిమ్ము? [Imp.Q]
జవాబు:
ఉష్ణమోచక చర్యలు :
ఉష్ణం విడుదలయ్యే రసాయన చర్యలను ఉష్ణమోచక చర్యలు అంటారు. ఈ చర్యలలో HR కన్న Hp తక్కువ. మరియు ∆H విలువ ఋణాత్మకము.
ఉదా: C(graphite) + O2(g) → CO2(g) ; ∆H= -393.5KJ
N2(g) + 3H2(g) → 2NH(g) ; ∆H= -92KJ
ఉష్ణగ్రాహక చర్యలు :
ఉష్ణం గ్రహించబడే రసాయన చర్యలను ఉష్ణగ్రాహక చర్యలు అంటారు. ఈ చర్యలలో HR కన్న Hp ఎక్కువ. మరియు ∆H విలువ ధనాత్మకము. ఉదా : మొక్కలలో జరిగే కిరణజన్య సంయోగక్రియ
ఉదా: N2(g) + O2(g) → 2NO(g) ; ∆H= +180.0KJ
PCl5(g) → PCl3(g) +Cl3(g); ∆H= + 87.9KJ
ప్రశ్న 14.
విస్తార ధర్మము మరియు గహన ధర్మములు అనగానేమి? ఉదాహరణనిమ్ము ? [AP 17,19][Imp.Q]
జవాబు:
విస్తార ధర్మము :
పదార్థపు ద్రవ్యరాశి మీద ఆధారపడే ధర్మమును విస్తార లేదా పరిమాణాధార ధర్మము అంటారు.
ఉదా : ఘనపరిమాణము, అంతరిక శక్తి, ఎంథాల్ని, ఎంట్రోపి
గహన ధర్మము :
పదార్ధ ద్రవ్యరాశి మీద ఆధారపడని ధర్మమును గహన లేదా గుణాధారధర్మము అంటారు.
ఉదా : సాంద్రత, భాష్పీభవనస్థానము, స్నిగ్ధత, తలతన్యత మొదలగునవి.
ప్రశ్న 15.
ΔU, ΔH ల సంబంధం తెలిపే సమీకరణం రాయండి. [Imp.Q]
జవాబు:
ΔΗ = ΔU + ΔnRT
ΔH = ఎంథాల్పీ మార్పు
ΔU = ఆంతరిక శక్తి మార్పు
Δn = np – nR, R = విశ్వవాయు స్థిరాంకం
T = ఉష్ణోగ్రత
ప్రశ్న 16.
Cp Cv ల మధ్య సంబంధం ఏమిటి?
జవాబు:
Cp – Cv = R
Cp = స్థిర పీడనము వద్ద ఉష్ణసామర్థ్యం
Cv = స్థిర ఘనపరిమాణము వద్ద ఉష్ణసామర్థ్యం
R = విశ్వవాయు స్థిరాంకం
ప్రశ్న 17.
కేవలం ఎంట్రోపీ పెరుగుదల చర్య అయత్నీకృతానికి కారణం కాదు. ఎందువల్ల? [Imp.Q]
జవాబు:
ఎంట్రోపీ మార్పు ధనాత్మకం అయితే ఆ చర్య స్వచ్ఛంద చర్య అగును. ఒక వివిక్త వ్యవస్థలో శక్తి మార్పు ఎప్పుడూ స్థిరంగా ఉండును. అందువల్ల కేవలం ఎంట్రోపీ పెరుగుదల చర్య అయత్నీకృతానికి కారణం కాదు.
![]()
ప్రశ్న 18.
1.00 మోల్ of H2O(l) ప్రమాణ పరిస్థితుల్లో ఏర్పడితే పరిసరాల ఎంట్రోపీ మార్పు ఎంత? [Imp.Q]
ΔH°f = 286 KJmol-1.
జవాబు:

ప్రశ్న 19.
ఒక చర్యకు సమతాస్థితి స్థిరాంకం విలువ 10. AGO విలువ ఎంత? R = 8.314J/Kmol, T = 300K. [Imp.Q]
జవాబు:
ఇక్కడ K = 10, R = 8.314J/K.mole, T=300K
ΔG° = -RTINK
= -2.303RT log K
= -2.303 × 8.314 × 300 × log10
= -5774.14J/mole
ప్రశ్న 20.
ఉష్ణగతిక శాస్త్ర మూడవ నియమమును నిర్వచించుము మరియు దాని ప్రాముఖ్యతను తెలుపుము? [TS 16][AP 17,19] [TS 17]
జవాబు:
ఉష్ణగతిక శాస్త్ర మూడవ నియమము :
“పరిపూర్ణ శుద్ధ స్ఫటిక పదార్థాల ఎంట్రోపి విలువ, పరమ శూన్య ఉష్ణోగ్రత వద్ద శూన్యం అగును.”

ప్రాముఖ్యత:
రసాయన చర్యలలోని ఎంట్రోపి మార్పును కనుగొనుటకు ఈ నియమం ఉపయోగపడును.
ఇది ఎంట్రోపి విలువ యొక్క అవధిని తెలియజేయును.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
హెస్ సంకలనోష్ణ నియమాన్ని ఉదాహరణలతో నిర్వచించి వివరించుము. [TS 15,1617,18,19,20,22][AP 15,1617,18,19,20,22]
జవాబు:
హెస్ నియమము :
ఒక రసాయన చర్య ఒక దశలో జరిగినా లేదా అనేక దశలలో జరిగినా, మొత్తం ఉష్ణమార్పు ఎల్లప్పుడు స్థిరము.
A అనే క్రియాజనకము నుండి D అనే క్రియాజన్యం రెండు విభిన్న మార్గాలలో తయారు అయినది అనుకొనుము.
మార్గం – I : A → D, ∆H = Φ1
మార్గం – II : A → B, ∆H = q1
B → C, ∆H = q2
C → D, ∆H = q3
మార్గం – II లో మొత్తం ఉష్ణ మార్పు Φ2 = q1 + q2 + q3.
హెస్ నియమం నుండి Φ1 = Φ2 (or) Φ1 = q1 + q2 + q3.
Ex: CO2 ను C(graphite) మరియు O2(g) ల నుండి రెండు విభిన్న పద్ధతులలో తయారు చేయవచ్చును.
మార్గం – I: C(graphite) + O2(g) → CO2(g); ∆H = -393.5 KJ
మార్గం – II : C(graphite) + ½ O2(g) → CO(g); ∆H = -110.5 KJ
CO(g) + ½O2(g) → CO2(g); ∆H = -283.02 KJ
మొత్తం ఉష్ణ మార్పు = (−110.5)+ (−283.02) =-393.52 KJ.
రెండింటిలోనూ ఎంథాల్పి మార్పు సమానంగా ఉన్నది.
![]()
ప్రశ్న 2.
ఉష్ణధారణ అంటే ఏమిటి? Cp – Cv = R ను ఉత్పాదించండి.
జవాబు:
ఒక పదార్ధము యొక్క ఉష్ణోగ్రతను ఒక డిగ్రీ పెంచుటకు అవసరమయ్యే, ఉష్ణరాశిని ఉష్ణసామర్ధ్యము (C) అంటారు.
C = \(\frac{\mathrm{ν}}{\Delta \mathrm{T}}\) (or) ν = C∆T; ‘ఇక్కడ V = శోషించిన ఉష్ణం పరిమాణం; ∆T = ఉష్ణోగ్రత వృద్ధి
వాయువులో ఉష్ణసామర్థ్యము రెండు రకాలు:
i) స్థిరఘనపరిమాణము వద్ద ఉష్ణసామర్ధ్యము (Cν)
ii) స్థిరపీడనము వద్ద ఉష్ణసామర్ధ్యము (Cp)
Cv : ఇది స్థిర ఘనపరిమాణము వద్ద, ఒక వ్యవస్థ యొక్క అంతరికశక్తిలో మార్పు.
Cp : ఇది స్థిర పీడనం వద్ద, ఒక వ్యవస్థ శోషించుకున్న మొత్తము ఉష్ణరాశి.
Cp మరియు Cv ల మధ్య సంబంధం:
ఉష్ణసమీకరణం (q) మరియు స్థిరఘ. ప వద్ద νv = Cv ∆T = ∆U, స్థిర పీడనం వద్ద vp = Cp∆T = ∆H
ఒక మోల్ ఆదర్శవాయువునకు ∆H = ∆U + R∆T
∆H మరియు ∆U ల విలువలను ప్రతిక్షేపించగా Cp ∆T = Cv ∆T + R∆T → (Cp – Cν) ∆T = R ∆T
∴ Cp – Cν = R.
ప్రశ్న 3.
∆U ను ప్రయోగపూర్వకంగా కెలోరి మెట్రిక్ విధానంలో ఏ విధంగా నిర్ణయిస్తారు.
జవాబు:
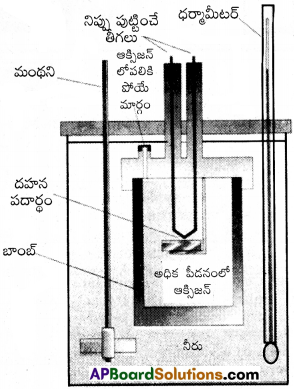
శక్తిమార్పులను ప్రయోగపూర్వకంగా సాంకేతిక పద్ధతిలో కొలవడాన్ని కెలోరిమెట్రి అంటారు. ఈ విధానంలో కొలిచే సాధనాన్ని కెలోరిమీటర్ అంటారు.
కెలోరిమీటర్ ఒక ధృడమైన గోడలు గల ఉక్కుపాత్ర. ఇది ఒక జలతాపకం పై ముంచబడి ఉంటుంది.
తేలికగా దహనం చెందిన పదార్థాన్ని ఆక్సిజన్ కలిపి దహనం చెందిస్తారు. ఈ చర్యలో ఉష్ణం విడుదలై కెలోరిమీటర్ ఉష్ణోగ్రతను పెంచుతుంది. కాని కెలోరిమీటర్లో పరిసరాలకు ఉష్ణం వినిమయం జరగదు. మరియు ఘనపరిమాణంలో మార్పు ఉండదు. కాబట్టి పని ఏమి జరగదు. ∆V = 0
చర్య వల్ల కెలోరిమీటర్ పెరిగిన ఉష్ణోగ్రతను ఉపయోగించి కెలోరిమీటర్ ద్రవ్యరాశి, ఉష్ణధారణ విలువల ద్వార వెలువడిన ఉష్ణాన్ని గణించవచ్చు.
అంతరిక శక్తి ∆U = Q.∆t × \(\frac{M}{m}\)
Q = ఉష్ణసామర్థ్యం. ∆t = t2 – t1. M = పదార్థ మోలార్ ద్రవ్యరాశి. m = పదార్థ ద్రవ్యరాశి
ప్రశ్న 4.
ఉష్ణగతిక శాస్త్ర మొదటి నియమము యొక్క గణిత రూపమును వ్రాయము?
జవాబు:
ఉష్ణగతిక శాస్త్ర మొదటి నియమము :
దీనిని శక్తి నిత్యత్వనియమము అంటారు. శక్తి సృష్టించుటగాని పూర్తిగా నాశనం చేయుట గాని జరుగదు. శక్తి ఒక రూపము నుండి వేరొక రూపములోనికి పరివర్తనము మాత్రమే చెందును. ఒకానొక ప్రక్రియలో ఒక రూపములోని శక్తి అదృశ్యమైన అంతే పరిమాణము గల వేరొక శక్తి రూపము ఏర్పడును. ఈ నియమము ప్రకారమువ్యవస్థ మరియు పరిసరాల మొత్తం శక్తి ఎల్లప్పుడు స్థిరము.
మొదటి నియమంను గణిత రూపంలో రాయడం :
‘A’ అనే స్థితి నుండి, EA అంతరిక శక్తి గల ఒక వ్యవస్థ, పరిసరాల నుండి (Q) అనే ఉష్ణశక్తిని గ్రహించి, ‘B’ అనే స్థితికి మారింది అనుకొందాం. స్థితి’B’ లో అంతరిక శక్తి EB మరియు అంతరిక శక్తిలో పెరుగుదల ∆E అయితే ∆E = EB – EA. ఈ ప్రక్రియలో వ్యవస్థ జరిపిన పని W అయితే, శక్తిలోని నికరలాభం (Q-W) అవుతుంది. ఉష్ణగతికశాస్త్ర మొదటి నియమం ప్రకారం, శక్తిలోని నికరలాభం (Q-W), ∆E కు సమానమగును.
ఇక్కడ, ∆E=(EB – EA) = (Q–W) (or) Q = ∆E + W. ఇదే ఉష్ణగతిక శాస్త్ర మొదటి నియమం యొక్క గణితరూపం.
ప్రశ్న 5.
ఉష్ణగతికశాస్త్ర రెండవ నియమమును యొక్క ప్రాముఖ్యతను వివరించి, నిర్వచింపుము?
జవాబు:
ఉష్ణగతికశాస్త్ర రెండవ నియమమును యొక్క ప్రాముఖ్యత :
బాహ్యకారకం ప్రమేయం లేకుండా స్వచ్ఛందంగా జరిగే చర్యను అయత్నికృత చర్య అంటారు. ప్రకృతిలో జరిగే అయతికృత చర్యలన్నీ ఉష్ణగతిక శాస్త్ర పరంగా అద్విగత చర్యలే.
నిర్ధిష్ట దిశలో ఒక ప్రక్రియ అయత్నీకృతంగా జరుగుతుందా లేదా అనే విషయాన్ని మొదటి నియమం తెలపదు.
ఉష్ణగతికశాస్త్ర రెండవ నియమమును యొక్క నిర్వచనాలు :
- చల్లని వస్తువు నుండి ఉష్ణం తనంతట తాను విడి వస్తువుకు బదిలీ కాలేదు.
- వ్యవస్థలో కాని, పరిసరాలలో కాని, కొన్ని శాశ్వత మార్పులు లేకుండా, ఉష్ణం మొత్తం, పూర్తిగా పనిగా మార్పు చెందదు.
- చల్లని ప్రాంతము నుండి వేడి ప్రాంతమునకు ఉష్ణంను తరలించి, చక్రీయముగా పనిచేసే యంత్రమును నిర్మించుట అసాధ్యము.
- అన్ని స్వచ్ఛంధ చర్యలు ఉష్ణగతికముగా అద్విగతములు మరియు అన్ని స్వచ్చంధ చర్యలలో ఎంట్రోపి పెరుగును.
ప్రశ్న 6.
ఉష్ణగతిక శాస్త్రం వివృత(open), సంవృత (closed) వివిక్త (isolated) వ్యవస్థలంటే ఏమిటి? ఒక్కొక్కదానికి ఒక ఉదాహరణ ఇవ్వండి.
జవాబు:
(a) వివృత వ్యవస్థ:
పరిసరాల నుంచి వ్యవస్థకు లేదా వ్యవస్థ నుంచి పరిసరాలకు శక్తి, ద్రవ్యం రెండూ మార్పిడి చెందుటకు వీలున్న వ్యవస్థను వివృత వ్యవస్థ అంటారు.
ఉదా: తెరచి ఉంచిన బీకరులోని నీరు వివృత వ్యవస్థకు ఉదాహరణగా చెప్పవచ్చు
(b) సంవృత వ్యవస్థ:
పరిసరాల నుంచి వ్యవస్థకు లేదా వ్యవస్థ నుంచి పరిసరాలకు శక్తి మార్పిడి చెందుటకు వీలుండి ద్రవ్యమార్పుకు వీలు లేని వ్యవస్థను సంవృత వ్యవస్థ అంటారు.
ఉదా: ఒక మూసి ఉంచిన వాహక పాత్ర(రాగి లేదా స్టీల్)లో ఉన్న నీరు.
(c) వివిక్త వ్యవస్థ:
పరిసరాల నుంచి వ్యవస్థకు లేదా వ్యవస్థ నుంచి పరిసరాలకు శక్తి, ద్రవ్యం రెండూ మార్పిడి చెందుటకు వీలులేని వ్యవస్థను వివిక్త వ్యవస్థ అంటారు.
ఉదా: ఒక ధర్మోప్లాస్క్ లేదా ఏదైనా మూసి ఉంచిన బంధక పాత్రలో ఉన్న ద్రవం. దీనిలో ద్రవ్యం మరియు శక్తి పరిసరాలకు, వ్యవస్థకు వినిమయం జరగదు.
![]()
ప్రశ్న 7.
స్థితి ప్రమేయాలు (state functions), స్థితి చరాంశాలు (state variables) వీటిని నిర్వచించండి. ఉదాహరణలు ఇవ్వండి.
జవాబు:
స్థితి ప్రమేయాలు:
వ్యవస్థ యొక్క ఏ ధర్మాలు అయితే తొలి మరియు తుది స్థితులపై ఆధారపడి ఉంటాయో మరియు చర్య మార్గము పై ఆధారపడవో వాటిని స్థితి ప్రమేయాలు అంటారు.
ఉదా: పీడనం, ఘనపరిమాణం, ఉష్ణోగ్రత మొదలైనవి.
స్థితి చరాంశాలు:
ఒక వ్యవస్థ గురించి పూర్తి వివరణను ఇవ్వగలిగిన చరరాశులను స్థితి చరాంశాలు అంటారు. ఉదా: పీడనం, ఘనపరిమాణం, ఉష్ణోగ్రత మొదలైనవి.
ప్రశ్న 8.
“పని స్థితి ప్రమేయం కాదు”. వివరించండి.
జవాబు:
ఒక వ్యవస్థలో జరిగే పని కేవలం తొలి మరియు అంత్య స్థితులపై మాత్రమేగాక ఆ పని జరిగే మార్గముపై కూడా ఆధారపడి ఉండును.
ఈ క్రింద పేర్కొనబడిన A నుండి B కు మారిన వ్యవస్థను పరిశీలించగా, వ్యవస్థ యొక్క స్థితి వివిధమార్గాలలో జరుగును.
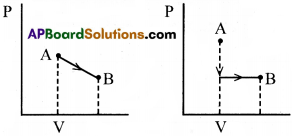
పై పటముల నుండి వక్రములచే పరిబద్ధమయ్యే వైశాల్యములు విభిన్నమని తెలియచున్నది. కావున వాటి వలన జరిగిన పని కూడా విభిన్నము. అందువల్ల పని ‘చర్యా మార్గం’ పై ఆధారపడును కాని వ్యవస్థ స్థితిపై ఆధారపడదు అని తెలియచున్నది. కాబట్టి పని స్థితి ప్రమేయం కాదు.
ప్రశ్న 9.
ΔΗ = ΔU + Δn(వా) RT ను ఉత్పాదించండి.
జవాబు:
వాయు వ్యవస్థకు
VA = వాయుస్థితిలో గల క్రియజనకాల మొత్తం ఘనపరిమాణం;
VB = వాయుస్థితిలో గల క్రియజన్యాల మొత్తం ఘనపరిమాణం
nA = వాయుస్థితిలో గల క్రియజనకాల మోత్ల సంఖ్య
nB = వాయుస్థితిలో గల క్రియజన్యాల మోత్ల సంఖ్య
ఆదర్శ వాయు సమీకరణం ప్రకారం PVA = nART and PVB = nBRT (or) PVB – PVA = nBRT – nART
P(VB – VA) = (nB – nA) RT
PΔV = (Δn)gRT ΔH = ΔU + PΔVకాబట్టి
∴ ΔH = ΔU + (Δn)g RT
Textual Solved Problems (సాధించిన సమస్యలు)
ప్రశ్న 1.
వ్యవస్థను నిర్వచించండి.
జవాబు:
వ్యవస్థ :
ఉష్ణగతిక శాస్త్ర అధ్యయనానికి ఎంచుకొన్న విశ్వంలోని లఘుభాగాన్ని వ్యవస్థ అంటారు.
ప్రశ్న 2.
ఒక వ్యవస్థలో స్థిరోష్ణక గోడ ఉంది మరియు ΔU = Wad. వ్యవస్థపరంగా ఉష్ణం, పని అంటే ఏమి అర్థమయింది?
జవాబు:
స్థిరోష్ణక పద్ధతిలో వ్యవస్థ మరియు పరిసరాల మధ్య ఉష్ణ మార్పిడి జరగదు.
స్థిరోష్ణక పద్ధతిలో వ్యవస్థలో జరిగిన పని అంతరిక శక్తికి సమానం
Wad = U2 – U1 = ΔU
ఇచ్చట వ్యవస్థ పై జరిగిన పని ధనాత్మకం, వ్యవస్థ ద్వారా జరిగిన పని ఋణాత్మకం.
ప్రశ్న 3.
వ్యవస్థ మీద పని ఏమీ జరగలేదు. వ్యవస్థ ‘q’ పరిమాణంలో ఉష్ణం కోల్పోయింది. ఈ వ్యవస్థ ఎలాంటి గోడను కలిగి ఉంది?
జవాబు:
ΔU = q, ఉష్ణవాహక గోడ
ప్రశ్న 4.
వ్యవస్థకు ‘q’ పరిమాణంలో ఉష్ణం అందించబడింది, వ్యవస్థ పనిచేసింది. ఈ వ్యవస్థ ఏ రకం పై ఎలాంటిదై ఉంటుంది?
జవాబు:
ΔU = q – w. ఈ వ్యవస్థ మూసిన వ్యవస్థ.
![]()
ప్రశ్న 5.
సమీకరణం ΔU = q – PexΔV, నుంచి ఘనపరిమాణం స్థిరంగా ఉన్నప్పుడు ΔU విలువ ఎంత?
జవాబు:
ఘనపరిమాణం స్థిరము అయితే ΔV = 0 అగును. కావున ΔU = q – PexΔV నుండి ΔU = q అగును.
కావున అంతరికశక్తి మార్పు = అందింపబడిన ఉష్ణం.
ప్రశ్న 6.
వ్యవస్థ మీద పని ఏమి జరగలేదు. అయితే (q) ఉష్ణం వ్యవస్థ నుంచి పరిసరాలకు మారింది. వ్యవస్థకు ఎలాంటి సరిహద్దు గోడ ఉంది. [Imp.Q]
జవాబు:
వ్యవస్థపై పని జరుగలేదు. కాని (q) ఉష్ణం వ్యవస్థ నుండి పరిసరాలకు మార్పిడి జరిగినది. ఇచ్చట గోడ ఉష్ణవాహక గోడ.
ప్రశ్న 7.
వ్యవస్థ పనిచేసింది, వ్యవస్థకు (q) ఉష్ణం కూడా ఇవ్వబడింది. ఇది ఎలాంటి వ్యవస్థ?
జవాబు:
వ్యవస్థ పని చేసింది దానికి ఉష్ణం కూడ ఇవ్వబడింది. ΔU = q – w కాబట్టి వ్యవస్థ మూసిన వ్యవస్థ.
ప్రశ్న 8.
q = w = -Pext (vf – vi) ఇది అనుత్రమణీయ …..మార్పు
జవాబు:
q = w = -Pext (vf – vi) అనునది అనుత్రమణీయ సమోష్ణక మార్పు.
ప్రశ్న 9.
q = -w = nRT In (vf – vi) ఇది సమోష్ఠీయ ……. మార్పు
జవాబు:
q = -w = nRTln\(\frac{v_f}{v_i}\) అనునది సమోష్ణ ఉత్రమణీయ మార్పు.
ప్రశ్న 10.
సమీకరణం q = c.m. AT. లో AT ఉష్ణోగ్రత మార్పు ‘m’ పదార్థం ద్రవ్యరాశి ‘q’ కావలసిన ఉష్ణం. అయితే ‘e’ ఏమిటి?
జవాబు:
q = c × m × ΔT అని ఇవ్వబడినది. ఇక్కడ ‘c’ అనునది విశిష్టోష్ణం.
ఇది 1గ్రా. పదార్థం యొక్క ఉష్ణోగ్రతను 1°C పెంచుటకు అవసరమైన ఉష్ణం.
ప్రశ్న 11.
బాంబ్ కెలోరిమీటర్లో ఆక్సిజన్ సమక్షంలో 298K, 1 atm పీడనంలో 1 g గ్రాఫైట్ ఇచ్చిన సమీకరణం ప్రకారం దహనం చెందింది.
C(graphite) + O2(g) → CO2(g)
చర్య జరగడం వల్ల ఉష్ణోగ్రత 298K నుంచి 299 K.కు పెరిగింది. బాంబ్ కెలోరిమీటర్ ఉష్ణధారణ 20.7KjK-1. పై చర్యకు 298K, 1 atm పీడనం వద్ద ఎంథాల్పీ మార్పు ఎంత?
జవాబు:
C(graphite) + O2(g) → CO2(g)
ΔT = 299 – 298 = 1K.
q = Cv × ΔT = -20.7 × 1 = -20.7KJ
1 గ్రా. గ్రాఫైట్ ఇవ్వబడినది. ∴ ΔH = ΔU (∵ ΔH = 0)
∴ ΔU = – 20.7 KJ/K
ఒక మోల్కు
ΔU = 12 × −20.7 = -248 KJ/mole
![]()
ప్రశ్న 12.
పై చర్యకు అంతరిక శక్తి మార్పు ΔU ఎంత?
జవాబు:
పై చర్యకు అంతరిక శక్తి మార్పు ΔU = -20.7KJ/K
ప్రశ్న 13.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) చర్యకు క్రియాజనకాలు, క్రియజన్యాల మోలార్ ఎంథాల్పీలా ఆధారంగా చర్యోష్ణం ΔrH ఎంత?
జవాబు:
ΔrH = క్రియాజన్యాల ఎంథాల్పీల మొత్తం – క్రియాజనకాల ఎంథాల్పీల మొత్తం
= ΔHp – ΔHr
ΔrH = (H(CO2) + 2 × H(H2O)) − (H(CH4) + 2H(O2))
ప్రశ్న 14.
కేవలం ఎంథాల్పీ తగ్గుదల మాత్రమే చర్య అయత్నీకృతానికి కారణం కాదు. ఎందువల్ల? [Imp.Q]
జవాబు:
కేవలం ఎంథాల్పీ తగ్గుదల అయత్నీకృతానికి తోడ్పడే అంశమే కాని ఇది అన్ని సందర్భలాలో వర్తించదు.
\(\frac{1}{2}\)N2(g) + O2(g) → NO2(g), ΔH0 = +33.2KJmole
అవిరామ స్వచ్ఛంద చర్యకు ΔH ధనాత్మకం
అవిరామ స్వచ్ఛంద చర్యకు కొన్ని సందర్భాలలో ΔH = 0.
ప్రశ్న 15.
గిబ్స్ శక్తిమార్పు ΔG కు సమతాస్థితి స్థిరాంకం K కు మధ్య సంబంధం తెలపండి.
జవాబు:
ΔG° = 2.303RT logK
ΔG = గిబ్స్ శక్తిలో మార్పు.
K = సమతాస్థితి స్థిరాంకం
ప్రశ్న 16.
ΔH°, ΔS° లు తెలిస్తే ΔG° గణించవచ్చు. ఇది నిజమా కాదా? ఎందువల్ల?
జవాబు:
ΔG° = ΔH° – TΔS’ అనే సమీకరణంను ఉపయోగించి ΔH, ΔS° తెలిస్తే ΔG° గణించవచ్చు.
ప్రశ్న 17.
సమతాస్థిరాంకం ‘K’ ని ప్రయోగశాలలో ఇచ్చిన ఉష్ణోగ్రత వద్ద ఖచ్చితంగా కొలిస్తే ΔG° ని వేరే ఏ ఉష్ణోగ్రత వద్దనన్నా కొలవవచ్చా? ఎట్లా?
జవాబు:
ΔH°, ΔS°తెలిస్తే ΔG°ను గణించవచ్చు. కావున సమతాస్థితి స్థిరాంకం (K) ను ఏ ఉష్ణోగ్రత వద్దనైనా కనుగొనవచ్చు.
సూత్రం: ΔG° = ΔH° – TΔS°
ప్రశ్న 18.
NO(g) ఉష్ణగతిక స్థిరత్వాన్ని కింది చర్యల ఆధారంగా వివరించండి.
\(\frac{1}{2}\)N2(g) + \(\frac{1}{2}\)O2(g) → NO(g), ΔH° = 90KJ mol-1
NO(g) + \(\frac{1}{2}\)O2(g) → NO2(g); ΔH° = =74KJmol-1
జవాబు:
\(\frac{1}{2}\)N2(g) + \(\frac{1}{2}\)O2(g) → NO(g), ΔH° = 90KJ mol-1
NO(g) + \(\frac{1}{2}\)O2(g) → NO2(g); ΔH° = −74KJmol -1
NO ఏర్పడుట ఉష్ణగ్రాహక చర్య. ఇది అవిరామం (spontaneous process) గా జరుగును
NO2 ఏర్పడుట ఉష్ణమోచక చర్య. కావున NO(g) ఉష్ణగతిక పరంగా సాపేక్షంగా అస్థిరంగా ఉంటుంది.
![]()
ప్రశ్న 19.
2Cl(వా)+Cl2(వా), చర్యకు ΔH, ΔS ల గుర్తులు ఇవ్వండి.
జవాబు:
ΔH: ఋణాత్మకం. దీనికి కారణం బంధం ఏర్పడినపుడు శక్తి విడుదలవుతుంది.
ΔS: ఋణాత్మకం. దీనికి కారణం పరమాణువులు కలిసి అణువులుగా ఏర్పడినపుడు ఏంట్రోపి తగ్గుతుంది.
ప్రశ్న 20.
గిబ్స్ శక్తిని వివరించండి.
జవాబు:
ఒక ప్రక్రియలో ఏ ఉష్ణగతిక ధర్మంలోని తగ్గుదల వ్యవస్థ చేయగల ఉపయోజిత పనిని తెలుపుతుందో అట్టి ధర్మాన్ని గిబ్స్ శక్తి లేదా గిబ్స్ ప్రమేయం అంటారు.
ΔG – ΔH – TΔS
ΔG ఋణాత్మకం అయితే నిరంతరం ప్రక్రియను సూచించును.
ΔG = ΔH – TΔS
Ex: ΔG = ఋణ విలువ, అయత్నీకృత చర్యలకు, (ΔG < 0)
ΔG = ధన విలువ, అయత్నీకృతం కాని చర్యలకు, (ΔG > 0)
ΔG = 0, సమతాస్థితి చర్యలకు (ΔG = 0)
ప్రశ్న 21.
గిబ్స్ సమీకరణం వ్రాయుము.
జవాబు:
ΔG = ΔH – TΔS
ఇక్కడ
ΔG = గిబ్స్ శక్తిలో మార్పు
ΔH = ఎంథాల్ఫీ మార్పు
ΔS = ఎంట్రోపి మార్పు
T = కెల్విన్ ఉష్ణోగ్రత.
ప్రశ్న 22.
ఎంట్రోపి అనగానేమి? [AP 22] [TS 16]
జవాబు:
ఒక వ్యవస్థలోని అణువుల క్రమరాహిత్యాన్ని లేదా అనియత స్వభావాన్ని కొలిచేదే ఎంట్రోపి.
ప్రశ్న 23.
రెండు లీటర్ల ఘనపరిమాణం గల ఒక ఆదర్శ వాయువు సమోష్ణక విధానంలో ఇరవై లీటర్లలో ఘనపరిమాణం వరకు శూన్యంలోకి వ్యాకోచించింది. వాయువు పీడనం పది అట్మాస్పియర్లయితే ఈ వ్యాకోచంలో గ్రహించిన ఉష్ణమెంత.
జవాబు:
సూత్రం: q = -w = Pex (v2 – v1)
v2 = 20 lit, v1 = 2 lit
శూన్యంలోకి వాయువు వ్యాకోచం, Pex = 0
∴ q = -w = 0(20 – 2) = 0
అంటే పని జరగదు. అదే విధంగా ఉష్ణం గ్రహింపబడదు.
ప్రశ్న 24.
పై సమస్యనే తీసుకొని వాయువు వ్యాకోచం శూన్యంలోకి కాకుండా బాహ్యపీడనం ఒక అట్మాస్పియర్ అయినప్పుడు q, w లను తెలపండి.
జవాబు:
Pex = 1 atm
V2 = 20 lit V1 = 2 lit
q = -w = Pex (V2 – V1)
∴ q = -w = 1 (20 – 2) = 18 lit atm.
ప్రశ్న 25.
పై వ్యాకోచాన్ని ఉత్రమణీయంగా జరిపితే గ్రహించే ఉష్ణం జరిగే పనిని తెలపండి.
జవాబు:
V1 = 2 lit V2 = 20 lit
ఉత్రమణీయ సమోష్ణక వ్యాకోచం, qF – w = 2.303 nRT log\(\frac{V_2}{V_1}\)
nRt = PV = 10 × 2 = 20
∴ q = -w = 2.303 × 20 log\(\frac{20}{2}\)
= 46.06 lit atm.
![]()
ప్రశ్న 26.
ఆక్సిజన్ ఓజోన్గా మార్చే చర్య \(\frac{3}{2}\) O2(g) → O3(g) కు 298 K. వద్ద Kp విలువ 2.47 × 10-29. అయితే ఈ చర్యకు ΔG° గణించండి.
జవాబు:
Kp = 2.43 × 10-29
R = 8.314 J mol-1K-1
T = 298K
కాబట్టి ΔG°
= -2.303 RT log Kp
= -2.303 × 8.314 × 298 × log 2.43 × 10-29
= 16300 J.mol-1 = 163KJ mol-1
ప్రశ్న 27.
ఒక ప్రక్రియలో 701J ల ఉష్ణం వ్యవస్థ గ్రహించగా వ్యవస్థ 394J పనిని చేసింది. వ్యవస్థ అంతరిక శక్తి మార్పు ఎంత?
జవాబు:
q = 701J, w = -394J
ఉష్ణగతిక శాస్త్రం మొదటి నియమం నుండి
ΔU = q + w = 701 – 394 = 307 J
అంతరిక శక్తి మార్పు = 307 J
ప్రశ్న 28.
సయనమైడ్, డైఆక్సిజన్ల మధ్య బాంబ్ కెలోరిమీటర్ లో 298 K వద్ద చర్య జరిగితే ΔU = -742.7Kjmol-1 ఇదే ఉష్ణోగ్రత వద్ద ఎంథాల్పీ మార్పు ఎంత?
NH2CN(s) + \(\frac{3}{2}\)O2(g) → N2(g) + CO2(g) + H2O(l)
జవాబు:
NH2CN(s) + \(\frac{3}{2}\)O2(g) → N2(g) + CO2(g) + H2O(l)
Δn = nP – nR = 2 – \(\frac{3}{2}=\frac{1}{2}\)
R = 8.314 × 10-3 KJ mol-1K-1
T = 298K
ΔU = -724.7 KJmol-1K-1
ΔΗ = AU + AnRT= -724.7 + \(\frac{1}{2}\) × 8.314 × 10-3 × 298
= -724.7+ 1.238 = -741.46 kJmol-1.
ప్రశ్న 29.
C(ఘ)ను CO2 మార్చడానికి దహనక్రియ ఎంథాల్పీ – 393.5 kJmol-1 కార్బన్, డై ఆక్సిజన్ వాయువు నుంచి 35.2 g CO2 ఏర్పడినప్పుడు విడుదలయ్యే ఉష్ణశక్తి ఎంత? [TS 15]
జవాబు:
C + O2 → CO2, ΔH = -393.5kJmol-1
44గ్రా. . CO2 = 393.5kJmol-1.
35.2గ్రా. CO2 = 393.5×35.2 44 = 314.8 kJmol-1.
ప్రశ్న 30.
CO(వా), CO2(వా), N2O(వా) N2O4(వా)ల సంఘటన ఎంథాల్పీలు వరసగా -110, -393, 81, 9.7 kJmol-1 కింది చర్య ΔH విలువ కనుక్కోండి.
N2O4(g) + 3CO(g) → N2O(g) + 3CO2(g).
జవాబు:
N2O4(g) + 3CO(g) → N2O(g) + 3CO2(g)
ΔΗ = క్రియాజన్యాల మొత్తం ఎంథాల్పీ – క్రియాజనకాల మొత్తం ఎంథాల్పీ..
= (HN2O + 3HCO2) – (HN2O4 + 3HCO)
= ( 81 + 3 x −393) – (9.7 + 3 x -110)
= (81 – 1179) – (9.7-330) = -777.7 kJ mol-1.
ప్రశ్న 31.
298K వద్ద 2A + B → C చర్యకు ΔH = 400kJmol-1 ΔS = 0.2kJmol-1 ఉష్ణోగ్రతా విస్తృతిలో ΔH, ΔS లు స్థిరంగా ఉంటాయనుకొంటే ఏ ఉష్ణోగ్రత వద్ద చర్య అయత్నీకృతం అవుతుంది?
జవాబు:
ΔG = ΔH – TΔS
![]()
2000K వద్ద ఈ చర్య సమతాస్థితిని పొందును మరియు దీని కంటే ఎక్కువ ఉష్ణోగ్రత వద్ద అవిరామ స్వచ్ఛంద చర్యగా మారును.
ప్రశ్న 32.
CH3OH (ద్ర) ప్రమాణ సంఘటన ఎంథాల్పీని కింది చర్యల ద్వారా గణించండి.
CH3OH(l) + \(\frac{3}{2}\)O2(g) → CO2(g) + 2H2O(l), ΔH°r = -726kJmol-1
C(graphite) + O2(g) → CO2(g), ΔH°c = -393kJmol-1
H2(g) + \(\frac{1}{2}\)O2(g) → H2O(l); ΔH°f = -286kJmol-1.
జవాబు:
CH3OH(l) + \(\frac{3}{2}\)O2(g) → CO2(g) + 2H2O(l), ΔH°r = -726kJmol-1 ——(1)
C(graphite) + O2(g) → CO2(g), ΔH°c = -393kJmol-1 ——(2)
H2(g) + \(\frac{1}{2}\)O2(g) → H2O(l); ΔH°f = -286kJmol-1. ——(3)
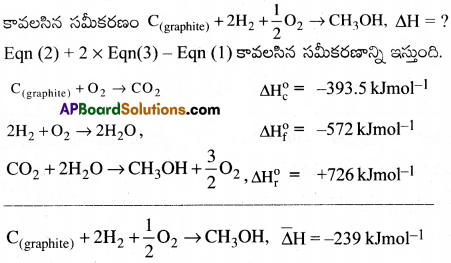
ప్రశ్న 33.
ఒక చర్యకు 300K సమతాస్థితి స్థిరాంకం 10. దీనికి ΔG0 విలువ ఎంత? R = 8.314 JK-1mol-1.
జవాబు:
సూత్రం ΔG0 = RT/nK
ΔG0 = – 2. 303 RTlog K
ΔG0 = -2.303 × 8.314 × 300 × log 10 = -5744J/mole = – 5.744 kJ mol-1
ప్రశ్న 34.
పరమ ఎంట్రోపి అనగా నేమి?
జవాబు:
ప్రమాణ స్థితులు 298K మరియు 1 అట్మాస్పియర్ పీడనము వద్ద ఒక మోల్ పదార్ధము లేదా అయాన్ యొక్క ఎంట్రోపిని పరమ ఎంట్రోపి అంటారు. పరమ ఎంట్రోపి (S°)ని, విలువల ఆధారముగా లెక్కగడతారు.
కొన్ని పదార్ధముల పరమ ఎంట్రోపీలు క్రింద ఇవ్వబడినవి.
| పదార్దము | S° విలువ(JK-1 mol-1) |
| గ్రాఫైట్ | 5.7 |
| డైమంట్ | 2.4 |
| H2O (ద్రవం) | 69.9 |
| H2O (వాయువు) | 188.8 |
![]()
ప్రశ్న 35.
ఎంథాల్ఫి (H) వివరించుము. CaCO3(s) → CaO(s) + CO2(g) కు (ΔH – ΔE) ఎంత? [IPE ‘11,14]
జవాబు:
స్థిర ఉష్ణోగ్రతా పీడనాల వద్ద ఒక వ్యవస్థ, పరిసరాలతో ‘వినిమయం చేసుకొన్న ఉష్ణరాశి పరిమాణాన్ని ఎంథాల్ఫీ అంటారు.
H = E + PV
‘H’ యొక్క పరమ విలువను ప్రయోగం ద్వారా నిర్ణయించలేము.
ఒక రసాయన చర్యలో ఎంథాల్ఫీ మార్పును (ΔH) ప్రయోగం ద్వారా ప్రత్యక్షంగా నిర్ణయించగల్గుతాము.
ΔH = [Hక్రియాజన్యాలు – Hక్రియాజనకాలు]
CaCO3(s) → CaO(s) + CO2(g)
Δn = వాయురూపంలో ఉండే క్రియాజన్య అణువుల సంఖ్య – వాయురూపంలో ఉండే క్రియాజనక అణువుల సంఖ్య = 1 – 0 = 1
సూత్రం: ΔH = ΔE + ΔnRT ∴ ΔH – ΔE = ΔnRT = 0(RT) = 0
ప్రశ్న 36.
ఈ క్రింది పదాలను ఉదాహరణలతో వివరించుము [Mar’ 09][AP 22]
1) సంశ్లేషణోష్ణం 2) దహనోష్ణం 3) ద్రావణీయతోష్ణం
జవాబు:
సంశ్లేషణోష్టం :
ప్రమాణస్థితిలో ఒక మోల్ పదార్ధం ప్రమాణస్థితిలో ఉన్న దాని ఘటక మూలకాల నుండి ఏర్పడినపుడు విడుదలయిన లేదా గ్రహించబడిన ఉష్ణాన్ని సంశ్లేషణోష్ణం అంటారు.
ఉదా: C(graphite) + O2(g) → CO2(g); ΔH = -393.5KJ
\(\frac{1}{2}\)N2(g) + \(\frac{1}{2}\)O2(g) → NO(g); ΔH = +90.4KJ
దహనోష్ణం:
ఒక మోల్ పదార్ధము పూర్తిగా ఆక్సిజన్ లేదా గాలిలో మండినపుడు విడుదలయ్యే ఉష్ణాన్ని దహనోష్ణం అంటారు.
ఉదా: CH4(g) + 2O2(g) → CO2(g) + 2H2O(g); ΔH = -890.8KJ
C(s) + O2(g) → CO2(g); ΔH= -393.5KJ
ద్రావణీయతోష్ణం :
ఒక మోల్ పదార్ధమును అధిక ద్రావణిలో కరిగించినపుడు విడుదలైన లేదా గ్రహించబడిన ఉష్ణాన్ని ద్రావణీయత ఉష్ణం అంటారు.
ఉదా: KCl(s) + H2O → KCl(aq); ΔH = +19.75KJ
HCl (g) + H2O→ HCl(aq); ΔH = -75.40KJ
![]()
ప్రశ్న 37.
తటస్థీకరణోష్ణం అనగానేమి? ఈ విలువ ఆమ్లము, క్షారముల యొక్క రసాయన స్వభావము పై ఆధారపడి ఎట్లు మారును? ఉదాహరణనిమ్ము. [Mar’09]
జవాబు:
తటస్థీకరణోష్ణం:
ఒక గ్రాము తుల్యభారము గల ఆమ్లం, ఒక గ్రాము తుల్యభారము గల క్షారముతో పూర్తిగా తటస్థీకరణం చెందినపుడు విడుదలయ్యే ఉష్ణాన్ని తటస్థీకరణోష్ణం అంటారు.
- తటస్థీకరణం ఎల్లపుడు ఉష్ణమోచకము.
- విడుదలయ్యే ఉష్ణపరిమాణము ఆమ్లం లేదా క్షారముల యొక్క బలాల మీద మరియు వాటి అయనీకరణ అవధుల మీద ఆధారపడి ఉండును.
బలమైన ఆమ్లము బలమైన క్షారములు జలద్రావణములో పూర్తిగా అయనీకరణము చెంది ఉండును. కనుక వాటి తటస్థీకరణ ఉష్ణం ఎల్లప్పుడు 57.3KJ గా ఉండును.
ఉదా : HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l); ΔH = – 57.3KJ
ఆమ్లము కాని క్షారము కాని లేదా రెండూకాని బలహీనమైనచో అవి పూర్తిగా అయనీకరణము చెందవు కనుక వాటి మధ్య తటస్థీకరణ ఉష్ణం 57.3KJ కన్న తక్కువగా ఉండును.