Students get through AP Inter 1st Year Chemistry Important Questions 8th Lesson హైడ్రోజన్ – దాని సమ్మేళనాలు which are most likely to be asked in the exam.
AP Inter 1st Year Chemistry Important Questions 8th Lesson హైడ్రోజన్ – దాని సమ్మేళనాలు
Very Short Answer Questions (అతిస్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
హైడ్రోజన్ ఐసోటోపులు మూడు వాటి చర్యావేగాల్లో భేదపడతాయి. కారణాలు తెలపండి.
జవాబు:
బంధ విచ్ఛేదక ఎంథాల్పీలో భేదం వలన హైడ్రోజన్ మూడు ఐసోటోపులు వాటి చర్యావేగాల్లో భేదపడతాయి.
ప్రశ్న 2.
అధిక ద్రవీభవన స్థానాలున్న లోహాలను వెల్డింగ్ చేయడానికి డైహైడ్రోజనన్ను ఎందుకు వాడతారు?
జవాబు:
వెల్డింగ్ చేయడానికి, కటింగ్ చేయడానికి పరమాణు హైడ్రోజన్ టార్చ్, ఆక్సీ -హైడ్రోజన్ టార్చ్ ను ఉపయోగిస్తారు. విద్యుత్ ఛాపం సహాయంతో హైడ్రోజనన్ను విఘటనం చేస్తే పరమాణు హైడ్రోజన్ పరమాణువులు వస్తాయి. వీటిని వెల్డింగ్ చేయవలసిన పదార్థ తలం పై పునః సంయోగం చెందించి 4000K ఉష్ణోగ్రతను పుట్టించవచ్చు.
ప్రశ్న 3.
అత్యంత శుద్ధమైన డైహైడ్రోజను తయారుచేయడానికి ఒక పద్ధతిని వివరించండి.
జవాబు:
అత్యంత శుద్ధమైన డై హైడ్రోజన్ ను వేడి Ba(OH)2 ద్రావణాన్ని నికెల్ విద్యుద్భటాల మధ్య విద్యుద్విశ్లేషణ చేసి పొందవచ్చు. ఇచ్చట 99.95% శుద్ధమైన H2 ఏర్పడును.
![]()
ప్రశ్న 4.
“సిన్ గ్యాస్” పదాన్ని వివరించండి.
జవాబు:
CO, H2 ల మిశ్రమాన్ని “వాటర్ గ్యాస్” అంటారు. దాన్ని మిథనోలు, ఇతర హైడ్రోకార్బన్లను తయారుచేయడానికి వాడతారు. దాన్ని “సింథటిక్ గాస్” లేదా “సిన్గాస్” అని కూడా అంటారు.
ప్రశ్న 5.
“కోల్ గాసిఫికేషన్” అంటే ఏమిటి? దానిని సరైన, తుల్య సమీకరణంతో వివరించండి. [TS 19]
జవాబు:
కోలు ఉపయోగించి ఉష్ణోగ్రత వద్ద సిన్ గ్యాస్ ను తయారుచేయుటను కోల్ గ్యాసిఫికేషన్ అంటారు.
![]()
![]()
ప్రశ్న 6.
హైడ్రైడ్ అంటే నిర్వచనం చెప్పండి. ఎన్ని రకాల హైడ్రేడ్లున్నాయి? వాటి పేర్లను చెప్పండి. [AP 22]
జవాబు:
డైహైడ్రోజన్,జడవాయువులు మినహా దాదాపు అన్ని మూలకాలతోను ప్రత్యేక పరిస్థితులలో సంయోగం చెంది ద్విగుణాత్మక సమ్మేళనాలను ఏర్పరుస్తుంది. వీటిని హైడ్రైడ్లంటారు. హైడ్రైడ్లను మూడు రకాలుగా వర్గీకరించవచ్చు:
a) అయానిక లేదా సెలైన్ లేదా లవణ సదృశ హైడ్రైడ్లు
b) కోవలెంట్ లేదా అణుహైడ్రైడ్లు
c) లోహ లేదా నాన్-స్థాయికియోమెట్రిక్ హైడ్రైడ్లు
ప్రశ్న 7.
ద్రవీకృత ప్రావస్థలో నీటికి అసాధారణ లక్షణం ఉంటుంది. అది నీటి అధిక భాష్పీభవనోష్టానికి దారితీస్తుంది. ఆ ధర్మం ఏమిటి?
జవాబు:
నీటిలో అంతర అణుక హైడ్రోజన్ బంధాలు కలవు. ఈ అసాధారణ ధర్మం నీటికి అధిక ఘనీభవన స్థానం, బాష్పీభవన స్థానం మరియు అధిక బాష్పీభవనోష్టానికి దారితీస్తుంది.
ప్రశ్న 8.
కిరణజన్య సంయోగక్రియ జరుగుతున్నప్పుడు నీరు O్కగా ఆక్సీకరణం చెందుతుంది. అయితే ఏ మూలకం క్షయకరణం చెందుతుంది?
జవాబు:
కిరణజన్య సంయోగక్రియలో కార్బన్ యొక్క ఆక్సీకరణ స్థితి + 4 నుండి ‘0’కు తగ్గును. కావున కార్బన్ క్షయకరణం చెందినదిగా చెప్పవచ్చును.
![]()
ప్రశ్న 9.
“స్వయం ప్రోటోలసిస్” అంటే మీకేమి తెలుస్తుంది? నీటి స్వయం ప్రోటోలసిసికి సమీకరణాన్ని రాయండి.
జవాబు:
నీటి స్వయం అయనీకరణాన్ని “ఆటో ప్రోటోలసిస్” అంటారు. నీటి ఆటో ప్రోటోలసిస్ క్రింది విధంగా జరుగుతుంది.
H2O(l) + H2O(l) → H3O+(aq) + OH–(aq)
ప్రాముఖ్యత:
పై చర్యల నుండి, నీరు ఆమ్లంగాను అదేవిధంగా క్షారంగాను పనిచేస్తుందని తెలియుచున్నది. ఆ విధంగా, నీరు ద్వంద స్వభావంగా పనిచేస్తుంది.
ప్రశ్న 10.
బ్రాన్ స్టెడ్ సిద్ధాంతపరంగా నీరు ద్విస్వభావం గల పదార్థం. దానిని మీరు ఎట్లా వివరిస్తారు?
జవాబు:
బ్రాన్ స్టెడ్ సిద్ధాంతం ప్రకారం నీరు స్వయం ప్రోటాలిసిస్ వలన ద్విస్వభావాన్ని కలిగి ఉండును.
Ex: 1) H2O + HCl ⇌ H3O+ + Cl–
పై చర్యలో HCl నుండి H2O ఒక ప్రోటాన్ ను గ్రహించినది. కావున H2O క్షారంగా ప్రవర్తించును.
2) H2O + NH3 ⇌ NH4+ + OH–
పై చర్యలో H2O NH3.కు ఒక ప్రోటాన్ న్ను దానం చేసినది. కావున H2O ఆమ్లంగా ప్రవర్తించును.
![]()
ప్రశ్న 11.
నీటి కాఠిన్యత అనగానేమి? నీటి కాఠిన్యతకు గల కారణం ఏమిటి ? [May’13, Mar’11,09][AP 15]
జవాబు:
సబ్బు ద్రావణంతో స్థిరమయిన నురగను త్వరగా ఇవ్వని నీటి లక్షణాన్ని నీటి కాఠిన్యత అంటారు.
నీటిలో కాల్షియం,మెగ్నీషియంల బైకార్బొనేట్లు, క్లోరైడ్ లు, సల్ఫేట్లు కరిగి వుండటం వల్ల నీటికి కఠినత్వం వస్తుంది.
ప్రశ్న 12.
డ్యుటిరాలసిస్ అనగానేమి? దీనికి ఒక సమీకరణాన్ని ఇవ్వండి? [Mar’ 10, May’ 09]
జవాబు:
భార జలం కొన్ని మూలక లవణాలతో చర్య జరిపి ఒక డ్యుటిరేటెడ్ ఆమ్లము మరియు ఒక క్షారముగా వియోగము చెందును. ఈ చర్యను డ్యుటిరాలసిస్ అంటారు.
AlCl3 + 3D2O → Al(OD)3 + 3DCl
ప్రశ్న 13.
భారజలం D2O యొక్క ఉపయోగాలను వ్రాయండి? [Mar’10]
జవాబు:
- న్యూక్లియర్ రియాక్టర్లలో సాధారణంగా న్యూట్రాన్ల మితకారిగా D2O ను వాడతారు.
- D2O ను రసాయన క్రియలలో చర్యా విధానాలను అధ్యయనం చేయడానికి ట్రేసర్ సమ్మేళనంగా ఉపయోగిస్తారు.
- భార హైడ్రోజన్ ను తయారుచేయుటలో D2O ను ఉపయోగిస్తారు.
ప్రశ్న 14.
D2O యొక్క ద్రవీభవన, బాష్పీభవన స్థానాలను చెప్పండి?
జవాబు:
D2O బాష్పీభవన స్థానం 276.8 K మరియు ద్రవీభవన స్థానం 374.4K.
ప్రశ్న 15.
H2O2 యొక్క నాలుగు ఉపయోగాలను వ్రాయండి? [TS 19]
జవాబు:
- వైద్యరంగంలో శస్త్ర చికిత్సలో యాంటీ సెప్టిక్ గాను, గాయాలను శుభ్రపరుచుటకు H2O2ను ఉపయోగిస్తారు.
- రాకెట్లలో ఇంధనంయొక్క ఆక్సిడెంట్ కొరకు H2O2ను ఉపయోగిస్తారు.
- సిల్క్, ఉన్ని, ఏనుగు దంతాలను విరంజనం చేయడానికి H2O2 ను ఉపయోగిస్తారు.
- ప్రయోగశాలలో ఆక్సీకరణ కారకంగాను H2O2ను ఉపయోగిస్తారు.
ప్రశ్న 16.
నీటి శాశ్వత కఠినత్వాన్ని తొలగించడానికి వాడే కాల్గన్ పద్ధతి వ్రాయండి. [AP 22][May’13][AP 15]
జవాబు:
సోడియం హెక్సా మెటాఫాస్ఫేట్ (Na6P6O18)ని వ్యాపార సరళిలో “కాల్గన్’ అంటారు. దీనిని కఠిన జలానికి కలిపినప్పుడు క్రింది చర్యలు జరుగుతాయి.
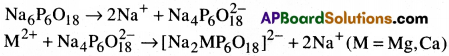
సంక్లిష్ట ఆనయాన్ Mg2+, Ca2+ అయాన్లను ద్రావణంలో ఉంచుతుంది.
Short Answer Questions (స్వల్ప సమాధాన ప్రశ్నలు)
ప్రశ్న 1.
భారజలం పై ఒక వ్యాఖ్యను రాయండి.
జవాబు:
డ్యుటీరియం ఆక్సైడ్ను (D2O) భారజలం అంటారు.
తయారీ:
భారజలాన్ని సాధారణ జలమును విద్యుద్విశ్లేషణ చేసి పొందవచ్చు.
మోలార్ ద్రవ్యరాశి, ద్రవీభవన స్థానం, బాష్పీభవన స్థానం లాంటి భౌతిక ధర్మాలు భారజలంకు నీటి కంటే ఎక్కువగా ఉంటాయి.
కానీ డై ఎలక్ట్రిక్ స్థిరాంకం, ద్రావణీయత భారజలంకు నీటి కంటే తక్కువ.
రసాయన ధర్మాలు:
(a)భారజలం కాల్షియం కార్బైడ్తో చర్య జరిపి డ్యూటురొఎసిటిలిన్ ఏర్పరుచును.
CaC2 + 2D2O → C2D2 + Ca(OD)2
(b) భారజలం సల్ఫర్ ట్రైఆక్సైడ్ తో చర్య జరిపి డ్యూటుకొసల్ఫూరిక్ ఆమ్లంను ఏర్పరుచును.
SO3 + D2O → D2SO4
(c) భారజలం అలూమినియం కార్బైడ్ తో చర్య జరిపి డ్యూటురొమీథేన్ న్ను ఏర్పరుచును.
Al4C3 + 12D2O → 3CD4 + 4Al(OD)3
ఉపయోగాలు:
- దీనిని న్యూక్లియర్ రియాక్టర్లలో మితకారిగా ఉపయోగిస్తారు.
- దీనిని చర్యా విధానాల అధ్యయనంలో వినిమయకారకంగా ఉపయోగిస్తారు.
- దీనిని డ్యూటిరియం సమ్మేళనాలను తయారు చేయుటకు ఉపయోగిస్తారు.
![]()
ప్రశ్న 2.
ఆవర్తన పట్టికలో హైడ్రోజన్ స్థానాన్ని దాని ఎలక్ట్రాన్ విన్యాసపరంగా చర్చించండి. [AP 20]
జవాబు:
హైడ్రోజన్ యొక్క ఎలక్ట్రాన్ విన్యాసం1s¹. ఈ విన్యాసం మూలంగా అది క్షారలోహాలు మరియు హాలోజన్లు రెండింటి వలె ప్రవర్తించును. కావున దానిని (IA) గ్రూపులోనూ లేదా హాలోజన్ గ్రూపు (VIIA) లోనూ ఉంచవచ్చును.
హైడ్రోజన్ ను (IA) గ్రూపులో ఉంచుటకు గల కారణాలు:
a. హైడ్రోజన్ ఎలక్ట్రాన్ 1s ఆర్బిటాల్లో ప్రవేశించటం వలన దానిని IA గ్రూప్ మూలకాలతోనే కలపవచ్చు.
b. హైడ్రోజన్ ఒక ఎలక్ట్రాన్ను పోగొట్టుకుని ఏకమాత్ర ధనావేశిత అయాన్ను ఇస్తుంది. క్షారలోహాలు కూడా ఎలక్ట్రాన్ను పోగొట్టుకుని ఏకమాత్ర ధనావేశిత అయానన్ను ఇస్తాయి. కాబట్టి హైడ్రోజనన్ను (IA) గ్రూప్ మూలకాలతో కలపవచ్చు.
c. ఆవర్తన పట్టికను కనిష్ట పరమాణు సంఖ్య (Z = 1) ఉన్న మూలకంతో ప్రారంభించటం తార్కికంగా ఉంటుంది.కావున హైడ్రోజన్ ను(IA) గ్రూప్ లో ఉంచవలెను.
హైడ్రోజన్ న్ను (VIA) గ్రూపులో ఉంచుటకు గల కారణాలు:
a. క్లోరిన్ లేదా ఫ్లోరిన్ వలె హైడ్రోజన్ ఒక వాయు పదార్థం.
b. హాలోజన్ల వలె అది ద్విపరమాణు అణువును ఏర్పరుచును.
c. హైడ్రోజన్ ఒక ఎలక్ట్రాను కలుపుకుని ఏకమాత్ర ఋణావేశిత అయానన్ను ఇస్తుంది. అందువలన దానిని ఏకమాత్ర ఋణావేశిత అయాన్ను ఇచ్చే హాలోజన్ (VIIA) గ్రూప్ కూడా కలపవచ్చు.
హైడ్రోజన్ క్షారలోహాల వలె ఎలక్ట్రాను కోల్పోయే స్వభావం లేదా హాలోజన్ల వలె ఒక ఎలక్ట్రాన్ను కలుపుకునే స్వభావాన్ని బలంగా ప్రదర్శించదు. కావున హైడ్రోజనన్ను నిర్దిష్టంగా వీటిలో ఒక గ్రూపులో ఉంచుట భావ్యం కాదు.
ప్రశ్న 3.
NH3; H2O, HF ల బాష్పీభవన స్థానాలు, ఆయా గ్రూపుల్లో వాటి తరువాత మూలకాల హైడ్రైడ్ల భాష్పీభవన స్థానాలకంటే ఎక్కువగా ఉంటాయి. మీ కారణాలు చెప్పండి.
జవాబు:
NH3, H2O, HF ల బాష్పీభవన స్థానాలు, ఆమ్ల గ్రూపుల్లో వాటి తరువాత మూలకాల హైడ్రైడ్ బాష్పీభవన స్థానాల కంటే ఎక్కువగా ఉంటాయి.
కారణాలు:
NH3, H2O మరియు HF లు ఎలక్ట్రాన్లు అధికంగా గల హైడ్రైడ్లు వీటిలో N,O, F లపై 1, 2, 3 ఒంటరి ఎలక్ట్రాన్ జంటలు గలవు.
అధిక ఋణవిద్యుదాత్మకత మూలకాలపై ఒంటరి ఎలక్ట్రాన్ జంటలుండుట వలన హైడ్రోజన్ బంధాలు ఏర్పడతాయి. ఈ హైడ్రోజన్ బంధాలు ఏర్పడుట వలన ఈ హైడ్రైడ్లకు అధిక బాష్పీభవన స్థానాలుంటాయి.
ప్రశ్న 4.
(a) క్లోరిన్ (b) సోడియం లోహంలతో డైహైడ్రోజన్ చర్య జరిపితే ఏమవుతుంది? వివరించండి.
జవాబు:
(a) డైహైడ్రోజన్తో క్లోరిన్ చర్య:
డై హైడ్రోజన్ క్లోరిన్ తో చర్య జరిపి హైడ్రోజన్ క్లోరైడ్ను ఏర్పరచును. ఈ చర్య సూర్యకాంతి సమక్షంలో జరుగును.
![]()
(b) సోడియం లోహంతో చర్య:
డై హైడ్రోజన్ అధిక చర్యశీలత గల సోడియంతో చర్య జరిపి సోడియం హైడ్రైడ్ను ఏర్పరచును.
![]()
ప్రశ్న 5.
విలీన H2O2 ద్రావణాన్ని గాఢపరిచేందుకు ముఖ్యాంశాలను తెల్పండి?
(లేదా)
1% H2O2 ద్రావణాన్ని మీకు ఇచ్చాం. దాని నుంచి శుద్ధ H2O2 ని తయారుచేయడానికి మీరు ఏమి చర్యలను తీసుకుంటారు?
జవాబు:
H2O2 ద్రావణాన్ని 3 దశలలో గాఢపరుస్తారు.
1 వ దశ : ద్రావణాన్ని జాగ్రత్తగా బాష్పీభవనం చేయడం :
విలీన H2O2 ద్రావణాన్ని అల్ప పీడనాల వద్ద నీటి తాపడంపై జాగ్రత్తగా బాష్పీభవనం చేస్తారు. 20 నుండి 30% H2O2 ద్రావణం ఏర్పడుతుంది.
2 వ దశ : అల్ప పీడనాల వద్ద స్వేదనం చేయడం :
20% – 30% H2O2 ద్రావణాన్ని స్వేదనం కుప్పెలో 15 మి.మీ అల్పపీడనం వద్ద వేడి చేస్తారు. 90% H2O2 ఏర్పడుతుంది.
3 వ దశ : స్పటీకీకరణం చేయడం :
ఘన CO2, ఈథర్ మిశ్రమాన్ని ఉపయోగించి చల్లబరిస్తే H2O2 స్ఫటీకీకరణం చెందుతుంది. దీని నుంచి 100% శుద్ధ, సూది లాంటి ఆకృతి గల H2O2 స్పటికాలు వేరవుతాయి.
![]()
ప్రశ్న 6.
“వాటర్ గ్యాస్ షిఫ్ట్” చర్య అంటే ఏమిటి? ఈ చర్యతో హైడ్రోజన్ తయారీని ఎట్లా పెంచగలరు?
జవాబు:
వాటర్ గ్యాస్ షిఫ్ట్ చర్య:
సిన్ గ్యాస్ మిశ్రమంలోని కార్బన్ మోనాక్సైడ్ను ఐరన్ క్రోమేట్ ఉత్ప్రేరకం సమక్షంలో నీటి ఆవిరితో చర్యనొందించి హైడ్రోజన్ ను ఎక్కువగా ఉత్పత్తి చేసుకోవచ్చు.
![]()
పై చర్యలో CO2(g)ను తొలగించినపుడు పురోగామి దిశలో చర్య జరుగును. కావున దీనిని వాటర్ గ్యాస్ షిఫ్ట్ చర్య అంటారు.
ప్రశ్న 7.
సంశ్లేషిత రెజిన్ పద్ధతి, ఇయాన్ వినిమయ రెజిన్ పద్ధతుల్లో జలకాఠిన్యతను తొలగించడానికి ఉపయోగించే సూత్రాన్ని పద్ధతిని చర్చించండి.
జవాబు:
కరిగి వున్న ఖనిజ లవణాలన్నింటిని తీసివేసిన నీటిని “డీ అయొనైజ్డ్ వాటర్” అంటారు. దీనిని తయారుచేయడానికి కఠిన జలాన్ని ‘కాటయాన్, ఆనయాన్ వినిమయ రెజిన్ల’ ద్వారా పంపుతారు.
అయాన్ వినిమయ పద్ధతిలో నీటిని శుద్ధపరుచుట :
సూత్రం:
అయాన్ వినిమయ పద్ధతి ద్వారా కఠిన జలంలో ఉన్న అన్ని కాటయాన్ మరియు ఆనయాన్లను తొలగించటం జరుగుతుంది. కాటయాన్ వినిమయ రెజీన్లో బృహద్ కార్బన్ అణువులు, – COOH సమూహాలుంటాయి. ఈ రెజిన్, నీటి నమూనాలో వున్న Ca2+, Mg2+, Na+ వంటి కాటయాన్లను తొలగిస్తుంది.
i) కఠిన జలాన్ని మొదటగా కాటయాన్ వినిమయ రెజిన్ వున్న తొట్టె గుండా పంపుతారు. అప్పుడు కఠిన జలంలోని కాటయాన్లు తొలగును. మరియు H+ అయాన్ విడుదల అగును.
2RCOOH + Ca2+ → (RCOO)2Ca + 2H+ ……(i)
ii) H+ అయాన్లు వున్న నీటిని ఆనయాన్ వినిమయ రెజిన్ వున్న ట్యాంక్లో నింపుతారు. ఇక్కడ, నీటిలో వున్న ఆనయాన్లు రెజిన్లోని OH– అయాన్ల తో పునఃస్థాపితమవుతాయి.
RNH3OH + Cl– → RNH3Cl + OH– ……(ii)
iii) పై దశల నుండి డీ-అయొనైజ్డ్ వాటర్ని పొందవచ్చు. ఆ విధంగా H+ + OH– → H2O
ప్రశ్న 8.
కింది చర్యలను పూర్తిచేసి, తుల్యం చేయండి:

జవాబు:
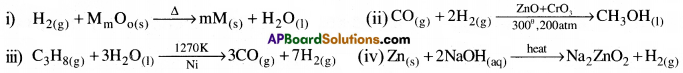
ప్రశ్న 9.
కింది రసాయన చర్యలను పూర్తి చేసి తుల్యం చేయండి.
i. PbS(s) + H2O2(ap) →
ii. MnO–4(ap) + H2O2(ap) →
iii. CaO(s) + H2O(l) →
iv. Ca3N2(s) + H2O(l) →
పై చర్యలను (a) జలవిశ్లేషణ (b) ఆక్సీకరణ -క్షయకరణ (c) హైడ్రేషన్ చర్యలుగా వర్గీకరించండి.
జవాబు:
i) H2O2 నల్లని లెడ్సల్ఫైడ్ను తెల్లని లెడ్ సల్ఫేట్గా ఆక్సీకరణం చేయును.
PbS + 4H2O2 → PbSO4 + 4H2O
ii) H2O2 ఆమ్లీకృత KMnO4 ను వర్ణరహిత మాంగనీస్ సల్ఫేట్గా క్షయకరణం చేయును.
MnO4 + 5H2O2 + 6H+ → 2Mn+2 + 5O2 + 8H2O
iii) (CaO) నీటిలో కరిగి (Ca(OH)2) ను ఇచ్చును.
CaO + H2O → Ca(OH)2
iv) కాల్షియం నైట్రైడ్ నీటితో చర్య జరిపి అమ్మోనియా వాయువును విడుదల చేయును.
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3
(i), (ii) చర్యలు రిడాక్స్ చర్యలు.
(iii), (iv) చర్యలు జలవిశ్లేషణ చర్యలు.
ప్రశ్న 10.
విద్యుద్విశ్లేషణ పద్ధతిలో H2O2ను ఏవిధంగా తయారుచేస్తారు? [Mar’10, May’10]
జవాబు:
0°C వద్ద 50% H2SO4 ద్రావణాన్ని విద్యుద్విశ్లేషణ చేయుట ద్వారా H2O2ను తయారు చేయవచ్చు.
విద్యుద్విశ్లేషణ పద్ధతిలో తయారీ :
- 50% సల్ఫ్యూరిక్ ఆమ్ల ద్రావణాన్ని పింగాణి పాత్రలో తీసుకుంటారు.
- ప్లాటినం కడ్డీని ఈ ద్రావణంలో ఉంచుతారు. ఇది ఆనోడ్గా పనిచేస్తుంది.
- లెడ్ తీగ కాథోడ్గా పనిచేస్తుంది.
- ఈ ఎలక్ట్రోడ్లను సచ్చిధ్ర విభాజక పటలంతో వేరుచేస్తారు.
- పాత్రను మంచు ముక్కలున్న మరొక పాత్రలో వుంచి ఉష్ణోగ్రత 0°C వుండేటట్లు చేస్తారు.
- విద్యుద్విశ్లేషణ జరిపితే, ఆనోడ్ వద్ద పరైడై సల్ఫ్యూరికామ్లం మరియు కాథోడ్ వద్ద H2వాయువు వెలువడును.
ఘట చర్యలు : 2H2SO4 ⇌ 2H+ + 2HSO4–
కాథోడ్ వద్ద : అయాన్ హైడ్రోజన్ వాయువుగా క్షయకరణం చెందును
2H+ + 2e– → H2 ↑
ఆనోడ్ వద్ద : బై సల్ఫేట్ అయాన్ పర్ డై సల్ఫ్యూరికామ్లంగా మారును.
2HSO–4 → H2S2O8 + 2e–
vii) పర్ డై సల్ఫ్యూరికామ్లాన్ని మార్షల్ ఆమ్లం అని అంటారు. దీనిని స్వేదన ప్రక్రియలో నీటితో చర్య జరిపి H2O2 ను ఇస్తుంది.
H2S2O8 + H2O → H2SO5 + H2SO4
H2SO5 + H2O → H2SO4 + H2O2
H2SO5 ను పర్మెనో సల్ఫ్యూరిక్ ఆమ్లం (కారోస్ ఆమ్లం) అని కూడా అంటారు.
![]()
ప్రశ్న 11.
జలకాఠిన్యత అనగానేమి? పర్ముటివ్ పద్ధతిలో నీటి కఠినత్వాన్ని ఏ విధంగా తొలగిస్తారు? [AP 18,22][TS 15,19]
జవాబు:
సబ్బు ద్రావణంతో స్థిరమయిన నురగను త్వరగా ఇవ్వని నీటిలక్షణాన్ని జల కాఠిన్యత అంటారు.
పర్ముటైట్ అనేది ఒక కృత్రిమ జియొలైట్. దీని సాధారణ ఫార్ములా Na2 Z
ఇక్కడ Z = Al2Si2O8. XH2O
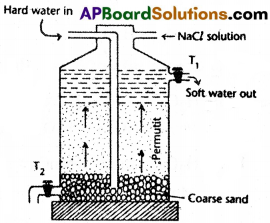
దీనిని సోడియం కార్బొనేట్, అల్యూమినా, సిలికాలను కలిపి కరిగించి తయారు చేస్తారు. అనువుగా వుండే పాత్రను పర్ముటైట్తో నింపుతారు. కాఠిన్యతను తొలగించవలసిన నీటిని ఆ పాత్రపై నుంచి పోస్తారు. కాఠిన్యతనిచ్చే కాల్షియం, మెగ్నీషియం అయాన్లను సోడియం అయాన్లు ప్రతిక్షేపిస్తాయి. మృదుజలాన్ని బహిర్మార్గం ద్వారా బయటకు పంపుతారు.
Na2 Z + Ca+2 → CaZ + 2Na+1
Na2 Z + Mg+2 → MgZ + 2Na+1
కొంత కాలం వాడిన తరువాత పర్ముటెట్ లోని సోడియం, అయాన్లతో స్థానభ్రంశంచెందించలేదు. అలా వ్యయమైపోయిన
పర్ముటైట్ను 10% NaCl ద్రావణంతో తడిపి కాల్షియం, మెగ్నీషియం క్లోరైడ్లను కడిగి వేస్తారు.
పర్ముటైట్ను పునరుద్ధరించేటప్పుడు జరిగే రసాయన చర్యలు :
Na2 Z + 2Na Cl → Na2 Z + CaCl2
MgZ + 2Na Cl → Na2 Z + MgCl2
ప్రశ్న 12.
హైడ్రోజన్ పెరాక్సైడ్ యొక్క నాలుగు ఆక్సీకరణ ధర్మాలను, సమీకరణాలతో వ్రాయండి? [TS 16,18][AP 18,19]
జవాబు:
ఆమ్ల యానకంలో:
i) H2O2 నల్లని లెడ్సల్ఫైడ్ను తెల్లని లెడ్ సల్ఫేట్గా ఆక్సీకరణం చేయును.
PbS + 4H2O2 → PbSO4 + 4H2O
ii) H2O2 ఆమ్ల యానకంలో ఫెర్రస్ సల్ఫేట్ను, ఫెర్రిక్ సల్ఫేట్గా ఆక్సీకరణం చేస్తుంది.
2FeSO4 + H2SO4 + H2O2 → Fe2(SO4)3 + 2H2O
క్షార యానకంలో:
iii) H2O2 Fe(II) లవణాలను Fe(III) లవణాలుగా ఆక్సీకరణం చెందించును.
2Fe2+ + H2O2 → 2Fe3+ + 2OH–
iv) H2O2 Mn(II) లవణాలను Mn(IV) లవణాలుగా ఆక్సీకరణం చెందించును.
Mn2+ + H2O2 → Mn4+ + 2OH–
ప్రశ్న 13.
H2O2 యొక్క నాలుగు క్షయకరణ ధర్మాలను తగు సమీకరణాలతో వ్రాయండి? [AP 17,18][TS 16,18]
జవాబు:
i) H2O2 సిల్వర్ ఆక్సైడ్ను సిల్వర్గా క్షయీకరిస్తుంది.
Ag2O + H2O2 → 2Ag + H2O + O2
ii) H2O2 క్లోరిస్కు క్లోరైడ్ గా క్షయీకరిస్తుంది.
Cl2 + H2O2 → 2HCl + O2
iii) H2O2 ఓజోన్ ను, ఆక్సిజన్ గా క్షయీకరిస్తుంది.
O3 + H2O2 → 2O2 + H2O
iv) H2O2 ఆమ్లీకృత పొటాషియం పర్మాంగనేట్ ద్రావణంతో క్షయకరణం చెంది విరంజనమవుతుంది.
2KMnO4 + 3H2SO4 + 5H2O2 → K2SO4 + 2MnSO4 + 8H22O + 5O2
ప్రశ్న 14.
కింది వాటిని సరైన ఉదాహరణలతో వివరించండి. [IPE ’14]
i. ఎలక్ట్రాన్ కొరత గల హైడ్రైడ్లు
ii. ఎలక్ట్రాన్లు కచ్చితంగా ఉన్న హైడ్రైడ్లు [AP 16]
iii. ఎలక్ట్రాన్లు అధికంగా గల హైడ్రైడ్లు [TS 17,20]
జవాబు:
i) ఎలక్ట్రాన్ కొరత హైడ్రైడ్లు:
ఏ అణు హైడ్రైడ్లలో అయితే లూయీ నిర్మాణాన్ని వ్రాయుటకు అవసరమైన వేలన్సీ ఎలక్ట్రాన్లు ఉండవో అటువంటి అణు హైడ్రైడ్లను ఎలక్ట్రాన్ కొరత హైడ్రైడ్లు అంటారు.
ఉదా: B2H6 (Diborane) 13వ గ్రూపుకు చెందిన మూలకాలన్నీ ఎలక్ట్రాన్ కొరత గల సమ్మేళనాలను ఏర్పరుచును.
ii) ఎలక్ట్రాన్లు ఖచ్చితంగా ఉన్న హైడ్రైడ్లు :
ఏ అణు హైడ్రైడ్లలో అయితే లూయీ నిర్మాణాన్ని వ్రాయుటకు సరిగా అవసరమగు వేలన్సీ ఎలక్ట్రాన్లు ఉంటాయో ఆ అణు హైడ్రైడ్లను ఎలక్ట్రాన్ ఖచ్చిత హైడ్రైడ్లు అంటారు.
ఉదా: 14 వ గ్రుపుకు చెందిన మూలకాలన్ని చతుర్ముఖీయ ఆకృతి కలిగిన (CH4), వంటి సమ్మేళనాలను ఏర్పరచును.
iii) ఎలక్ట్రాన్లు అధికంగా గల హైడ్రైడ్లు:
ఏ అణు హైడ్రైడ్లలో అయితే లూయీ నిర్మాణాన్ని వ్రాయుటకు సరిగా అవసరమగు వేలన్సీ ఎలక్ట్రాన్ల కంటే అధికంగా ఉంటాయో ఆ అణుహైడ్రైడ్లను ఎలక్ట్రాన్ అధిక హైడ్రేడ్లు అంటారు. 15 నుంచి 17 గ్రూపు వరకు గల మూలకాలన్ని ఈ రకమైన సమ్మేళనాలను ఏర్పరచును.
ఉదా: NH3 ఒక ఒంటరి ఎలక్ట్రాన్ జంటను, H2O రెండు ఒంటరి ఎలక్ట్రాన్ జంటలను, HF మూడు ఒంటరి ఎలక్ట్రాన్ జంటలను కలిగి ఉండును. కావున ఇవి అన్నీ లూయీ క్షారాల వలె ప్రవర్తించును.
అధిక ఋణవిద్యుదదాత్మకత గల N, O, F పరమాణువుల మీద ఒంటరి జంటల ఉనికి వల్ల హైడ్రైడ్లో అణువుల మధ్య హైడ్రోజన్ బంధాలు వస్తాయి. వీటి వల్ల అణువులలో సహచర్యం వస్తుంది.
![]()
ప్రశ్న 15.
ఇంధనంగా హైడ్రోజన్ ఉపయోగాన్ని గురించి కొన్ని వాక్యాలు వ్రాయండి. [May’13][AP,TS 17]
జవాబు:
- కోల్గ్యాస్, వాటర్ గ్యాస్ ల రూపంలో హైడ్రోజన్ ను పారిశ్రామిక ఇంధనంగా వాడతారు.
- ఆక్సీహైడ్రోజన్ బ్లోటార్చ్ సహాయంతో ప్లాటినం, క్వార్జ్ మొదలగువానిని కరిగించటం, వెల్డింగ్ చేయటం చేస్తారు.
- కార్బోరేటెడ్ వాటర్ గ్యాస్, సెమీవాటర్ గ్యాస్లను కూడా ఇంధనంగా ఉపయోగిస్తారు.
- హైడ్రోజన్ విద్యుత్ శక్తిని ఉత్పత్తి చేయుటకు ఇంధన ఘటాలతో ఉపయోగిస్తారు.
- చతుర్చక్ర వాహనాలలో 5% హైడ్రోజన్ ఉన్న CNG ని ఉపయోగిస్తారు.